初中科学浙教版八年级下册第2章 微粒的模型与符号第3节 原子结构的模型学案
展开原子结构的模型
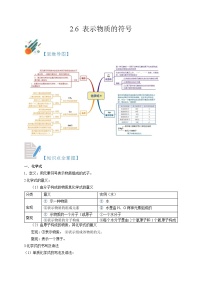
【思维导图】
【知识点全掌握】
模型与符号
模型
(1)模型的概念:模型是依照实物的形状和结构按比例制成的物品,是用来显示复杂事物或过程的表现手段,如图画、图表、计算机图像等。
(2)模型的分类:
= 1 \* GB3 ① 物体的复制品;② 事物变化的过程;③ 图片;④ 数学公式、表达式或特定的词。
(3)模型的作用:建立模型能帮助人们理解他们无法直接观察到的事物,如科学家们经常用模型来代表非常庞大或极其微小的事物(太阳系中的行星、细胞的细微结构等)。
符号
(1)符号的概念:符号是代表事物的标记。
(2)符号的作用:
= 1 \* GB3 ① 能简单明了地表示事物。
= 2 \* GB3 ② 可以避免由于事物外形不同而引起的混乱。
= 3 \* GB3 ③ 可以避免由于表达事物的文字语言不同而引起的混乱。
化学模型的建立
模型可以是实物的模型,一可以是事件的模型,模型能表达出研究对象的基本的特征。如:
= 1 \* GB3 ① 人们用水分子结构模型来了解水分子的构成:两个氢原子成104.5°角附在氧原子上;
比例模型 棍棒模型
= 2 \* GB3 ② 分子聚集成物质。
分子的构成
(1)分子是由原子构成的。
(2)分子构成的描述:以分子AmBn为例,1个AmBn分子由m个A原子和n个B原子构成。
如1个H2分子由2个H原子构成;1个O2分子由2个O原子构成;1个H2O分子由2个H原子和1个O原子构成。
物质的构成
(1)
分子是构成物质的一种基本粒子,有的物质是由原子直接构成的,如金属、金刚石、石墨等。由分子构成的物质在发生物理变化时,物质的分子本身没有变化;由分子构成的物质在发生化学变化时,它的分子起了变化,变成了别的物质的分子。所以,分子是保持物质化学性质的最小粒子。同种物质的分子,化学性质相同;不同种物质的分子,化学性质不同,分子不能保持物质的物理性质。
同种原子构成的物质,由于原子排列不同,可以构成不同的物质。如金刚石、石墨是由碳原子构成的,足球烯(C60)是由C60分子构成的。
金刚石 石墨 C60
分子和原子
(1)
(2)
区分不同的分子
(1)分子是构成物质的一种基本粒子,不同的分子构成不同的物质。由原子构成分子时:
① 相同的原子种类,不同的原子个数,能够成不同的分子。如O2分子与O3分子、CO分子与CO2分子、SO2分子与SO3分子等。
② 相同的原子个数,不同的原子种类,也能构成不同的分子。如H2与O2、N2,H2O与CO2、SO2,CO与N2,SO3与NH3等。
粒子的大小与质量
(1)分子和原子都有一定的质量和体积。
(2)原子的体积很小,原子半径一般在10-10m数量级。
(3)分子和原子的质量也非常小。氢分子是最轻的分子,其分子质量的数量级是10-27kg。
(4)不同种类的分子和原子质量不同,体积也不同。
(5)分子的特性:① 分子在不断运动;② 分子间有间隔。热胀冷缩就是分子间间隔发生改变的结果。
化学反应实质、模型的建立
(1)当水分子分解时,生成氢原子和氧原子,每两个氢原子又结合成一个氢分子,每两个氧原子结合成一个氧分子。
(2)结论: = 1 \* GB3 ① 分子是由原子构成的; = 2 \* GB3 ② 物质在发生化学变化时,分子分解成原子,原子重新组合形成新的分子。在化学变化中,分子是可以再分的,原子是不能再分的,原子是化学变化中的最小粒子。
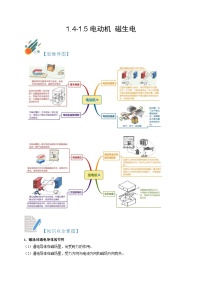
三、原子的构成
原子是“空心球体”,原子里有“很大”的空间,电子在绕核做高速运动。
原子核所带的电量和核外电子的电量相等,但电性相反,因此整个原子不显电性。对原子而言,核电荷数=质子数=核外电子数。
一般地,原子核内质子数小于或等于中子数。
原子的质量主要集中在原子核上。
质子和中子都是由更微小的基本粒子——夸克构成的。
原子符号()中X——原子种类,Z——质子数,A——质子数与中子数之和。
四、离子
概念:离子是带电荷的原子或原子团。
原子团是“原子的集团”,由几个原子组成,在许多化学反应里作为一个整体参加反应。
分类:
= 1 \* GB3 ① 阳离子:带正电荷;质子数大于电子数。
= 2 \* GB3 ② 阴离子:带负电荷;质子数小于电子数。
原子和离子的比较
【例题精析】
(2021•衢州)2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,如图为氚原子结构示意图,由图可知氚原子( )
A.含有2个质子B.核电荷数为1
C.相对原子质量为4D.质子数和中子数相等
(2021•杭州)有一种人造氢原子(可表示为 14H)的原子核中有3个中子,它可以结合成 14H2分子。 14H2分子中,下列微粒的个数不等于2的是( )
A.原子B.质子C.中子D.电子
(2022•温州)“原子﹣分子”学说的建立经历了曲折的过程。
材料一:1803年,道尔顿在原子论中提出元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖•吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖•吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原子论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖•吕萨克的矛盾。随后科学家们确立并逐步完善了“原子﹣分子”学说。
(1)1897年,汤姆生发现原子内有带负电的 ,否定了“原子不可再分”的观点。
(2)道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的 。
(3)依据道尔顿的原子论和盖•吕萨克的假说,下列反应能推导出“半个原子”的是 。(可多选)
A.1升氢气和1升氯气化合成2升氯化氢气体
B.2升氢气和1升氧气化合成2升水蒸气
C.木炭与1升氧气化合成1升二氧化碳
D.木炭与1升二氧化碳化合成2升一氧化碳
E.硫与1升氢气化合成1升硫化氢气体
(2020•浙江)人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,绝少数α粒子发生了较大角度的偏转。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 ;
(2)当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 (填字母)。
(2020•浙江)2019年诺贝尔化学奖颁发给了在锂电池领域作出重大贡献的吉野彰等三位科学家,分析回答下列问题:
(1)图甲是元素周期表中锂元素的相关信息,可知锂元素的原子核电荷数是 。
(2)图乙表示锂原子转变为锂离子的过程,锂离子符号可表示为 。
(2022•湖州)微粒间的相互作用使物质的结构具有一定的层次,例如:
(1)构成水的水分子聚集在一起而不散开是因为 。
(2)水分子中含有氧原子,氧原子中电子绕核运动而不离开原子核是因为 。
(3)氧原子核中含有8个质子,每个质子都带1个单位正电荷,为什么这些质子聚集在一起而不散开,请你提出一个合理的猜测。
(2020•衢州)用高能粒子轰击原子核是研究微观粒子的一种方法。1934年,意大利科学家费米用中子轰击铀原子(质子数为92,元素符号为U),得到了一种质量增加的原子,他公开宣布发现了93号元素,被科学界认可,从而获得了诺贝尔物理学奖。
1938年,德国科学家哈恩在重复费米的实验后,发现费米实验中得到的是56号钡元素,并用图示模型来定义这一变化。费米知道后,立即重复哈恩的实验,结果证实自己错了,费米坦率地检讨并纠正了错误。
(1)费米用中子轰击铀原子,不可能增加铀原子的 数,所以得不到93号元素。
(2)结合材料分析,以下观点正确的是 。
A.面对前人的观点要敢于质疑
B.科学结论的得出要依据客观事实
C.对科学的认识是一个不断修正、完善的过程
【习题巩固】
一.选择题(共14小题)
1.下列各项中,不属于模型的是( )
A.ρ=mV密度公式B.甲烷分子结构
C.北京冬奥会会徽D.空气成分
2.下列各组微粒中,含有相同质子数和电子数的组是( )
A.Al3+、AlB.K+、NH3C.N2、COD.NO、CO2
3.英国理论物理学家保罗•狄拉克在1928年通过数学方法预言了反粒子的存在,他认为每一种粒子都应有一个和它质量、带电量相等,而电性却正好相反的反粒子存在。近年来,夏威夷联合天文中心的科学家在宇宙深处发现H3+离子,据此推测反H3+离子的结构是( )
A.由三个带正电荷的质子与两个带正电荷的电子构成
B.由三个带负电荷的质子与两个带正电荷的电子构成
C.由两个带正电荷的质子与三个带负电荷的电子构成
D.由两个带负电荷的质子与三个带正电荷的电子构成
4.医学上用碘的同位素治疗甲亢已非常普遍。从1942年第一例放射性元素碘﹣131治疗甲亢以来有效性和安全性就得到了充分的证实。已知碘﹣131原子的核电荷数为53,中子数为78,则该原子核外电子数为( )
A.25B.53C.78D.131
5.同位素标记可以追踪有关反应中有关原子的去路,16O与18O是氧的二种同位素原子。1939年,美国科学家鲁宾和卡门利用某种植物,采用同位素标记法进行了如下实验:第一组:H218O+C16O2→某种植物→18O2,第二组:H216O+C18O2→某种植物→16O2.关于该实验,有关叙述不正确的是( )
A.实验目的是为了研究光合作用制造的氧来自于水还是二氧化碳
B.第二组实验是没必要做的
C.16O与18O两种原子质子数相同,中子数不同,化学性质相同
D.为了得到科学结论,此实验应该在密闭的容器里进行,重复多次
6.月球氦﹣3是在宇航员采集到的月球岩石样本中发现的一种储量惊人的新物质,该物质可以与氘一同参与核聚变反应堆反应,释放出大量能量。如图是氦﹣3原子结构示意图,以下说法错误的是( )
A.质子和中子可分,它们由更小的微粒构成
B.氦﹣3原子由原子核和核外电子构成
C.氦﹣3原子核内有2个质子和一个中子
D.氦元素在周期表中的原子序数3
7.我们考试填涂答题卡专用的2B铅笔如图甲,其笔芯主要成分是石墨和黏合剂,石墨由碳原子直接构成,碳原子结构模型如图乙所示,下列有关说法正确的是( )
A.中子的质量相对于带电的质子和电子,可以忽略
B.所有原子中,质子数=中子数=核外电子数
C.质子和中子由更小的、不能再分的夸克构成
D.原子核内质子带正电,核外电子带负电
8.如图甲是卢瑟福用带正电的a粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构。下列说法中错误的是( )
A.通过该实验可知原子内部绝大部分是空的
B.a粒子可能是某种原子的原子核
C.原子核式结构模型完美地揭示了原子真实的结构
D.卢瑟福在研究过程中采用了模型法
9.为了探究宇宙起源,“阿尔法磁谱仪”(AMS)将在太空中寻找“反物质”。所谓“反物质”是由“反粒子”构成的。“反粒子”与其对应的正粒子具有相同的质量和相同的电荷量,但电荷的符号相反,则反氢原子是( )
A.由1个带负电荷的反质子和1个带正电荷的反电子构成
B.由1个带负电荷的反质子和1个带负电荷的反电子构成
C.由1个不带电荷的中子和1个带正电荷的反电子构成
D.由1个带正电荷的质子和1个带负电荷的电子构成
10.有3 种不同的原子,甲原子核内有8个质子和9个中子,乙原子核内有8个质子和8个中子,丙原子核内有7 个质子和8个中子.下列说法正确的是( )
A.甲和乙是同一种元素B.甲和乙的核电荷数不同
C.乙和丙核外电子数相等D.乙和丙互为同位素原子
11.如图是卢瑟福将带正电的a粒子流轰击金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
B.绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
C.绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
D.绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
12.臭氧(O3)、二氧化氯(ClO2)、双氧水(H2O2)等物质都是生产、生活中常用的消毒剂,这三种物质都含有( )
A.氧分子B.氧离子C.氧气D.氧元素
13.关于分子、原子、离子的下列说法中,错误的是( )
A.分子、原子、离子都是在不断运动的粒子
B.分子是由原子构成的一种粒子
C.分子、原子、离子都是不显电性的粒子
D.分子、原子、离子都是构成物质的基本粒子
14.构成物质的粒子有分子、原子、离子等。下列叙述不正确的是( )
A.从分子的角度看,糖水和水的本质区别在于前者含有多种分子,后者只含一种分子
B.金刚石、石墨、C60都是由碳元素组成的单质,保持它们化学性质的最小粒子都是碳原子
C.氧气和臭氧都由氧元素组成,但二者化学性质差异很大,是由于构成它们的分子不同
D.二氧化硫、液氧都是由分子构成的,氦气、铁水都是由原子构成的,碳酸钙则是由离子构成的
二.填空题(共2小题)
15.对原子结构模型的形成,汤姆生、卢瑟福和玻尔等科学家做出了突出贡献。请根据所学完成下列有关问题。
(1)汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子是 。
(2)1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氢原子核)散射实验,为建立现代原子理论打下了基础、如图A、B、C、D四条线中,不可能是α粒子在该实验中的运动轨迹的是 。
16.人类对原子结构的认识永无止境。请根据所学知识回答:
(1) 认为原子的模型是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均 (填“正确”或“错误”)的。
(2)卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由带电荷的原子核和 构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个 。
A.建立模型的过程
B.得出结论的过程
C.提出问题的过程
D.验证证据的过程
(3)卢瑟福在α散射实验中(α粒子带正电荷),认为原子中的绝大部分空间是空的,他的依据是: 。
(4)如上图乙是某原子结构模型,它表示了原子核在原子中所占体积很小,但它几乎集中了原子的全部 。
三.实验探究题(共1小题)
17.科学理论的建立要有一个又一个的证据。在研究原子结构的历史进程中,卢瑟福揭开了原子世界的一个又一个的奥秘,请回答:
(1)1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,用一些高速运动的α粒子轰击金箔,发现多数α粒子穿过金箔后仍保持原来的运动方向,但有少数α粒子发生了较大角度的偏转,而极少数α粒子发生反弹,下列说法正确的有
A.多数α粒子保持原来的运动方向,说明原子核的体积很小
B.少数α粒子发生较大角度偏转,说明原子核带负电
C.极少数α粒子发生反弹,说明原子核的质量很大
(2)1919年,卢瑟福用加速了的高能α粒子轰击氮原子。结果有种微粒从氮原子中被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒一定是 。
四.解答题(共1小题)
18.对于同一种元素的不同原子而言,质子数是唯一确定的,但中子数却可能不同。质子数相同而中子数不同的原子,互称同位素。所有原子都有同位素。
资料一:氢有氕、氘、氚三种同位素,它们在元素周期表中处于同一个位置,化学性质与核外电子数有关,其原子结构如图所示。
资料二:氢的三种同位素可以分别表示为1H、2H、3H,它们都会与氧反应生成水,生成物叫做轻水1H2O、重水2H2O及超重水3H2O,它们的化学性质相同。
资料三:同位素构成的物质中,物理性质可能不同。在标准状况下,轻水的密度是1.0g/cm3,重水的密度却是1.105g/cm3。请分析资料,结合水的微观结构解释“轻水”和“重水”性质异同的原因。
粒子种类
原子
离子
阳离子
阴离子
区别
粒子结构
核内质子数=核外电子数
核内质子数>核外电子数
核内质子数<核外电子数
粒子电性
中性
正电
负电
联系
初中浙教版第4节 二氧化碳学案: 这是一份初中浙教版第4节 二氧化碳学案,文件包含34二氧化碳原卷版docx、34二氧化碳解析版docx等2份学案配套教学资源,其中学案共34页, 欢迎下载使用。
初中科学浙教版八年级下册第3节 化学方程式学案: 这是一份初中科学浙教版八年级下册第3节 化学方程式学案,文件包含33化学方程式原卷版docx、33化学方程式解析版docx等2份学案配套教学资源,其中学案共32页, 欢迎下载使用。
浙教版八年级下册第2章 微粒的模型与符号第7节 元素符号表示的量学案设计: 这是一份浙教版八年级下册第2章 微粒的模型与符号第7节 元素符号表示的量学案设计,文件包含27元素符号表示的量原卷版docx、27元素符号表示的量解析版docx等2份学案配套教学资源,其中学案共26页, 欢迎下载使用。