





所属成套资源:新教材2023版高中化学鲁科版选择性必修1课件(27份)
- 新教材2023版高中化学第3章物质在水溶液中的行为第1节水与水溶液第1课时水的电离电解质在水溶液中的存在形态课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第1节水与水溶液第2课时水溶液的酸碱性与pH课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第2课时盐类的水解课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第3课时盐类水解的应用课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第3节沉淀溶解平衡课件鲁科版选择性必修1 课件 0 次下载
化学第2节 弱电解质的电离 盐类的水解集体备课ppt课件
展开
这是一份化学第2节 弱电解质的电离 盐类的水解集体备课ppt课件,共60页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,电离平衡,电离能力,相对强弱,已电离的溶质分子数,本身的性质,答案D等内容,欢迎下载使用。
素养新目标1.了解弱电解质的电离平衡常数概念和电离平衡常数与电离程度的关系。2.理解影响弱电解质电离平衡的因素对电离平衡移动的影响。3.了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱。
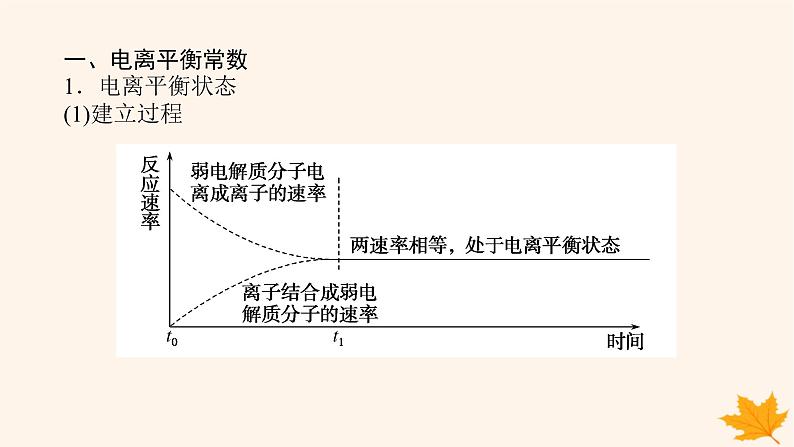
一、电离平衡常数1.电离平衡状态(1)建立过程
(2)电离平衡:弱电解质的电离平衡指在一定条件下(温度、浓度)弱电解质分子电离成离子的速率和离子结合成分子的速率相等时的状态。电离平衡是化学平衡的一种,同样具有化学平衡的特征,条件改变时平衡移动的规律符合勒夏特列原理。(3)特点:电离平衡是动态平衡,弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行且速率相等。
2.电离平衡常数(1)概念在一定条件下达到________时,弱电解质电离形成的各种_____的浓度_____与溶液中未电离的_____的浓度之比。电离平衡常数简称电离常数。(2)影响因素电离常数服从化学平衡常数的一般规律,它只与_____有关,由于电离过程是_____过程,升温,K值_____。(3)应用电离常数表征了弱电解质的________,根据相同温度下电离常数的大小可以判断弱电解质电离能力的________,K越大,表示弱电解质的电离程度_____,弱酸的酸性或弱碱的碱性相对_____。
3.电离度(1)概念:弱电解质在水中的电离达到平衡状态时,_________________占原有溶质分子数(包括已电离的和未电离的)的百分率。(2)表达式:α=________________×100%。状元随笔 电离常数表达的意义(1)电离常数只随温度变化,与浓度无关。(2)电离常数的大小反映了弱电解质的电离程度。K值越大,弱电解质越易电离,其对应的弱酸(弱碱)越强;反之,K值越小,弱电解质越难电离,其对应的弱酸(弱碱)越弱。即根据K值的大小可判断弱电解质的相对强弱。(3)多元弱酸是分步电离的,一级电离程度最大,一般有Kal≫Ka2≫Ka3。
二、影响电离平衡的因素1.弱电解质电离程度的大小是由电解质__________决定的。2.反应条件对弱电解质的电离平衡的影响:
状元随笔 电离平衡的移动完全符合勒夏特列原理,可将勒夏特列原理迁移到电离平衡的移动(电离度相当于转化率,离子浓度相当于生成物的平衡浓度,分子浓度相当于反应物的平衡浓度等)中来。
2.食醋的主要成分是醋酸,已知在不同温度下,测定一定浓度的CH3COOH溶液中H+的浓度,则结果是( )A.缺少条件,无法测定B.H+的浓度相同C.温度低时,H+的浓度大D.温度高时,H+的浓度大
解析:CH3COOH是弱电解质,温度升高时,CH3COOH的电离程度增大,则溶液中H+的浓度也增大。
3.(双选)下列关于电离常数(K)的说法中正确的是( )A.电离常数(K)越小,表示弱电解质电离能力越弱B.电离常数(K)与温度无关C.不同浓度的同一弱电解质,其电离常数(K)不同D.多元弱酸各步电离常数相互关系为Ka1≫Ka2≫Ka3
解析:电离常数表示电离程度的大小,K值越大,电离程度越大。电离常数是一个温度的函数,温度不变时电离常数不变。多元弱酸的电离常数关系为Ka1≫Ka2≫Ka3。
4.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 ml,下列叙述错误的是( )A.与NaOH完全中和时,醋酸所消耗的NaOH多B.分别与足量CaCO3反应时,放出的CO2一样多C.两种溶液的pH相等D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
解析:体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 ml,根据二者的电离方程式可知,二者电离出的c平(H+)相同,故pH相等,C项正确;由于CH3COOH不能完全电离,因此n(CH3COOH)>n(HCl),故与NaOH完全中和时,醋酸消耗的NaOH多,分别与足量CaCO3反应时,醋酸参与的反应放出的CO2多,A项正确、B项错误;分别用水稀释相同倍数时,醋酸的电离程度增大,n(CH3COO-)增大,而n(Cl-)不变,D项正确。
5.(双选)部分弱酸的电离平衡常数如下表:
状元随笔 (1)弱酸或弱碱的电离平衡向右移动,其电离程度不一定增大,电解质分子的浓度不一定减小,离子的浓度不一定增大。(2)弱酸或弱碱加水稀释时,溶液中不一定所有离子浓度都减小。如稀醋酸加水稀释时,c平(OH-)增大,其他离子浓度均减小。(3)对于浓的弱电解质溶液,如冰醋酸加水稀释的过程弱电解质的电离程度逐渐增大,但离子浓度先增大后减小。(4)分析弱电解质微粒浓度变化时,要注意平衡移动时相关量的变化程度与溶液体积变化程度的相对大小。
关键能力影响因素(1)内因弱电解质本身的性质,如相同条件下CH3COOH电离程度大于H2CO3。(2)反应条件以CH3COOH⇌CH3COO-+H+ ΔH>0为例:
目标二 弱电解质强弱判断例2 下列事实一定能证明HNO2是弱电解质的是( )①常温下NaNO2溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④0.1 ml·L-1 HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥0.1 ml·L-1 HNO2溶液稀释至100倍,pH约为3.9A.①④⑥ B.①②③④C.①④⑤⑥ D.全部
状元随笔 三角度判断电解质的强弱角度一:是否存在电离平衡(1)同温度、同浓度的强酸溶液的导电性强于弱酸溶液的导电性。(2)pH相同的强酸和弱酸,弱酸的物质的量浓度大于强酸的物质的量浓度,酸体积相等时,与足量的活泼金属反应,产生H2多的是弱酸。(3)相同pH、相同体积的强酸和弱酸,当加水稀释相同倍数时,pH变化大的为强酸,pH变化小的为弱酸。(4)稀释浓的弱酸溶液,一般是c(H+)先增大后减小;稀释浓的强酸溶液,c(H+)一直减小。(5)相同pH、相同体积的强酸和弱酸分别与等物质的量的同元强碱发生中和反应后,若溶液呈中性,则该酸为强酸;若溶液呈酸性,则该酸为弱酸。(6)中和相同体积、相同pH的强酸和弱酸,弱酸的耗碱量多于强酸。
角度二:是否存在水解平衡(1)测定相应强碱盐的酸碱性,强酸强碱盐不水解,溶液呈中性;弱酸强碱盐水解,溶液显碱性,且水解程度越大的酸根对应的酸越弱。(2)相同浓度、相同体积的强酸和弱酸分别与等物质的量的同元强碱发生中和反应后,若溶液呈中性,则该酸为强酸;若溶液呈碱性,则该酸为弱酸。角度三:是否发生复分解反应(强酸可制备弱酸)根据复分解反应发生的条件可知,强酸可以和弱酸的盐反应生成弱酸和强酸的盐,或弱酸和更弱酸的盐反应生成更弱的酸。如盐酸能与石灰石反应生成二氧化碳,由此可判断酸性:盐酸>碳酸。
[提升2] 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )A.两溶液稀释前的浓度相同B.a、b、c三点溶液的pH由大到小的顺序为a>b>cC.a点的Kw比b点的Kw大D.a点水电离的c(H+)大于c点水电离的c(H+)
解析:A错,稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度。B错,导电能力越大,说明离子浓度越大,酸性越强,则a、b、c三点溶液的pH大小顺序为c<a<b。C错,相同温度下,Kw相同,a点的Kw等于b点的Kw。D对,a点离子浓度小于c点离子浓度,氢离子浓度越大,对水的电离抑制程度越大,则a点水电离的H+物质的量浓度大于c点水电离的H+物质的量浓度。
状元随笔 强、弱酸(碱)稀释时pH的变化规律(1)对于pH相同的强酸与弱酸(或强碱与弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大。这是因为强酸(或强碱)已完全电离,随着水的加入,溶液中H+(或OH-)数目不会增多(不考虑水的电离),浓度改变大,而弱酸(或弱碱)随着水的加入,电离程度增大,H+(或OH-)数目会增多,浓度改变小。
稀释时pH都向7靠近,但不越过7(2)对于物质的量浓度相同的强酸与弱酸(或强碱与弱碱),稀释相同的倍数,pH的变化幅度不同,强酸(或强碱)稀释后pH变化幅度大。
关键能力强、弱电解质的比较(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(见下表)
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(见下表)
下列叙述正确的是( )
状元随笔 关于电离平衡常数的理解(1)电离常数的大小由物质本身的性质决定,同一温度下,不同弱电解质的电离常数不同,K值越大,电离程度越大。(2)同一弱电解质在同一温度下改变浓度时,其电离常数不变。(3)电离常数K只随温度的变化而变化,升高温度,K值增大。(4)多元弱酸电离常数:Ka1≥Ka2≥Ka3……其酸性主要由第一步电离决定,Ka1值越大,相应酸的酸性越强。
[提升3] 下表是几种常见弱酸的电离平衡常数(25 ℃)
1.室温下,下列事实不能说明NH3·H2O为弱电解质的是( )A.0.1 ml·L-1氨水能使无色酚酞溶液变红色B.0.1 ml·L-1氨水pH小于0.1 ml·L-1 NaOH溶液的pHC.0.1 ml·L-1 NaOH溶液的导电能力比0.1 ml·L-1 氨水的导电能力强D.0.1 ml·L-1氨水的pH小于13
2.下列有关“电离平衡”的叙述中正确的是( )A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等B.达到电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡C.电离平衡是相对的、暂时的,反应条件改变时,平衡可能会发生移动D.电解质达到电离平衡后,各离子的浓度相等
3.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )A.V1=V2 B.V1<V2C.V1>V2 D.V1≤V2
6.25 ℃时,几种酸的电离平衡常数见下表:
(4)将体积均为10 mL pH=2的醋酸溶液与一元酸HX的溶液分别加水稀释至1 000 mL,稀释过程中溶液pH的变化如图所示,则HX的电离平衡常数_______(填“大于”“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c水(H+)________醋酸溶液中水电离出来的c水(H+)。
解析:体积均为10 mL的pH=2的醋酸溶液与一元酸HX的溶液分别加水稀释至1 000 mL,加水稀释变化大的酸性相对较强,因此根据稀释过程pH变化可知,HX的酸性比醋酸强,则HX的电离平衡常数大于醋酸的电离平衡常数,稀释后,HX溶液酸性比醋酸溶液酸性弱,对水电离抑制程度比醋酸抑制水电离的能力弱,因此HX溶液中水电离出来的c水(H+)大于醋酸溶液中水电离出来的c水(H+)。
练后反思1.根据电离常数计算的解题思路
相关课件
这是一份高中化学第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解教学演示课件ppt,共55页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,H+或OH-,弱电解质,OH-,影响因素,答案BC,答案B等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解课堂教学课件ppt,共15页。PPT课件主要包含了醋酸的电离方程式,外部因素,电离平衡常数,升高温度K值增大,H2CO3,43×10-7,56×10-11,cH+,第一步电离产生的H+,迁移应用等内容,欢迎下载使用。
这是一份化学选择性必修1第2节 弱电解质的电离 盐类的水解教课课件ppt,共56页。PPT课件主要包含了内容索引,知识铺垫,必备知识,盐的水解常数,自我检测,问题探究,归纳拓展,应用体验,答案B,答案D等内容,欢迎下载使用。










