




所属成套资源:新教材2023版高中化学鲁科版选择性必修1课件(27份)
- 新教材2023版高中化学第3章物质在水溶液中的行为第1节水与水溶液第2课时水溶液的酸碱性与pH课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第1课时弱电解质的电离平衡课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第3课时盐类水解的应用课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第3节沉淀溶解平衡课件鲁科版选择性必修1 课件 0 次下载
- 新教材2023版高中化学第3章物质在水溶液中的行为第4节离子反应第1课时离子反应发生的条件课件鲁科版选择性必修1 课件 0 次下载
高中化学第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解教学演示课件ppt
展开
这是一份高中化学第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解教学演示课件ppt,共55页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,H+或OH-,弱电解质,OH-,影响因素,答案BC,答案B等内容,欢迎下载使用。
素养新目标1. 理解盐类水解的本质,能解释强酸弱碱盐和强碱弱酸盐的水解。2.能运用盐类水解的规律判断盐溶液的酸碱性,会书写盐类水解的离子方程式。3.了解影响盐类水解平衡的因素,能多角度、动态地分析反应条件对盐类水解平衡的影响。
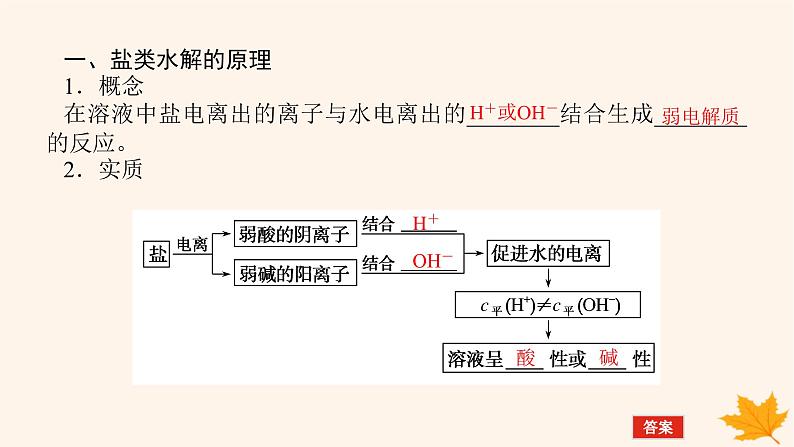
一、盐类水解的原理1.概念在溶液中盐电离出的离子与水电离出的________结合生成________的反应。2.实质
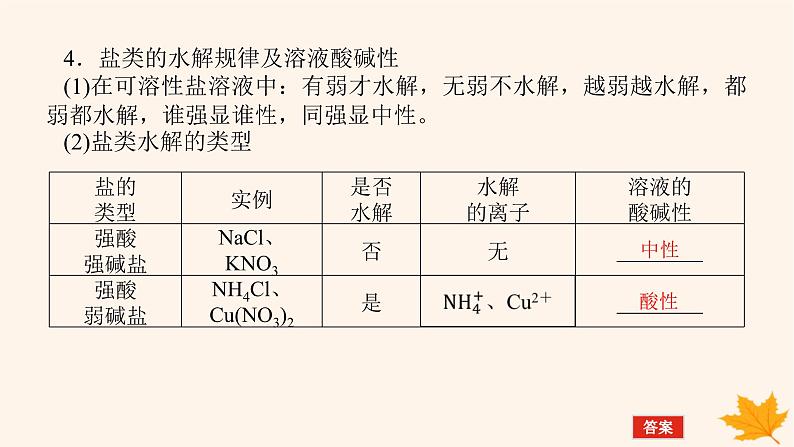
4.盐类的水解规律及溶液酸碱性(1)在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。(2)盐类水解的类型
5.表示方法(1)用化学方程式表示:盐+水⇌酸+碱。如NH4Cl的水解:__________________________。(2)用离子方程式表示:盐的离子+水⇌酸(或碱)+OH-(或H+)。如NH4Cl的水解:________________________。
NH4Cl+H2O⇌NH3·H2O+HCl
(3)多元弱酸酸根离子的水解应分步书写:如Na2CO3的水解:_________________________,________________________,多元弱碱阳离子的水解实际是分步进行的,习惯只写一步,如Fe3+的水解:___________________________。
Fe3++3H2O⇌Fe(OH)3+3H+
状元随笔 盐类的水解条件(1)盐必须溶于水。(2)盐中必须有弱酸酸根离子或弱碱阳离子。注:盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。如相同浓度的Na2CO3和CH3COONa溶液的pH前者大于后者。即“越弱越水解”。
二、影响盐类水解平衡的因素1.盐类水解的特征(1)盐类的水解是_____反应。(2)加水稀释能_____盐类的水解。
3S2-+2Al3++6H2O===3H2S↑+2Al(OH)3↓
状元随笔 分析水解平衡移动时的注意事项(1)水解平衡正向移动,离子的水解程度不一定增大。若升高温度水解平衡正向移动,离子的水解程度增大,若增大离子的浓度使水解平衡正向移动,离子的水解程度反而减小。(2)温度不变,水解平衡移动,水解平衡常数不变。水解平衡常数只与温度有关。
解析:多元弱酸酸根离子分步水解,多元弱碱阳离子水解一步写出,故A错误,C正确;B正确;D应用“⇌”连接。
3.水溶液呈酸性的是( )A.NaCl B.NaHSO4C.HCOONa D.NaHCO3
解析:NaCl是强酸强碱盐,其水溶液呈中性,A错误;NaHSO4是强酸的酸式盐,其水溶液呈酸性,B正确;HCOONa属于强碱弱酸盐,其水溶液呈碱性,C错误;NaHCO3是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D错误。
4.下列有关盐类水解的说法不正确的是( )A.盐类的水解过程破坏了纯水的电离平衡B.盐类的水解是酸碱中和反应的逆过程C.盐类水解的结果使溶液不一定呈中性D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
状元随笔 主要因素是盐本身的性质,组成盐的弱酸阴离子对应的酸越弱或弱碱阳离子对应的碱越弱,水解程度就越大(越弱越水解)。(1)不同弱酸对应的盐(溶液浓度相同):碱性NaClO(aq)>NaHCO3(aq);对应酸的酸性HClOH3PO4>HF>CH3COOH>H2CO3>H2S>H2SiO3>HClO。(2)不同弱碱对应的盐(溶液浓度相同):酸性MgCl2(aq)Al(OH)3。
(3)同一弱酸对应的盐(溶液浓度相同):碱性Na2CO3(aq)>NaHCO3(aq);正盐的水解程度>酸式盐的水解程度。(4)多元弱酸对应的酸式盐:一般来说,水解趋势>电离趋势(NaH2PO4和NaHSO3例外,电离趋势>水解趋势)。pH:Na2SO3>Na2SO4>NaHSO3>NaHSO4;Na3PO4>Na2HPO4>NaH2PO4>H3PO4。(5)弱酸弱碱盐:水解程度较大。
目标二 溶液中离子浓度大小的比较例2 室温下,下列溶液中有关物质的量浓度的关系错误的是( )A.0.1 ml·L-1 pH=6的NaHA溶液中:c(HA-)>c(H+)>c(A2-)>c(H2A)B.pH相等的HCl溶液和NH4Cl溶液:c(HCl)c(CH3COOH)B.在M点时,n(OH-)-n(H+)=(a-0.05) mlC.当n(NaOH)=0.001 ml时,2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)D.ac(CH3COO-)>c(CH3COOH)。B错,在M点,c(CH3COOH)=c(CH3COO-)=0.05 ml·L-1,可得n(CH3COOH)=n(CH3COO-)=0.001 ml,溶液中存在电荷守恒n(Na+)+n(H+)=n(CH3COO-)+n(OH-),且n(Na+)=a ml,所以n(OH-)-n(H+)=(a-0.001) ml。C对,当n(NaOH)=0.001 ml时,醋酸只被中和了一半,反应后的溶液中醋酸和醋酸钠的物质的量相等,电荷守恒关系为①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒关系为②c(CH3COOH)+c(CH3COO-)=2c(Na+),①×2+②得:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-)。D对,当n(NaOH)=0.001 ml时,溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,溶液中c(CH3COO-)>c(CH3COOH),而M点,c(CH3COOH)=c(CH3COO-)=0.05 ml·L-1,可推知ac平(H+)>c平(CH3COO-)>c平(OH-)。(2)水解平衡→建立水解过程是“微弱”的意识。弱酸阴离子或弱碱阳离子的水解是微弱的,但水的电离程度远远小于盐的水解程度。如稀的CH3COONa溶液中,CH3COONa===CH3COO-+Na+,CH3COO-+H2O⇌CH3COOH+OH-,H2O⇌H++OH-,所以CH3COONa溶液中,c平(Na+)>c平(CH3COO-)>c平(OH-)>c平(CH3COOH)>c平(H+)。
1.NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子为( )A.NH2D·H2O和D3O+B.NH3·D2O和HD2O+C.NH3·HDO和D3O+D.NH2D·HDO和H2DO+
3.(双选)在常温下,纯水中存在电离平衡H2O⇌H++OH-,如要使水的电离程度增大,并使c平(H+)增大,应加入的物质是( )A.NaHSO4 B.KAl(SO4)2C.NH4Cl D.CH3COONa
4.25 ℃时,在1.0 L浓度均为0.01 ml·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c平(Na+)>c平(A-),则下列描述不正确的是( )A.该溶液的pH<7B.HA为弱酸,A-的水解程度较大C.c平(A-)+c平(HA)=0.02 ml·L-1D.n(A-)+n(OH-)=0.01 ml+n(H+)
A.随温度升高,纯水中c(H+)>c(OH-)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向相同
5.(双选)实验测得0.5 ml·L-1 CH3COONa溶液、0.5 ml·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
解析:升高温度,促进水的电离,但纯水中的c(H+)=c(OH-),故A错误;升高温度既促进水的电离,又促进醋酸钠的水解,使溶液中c(OH-)增大,故B错误;升高温度既促进水的电离,Kw增大,又促进铜离子的水解,使其水解平衡正向移动,这相当于促进了氢氧根离子与铜离子结合,最终的结果是氢离子剩余,导致pH减小,故C正确;随温度升高,CH3COO-、Cu2+水解平衡均正向移动,故D正确。
6.中和反应是指酸和碱互相交换成分,生成盐和水的反应。实质是H++OH-===H2O。常温下,向100 mL 0.01 ml·L-1 HA溶液中逐滴加入0.02 ml·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为____ (填“强”或“弱”)酸,理由是___________________________________________。(2)常温下一定浓度的MA稀溶液的pH=a,则a____ (填“>”“”“c平(A-)>c平(OH-)>c平(H+)。(4)由物料守恒得c平(M+)+c平(MOH)=2c平(A-),由电荷守恒得c平(M+)+c平(H+)=c平(A-)+c平(OH-),故c平(MOH)+c平(OH-)=c平(A-)+c平(H+)≈0.005 ml·L-1。
相关课件
这是一份化学选择性必修1第2节 弱电解质的电离 盐类的水解教课ppt课件,共38页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,饱和FeCl3,酒精灯,激光笔,红褐色,FeOH3胶体,Al2SO43等内容,欢迎下载使用。
这是一份化学第2节 弱电解质的电离 盐类的水解集体备课ppt课件,共60页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,电离平衡,电离能力,相对强弱,已电离的溶质分子数,本身的性质,答案D等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解授课课件ppt,共56页。PPT课件主要包含了内容索引,知识铺垫,必备知识,热碱水清洗油污,自我检测,问题探究,归纳拓展,应用体验,答案D,答案C等内容,欢迎下载使用。










