
江苏省名校2024年高考化学模拟卷(二)(含解析)
展开可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cr 52 Fe 56 Cu 64 Ce 140
第Ⅰ卷
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. “碳中和”是指的排放总量和减少总量相当。下列措施中促进碳中和最直接有效的是
A.将重质油裂解为轻质油作为燃料B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染D.研发新型催化剂促使转化为甲醇
2.亚硝酰氟(FNO)是一种工业稳定剂,可通过反应N2O4 +CsF=FNO+CsNO3制得。下列说法正确的是
A.氧原子的结构示意图为B.CsF的电子式为
C.FNO的空间构型为直线形D.CsNO3中含有离子键与共价键
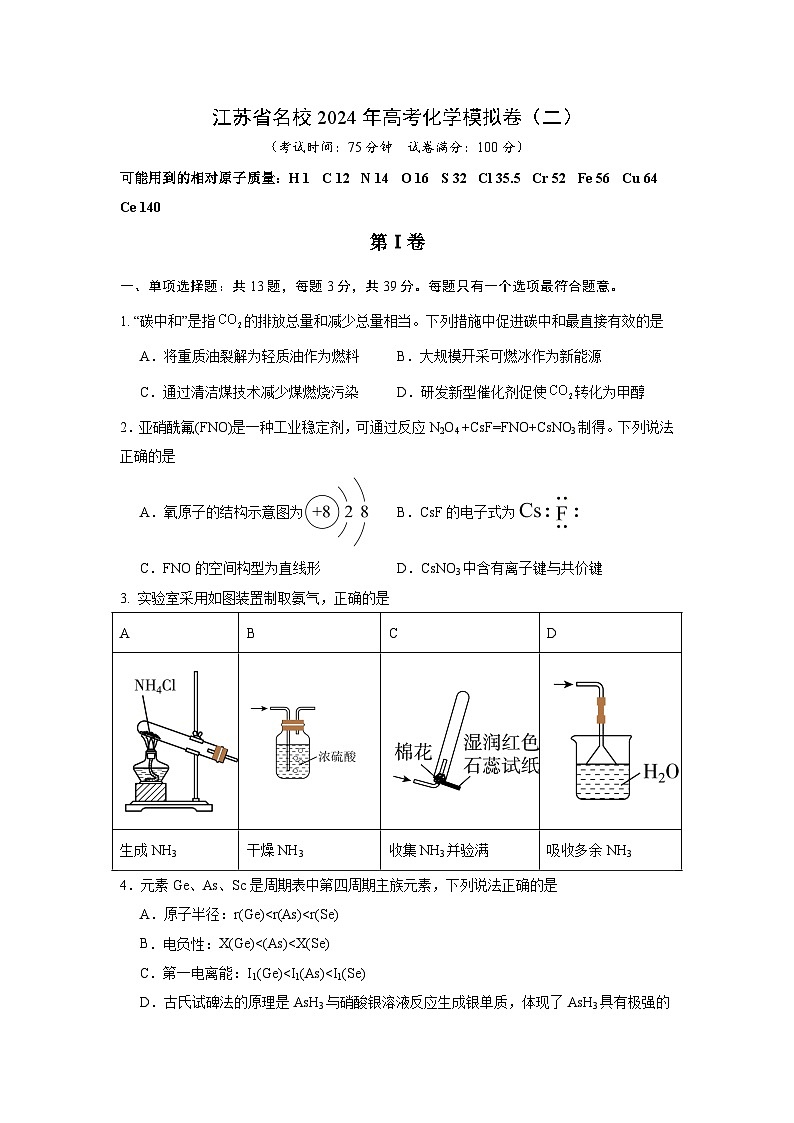
3. 实验室采用如图装置制取氨气,正确的是
4.元素Ge、As、Sc是周期表中第四周期主族元素,下列说法正确的是
A.原子半径:r(Ge)
阅读下列材料,回答5~7题:
ⅤA族元素氮、磷、砷(As)、锑(Sb)及其化合物应用广泛。NH3催化氧化生成NO,NO继续被氧化为NO2,将NO2通入水中制取HNO3。工业上用白磷(P4)与Ba(OH)2反应生成PH3和一种盐,该盐可与H2SO4反应制备一元中强酸H3PO2。雌黄(As2S3)和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4(沸点114 ℃)并放出H2S气体。锑是带有银色光泽的灰色金属,其氧化物Sb2O3可用于制造耐火材料;锑能与铅形成用途广泛的合金。
5. 下列说法正确的是( )
A. SnCl4是由极性键形成的非极性分子
B. P4是正四面体形分子,其中P—P—P夹角为109°28′
C. ⅤA族元素单质的晶体类型相同
D. 基态砷原子(33As)核外电子排布式为3d104s24p3
6.下列化学反应表示错误的是( )
A. NO2制HNO3的离子方程式:3NO2+H2O===2H++2NO eq \\al(-,3) +NO
B. 白磷与Ba(OH)2溶液反应:2P4+3Ba(OH)2+6H2O===3Ba(H2PO2)2+2PH3↑
C. H3PO2与足量的NaOH溶液反应的离子方程式:H++OH-===H2O
D. 雌黄制备雄黄的化学方程式:2As2S3+2SnCl2+4HCl===As4S4+2SnCl4+2H2S↑
7.下列物质性质与用途具有对应关系的是( )
A. 氨气易液化,可用于工业制硝酸
B. 五氧化二磷能与水反应,可用于干燥氨气
C. 三氧化二锑的熔点高,可用于制造耐火材料
D. 锑铅合金导热性好,可用作铅酸电池的电极材料
8.用废铜屑(含Cu、CuO、Fe2O3等)制备胆矾的流程如下:
下列说法不正确的是( )
A. “溶解”时,铜发生反应的离子方程式为Cu+4H++O eq \\al(2-,2) ===Cu2++2H2O
B. “调pH”时,可用Cu2(OH)2CO3代替CuO
C. “滤液”中c(Cu2+)·c2 (OH-)≤Ksp[Cu(OH)2]
D. “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
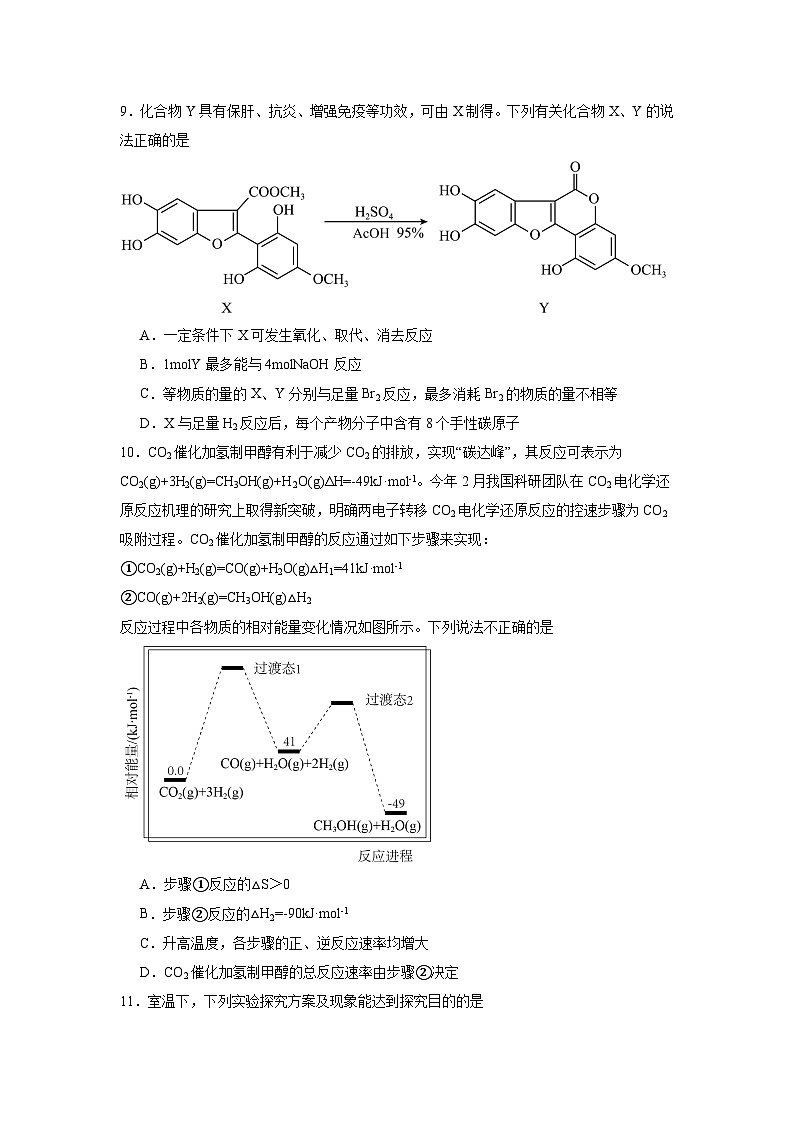
9.化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是
A.一定条件下X可发生氧化、取代、消去反应
B.1mlY最多能与4mlNaOH反应
C.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量不相等
D.X与足量H2反应后,每个产物分子中含有8个手性碳原子
10.CO2催化加氢制甲醇有利于减少CO2的排放,实现“碳达峰”,其反应可表示为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH=-49kJ·ml-1。今年2月我国科研团队在CO2电化学还原反应机理的研究上取得新突破,明确两电子转移CO2电化学还原反应的控速步骤为CO2吸附过程。CO2催化加氢制甲醇的反应通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)△H1=41kJ·ml-1
②CO(g)+2H2(g)=CH3OH(g)△H2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是
A.步骤①反应的△S>0
B.步骤②反应的△H2=-90kJ·ml-1
C.升高温度,各步骤的正、逆反应速率均增大
D.CO2催化加氢制甲醇的总反应速率由步骤②决定
11.室温下,下列实验探究方案及现象能达到探究目的的是
12.为二元弱碱。室温下,配制一组的与的混合溶液,溶液中相关组分的物质的量分数随溶液pH变化的曲线如下图所示,下列说法正确的是
A.由图可知的
B.的溶液中:
C.等物质的量的和混合溶液中
D.在的水溶液中,
13.CO2CH4重整可获得H2。CO2CH4重整反应的热化学方程式如下。
反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH1=247 kJ·ml-1。
反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g);ΔH2=41 kJ·ml-1。
反应Ⅲ:CH4(g)===C(s)+2H2(g);ΔH3=75 kJ·ml-1。
1.01×105 Pa下,将n起始(CO2)∶n起始(CH4)=1∶1的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法不正确的是( )
A. 曲线X表示CO2
B. 反应CH4(g)+3CO2(g)===4CO(g)+2H2O(g)进行的程度很小
C. 500 ℃,1.01×105 Pa时,向平衡体系中再充入一定量的CO2,达新平衡后, eq \f(c(CO)·c(H2O),c(CO2)·c(H2)) 的值保持不变
D. 随着温度升高, eq \f(n(CO),n(H2)) 的值变小,原因是反应Ⅲ增大的程度小于反应Ⅱ增大的程度
第Ⅱ卷
二、非选择题:共4题,共61分。
14.(15分)铜-钢双金属废料和铜烟灰是铜的重要二次资源。
Ⅰ.从铜-钢双金属废料中浸出铜的工艺流程如下:
(1)25℃时,随溶液的不同,甘氨酸在水溶液中分别以、或为主要形式存在。内盐是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因: 。
(2)浸出剂的制备:主要原料有甘氨酸(简写为)、溶液和固体。取一定量固体溶于水,随后依次加入 (填“”或“”,下同)、 ,所得碱性浸出剂的主要成分为甘氨酸铜、等。
(3)浸出:将经打磨的铜钢废料投入浸出剂,控制温度50℃,通入空气,并搅拌。浸出剂不与钢作用,但与铜反应,最终铜全部转化为进入溶液,从而实现铜、钢分离。
①浸出时发生的反应过程为、 。
②其它条件不变时,空气流量对铜浸出速率的影响如图1所示。当空气流量超过时,铜浸出速率急剧下降的可能原因是 。
Ⅱ.从铜烟灰(主要成分为)中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
已知:溶于无机酸。
(4)酸浸:将铜烟灰用硫酸浸出,控制其他条件相同,铜浸出率与温度的变化关系如图2所示。随温度升高,铜浸出率先增大后减小的可能原因是 。
(5)萃取、反萃取:向浸出液(浓度为)中加入有机萃取剂萃取,其原理可表示为:(水层)(有机层)(有机层)(水层)。
向萃取所得有机相中加入硫酸,反萃取得到水相(浓度达)。该工艺中设计萃取、反萃取的目的是 。
15.(15分)有机物F是一种新型大环芳酰胺的合成原料,可通过以下方法合成:
(1)A中采用杂化方式的碳原子有 个。
(2)的反应类型为 。
(3)若B直接硝化,最后主要产物的结构简式为 。
(4)写出一种符合下列条件的B的同分异构体的结构简式: 。
①能与溶液发生显色反应;
②分子中含有2个苯环,共有3种不同化学环境的氢原子。
(5)已知:,写出以、和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(15分)实验室以氟碳铈矿(主要成分为CeFCO3)为原料制备CeO2粗品,并测定粗品中CeO2的含量。
(1) 酸洗。氟碳铈矿和浓硫酸发生反应,生成Ce2(SO4)3等。酸洗不宜在玻璃器皿中进行,其原因是 。
(2)焙烧。Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应方程式为_____________________。
(3)测定粗品中CeO2的含量。部分实验操作如下:
步骤Ⅰ 称取0.500 0 g样品置于锥形瓶中,加入蒸馏水和浓硫酸,边搅拌边加入双氧水,低温加热至样品反应完全。
步骤Ⅱ 煮沸,冷却后滴入催化剂硝酸银溶液,加入过量的(NH4)2S2O8溶液,将Ce(Ⅲ)氧化为Ce(Ⅳ),低温加热至锥形瓶中无气体产生[2(NH4)2S2O8+2H2O eq \(=====,\s\up7(△)) 4NH4HSO4+O2↑]。再次煮沸、冷却,用硫酸亚铁铵标准溶液滴定。
① “步骤Ⅰ”中加入双氧水的作用是 。
② “步骤Ⅱ”中“再次煮沸”的时间不宜太短,其原因是 。
③ 请补充完整制备(NH4)2Fe(SO4)2·6H2O晶体的实验方案:称取一定质量的铁粉, ,
低温干燥,即可得到硫酸亚铁铵晶体。
已知:(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2·6H2O。
须使用的试剂:1 ml·L-1 H2SO4溶液、95%的乙醇溶液、(NH4)2SO4固体。
17.(16分)苯乙烯是合成橡胶和塑料的重要原料,可由乙苯为原料制得。
(1) 利用“乙苯脱氢反应”可制备苯乙烯。
C6H5C2H5(g)⇌C6H5CH===CH2(g)+H2(g);ΔH=a kJ·ml-1
图1
保持气体总压不变,原料气按以下A、B、C三种投料方式进行:
A. 乙苯
B. n(乙苯)∶n(N2)=1∶10
C. n(乙苯)∶n(CO2)=1∶10
三种投料分别达到平衡时,乙苯转化为苯乙烯的转化率[ eq \f(n(C6H5CHCH2),n总(C6H5C2H5)) ×100%]与温度的关系如图1所示。
① a (填“>”“<”或“不能确定”)0。
② 相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是______________________。
③ 相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是________________________。
④ 工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2,可较长时间内保持催化剂的催化活性,其原因是 。
(2)CO2用于制备苯乙烯有助于实现“碳中和”。
①在催化剂X作用下,CO2参与反应的机理如图2所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。根据元素电负性的变化规律,图2所示的反应机理中步骤Ⅰ和步骤Ⅱ可描述为___________________________________________________。
图2
图3
②保持混合气体总压(p)等其他条件不变,CO2的分压[p(CO2)= eq \f(n(CO2),n(乙苯)+n(CO2)) ×p]与乙苯转化率的关系如图3所示。p(CO2)>14 kPa时,乙苯转化率下降的原因是_________________________________。
江苏省名校2024年高考化学模拟卷(二)(解析版)
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Cr 52 Fe 56 Cu 64 Ce 140
第Ⅰ卷
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. “碳中和”是指的排放总量和减少总量相当。下列措施中促进碳中和最直接有效的是
A.将重质油裂解为轻质油作为燃料B.大规模开采可燃冰作为新能源
C.通过清洁煤技术减少煤燃烧污染D.研发新型催化剂促使转化为甲醇
【答案】D
【解析】将重质油裂解为轻质油作为燃料,实质是长链烃断裂为短链烃,燃烧后排放的CO2的量并没有改变,A不符合题意;可燃冰是甲烷的结晶水合物,大量开采使用,会产生CO2,不利用碳中和,B不符合题意;通过清洁煤技术减少煤燃烧污染,只会减少SO2的排放,但对CO2的排放总量无影响,C不符合题意;研发催化剂将CO2还原为甲醇,有利于减少CO2的排放,对促进“碳中和”最直接,D正确。
2.亚硝酰氟(FNO)是一种工业稳定剂,可通过反应N2O4 +CsF=FNO+CsNO3制得。下列说法正确的是
A.氧原子的结构示意图为B.CsF的电子式为
C.FNO的空间构型为直线形D.CsNO3中含有离子键与共价键
【答案】D
【解析】O原子的质子数和电子数都是8,核外电子分层排布,其结构示意图为,A错误; CsF为离子化合物,电子式为,B错误; FNO中心原子N原子价层电子对数为2+=3,空间构型为V形,C错误;CsNO3中含有Cs+与NO间的离子键与N-O共价键,D正确。
3.实验室采用如图装置制取氨气,正确的是
【答案】D
【解析】氯化铵受热分解生成HCl和氨气,HCl和氨气在试管口遇冷又会化合生成氯化铵,不能用加热氯化铵来制取氨气,A错误;浓硫酸能与氨气反应,不能用浓硫酸来干燥氨气,B错误;氨气密度比空气小,应该用向下排空气法收集氨气,导管应该伸到试管底部,C错误;氨气极易溶于水,尾气吸收应采取防倒吸的措施,D正确。
4.元素Ge、As、Sc是周期表中第四周期主族元素,下列说法正确的是
A.原子半径:r(Ge)
【答案】B
【解析】电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,故原子半径:r(Ge)>r(As)>r(Se),A项错误;同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强,电负性:X(Ge)<(As)
ⅤA族元素氮、磷、砷(As)、锑(Sb)及其化合物应用广泛。NH3催化氧化生成NO,NO继续被氧化为NO2,将NO2通入水中制取HNO3。工业上用白磷(P4)与Ba(OH)2反应生成PH3和一种盐,该盐可与H2SO4反应制备一元中强酸H3PO2。雌黄(As2S3)和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4(沸点114 ℃)并放出H2S气体。锑是带有银色光泽的灰色金属,其氧化物Sb2O3可用于制造耐火材料;锑能与铅形成用途广泛的合金。
5. 下列说法正确的是( )
A. SnCl4是由极性键形成的非极性分子
B. P4是正四面体形分子,其中P—P—P夹角为109°28′
C. ⅤA族元素单质的晶体类型相同
D. 基态砷原子(33As)核外电子排布式为3d104s24p3
【答案】A
【解析】A项,Sn与C同一主族,所以SnCl4结构类似于CCl4的结构,是正面体形,由极性键形成的非极性分子,正确;B项,P4是正四面体形分子,每个顶点均为P原子,P4的结构为,P—P—P的夹角为60°,错误;C项,N2、P和As均为分子晶体,Sb为金属晶体,错误;D项,基态砷原子(33As)核外电子排布式为[Ar]3d104s24p3,错误。
6.下列化学反应表示错误的是( )
A. NO2制HNO3的离子方程式:3NO2+H2O===2H++2NO eq \\al(-,3) +NO
B. 白磷与Ba(OH)2溶液反应:2P4+3Ba(OH)2+6H2O===3Ba(H2PO2)2+2PH3↑
C. H3PO2与足量的NaOH溶液反应的离子方程式:H++OH-===H2O
D. 雌黄制备雄黄的化学方程式:2As2S3+2SnCl2+4HCl===As4S4+2SnCl4+2H2S↑
【答案】C
【解析】A项,NO2溶于水生成HNO3和NO,正确;B项,P4发生歧化反应生成H2PO eq \\al(-,2) 和PH3,正确;C项,H3PO2为一元中强酸,在写离子方程式时不可拆开,错误;D项,根据信息“雌黄(As2S3)和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4(沸点114 ℃)并放出H2S气体”,写出化学方程式,正确。
7.下列物质性质与用途具有对应关系的是( )
A. 氨气易液化,可用于工业制硝酸
B. 五氧化二磷能与水反应,可用于干燥氨气
C. 三氧化二锑的熔点高,可用于制造耐火材料
D. 锑铅合金导热性好,可用作铅酸电池的电极材料
【答案】C
【解析】A项,NH3被O2氧化为NO,NO与O2反应生成NO2,NO2溶于水生成HNO3,反应中NH3体现出还原性,错误;B项,P2O5溶于水生成H3PO4,显酸性,NH3显碱性,两者会发生反应,故不可用P2O5干燥NH3,错误;C项,Sb2O3的熔点高,即在高温下,不易熔化,故可作耐火材料,正确;D项,锑铅合金具有良好的导电性,故用作电极材料,错误。
8.用废铜屑(含Cu、CuO、Fe2O3等)制备胆矾的流程如下:
下列说法不正确的是( )
A. “溶解”时,铜发生反应的离子方程式为Cu+4H++O eq \\al(2-,2) ===Cu2++2H2O
B. “调pH”时,可用Cu2(OH)2CO3代替CuO
C. “滤液”中c(Cu2+)·c2 (OH-)≤Ksp[Cu(OH)2]
D. “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
【答案】A
【解析】A项,H2O2写离子方程式不可拆开,错误;B项,Fe2O3溶于稀硫酸生成Fe3+,Fe3+水解反应:Fe3++3H2OFe(OH)3+3H+,加入的CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀,而除去Fe3+,用Cu2(OH)2CO3与H+反应生成Cu2+、H2O、CO2,也无杂质生成,且Cu2(OH)2CO3为难溶物,若过量也可以一并过滤除去,正确;C项,“调pH”时,不可将Cu2+转化为Cu(OH)2沉淀,所以溶液中Qsp[Cu(OH)2]= c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2],取等号时,Cu2+与OH-刚好达到Cu(OH)2的沉淀溶解平衡,正确;D项,蒸发CuSO4溶液时,Cu2+会水解生成Cu(OH)2,故加入稀硫酸可抑制Cu2+的水解,正确。
9.化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是
A.一定条件下X可发生氧化、取代、消去反应
B.1mlY最多能与4mlNaOH反应
C.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量不相等
D.X与足量H2反应后,每个产物分子中含有8个手性碳原子
【答案】D
【解析】有机物X能燃烧,发生氧化反应。另外,酚羟基能被氧化形成醌类结构。有机物中的氢在一定条件下均有被其他原子或基团取代的可能。X中的酯类结构能发生水解反应,水解反应也属于取代反应。消去反应多数情况发生在醇和卤代烃上。有机物X没有可发生消去反应的醇(或)或卤代烃(或)的结构,因此不能发生消去反应,A错误;Y的酯基可水解,形成如下化合物。酚羟基和羧基均能和NaOH反应。因此,1 ml Y最多能与5 ml NaOH反应,B错误;X和Y能与Br2发生羟基邻对位(*)的取代反应和双键(#)的加成反应。X:;Y:,X和Y反应的位置相同,最多消耗Br2的物质的量也相等,C错误;X与足量H2反应后的产物如下:,手性碳原子要求是饱和碳原子,同时连有4种不同原子或基团。符合要有的碳原子有(*号标记),共8个,D正确。
10.CO2催化加氢制甲醇有利于减少CO2的排放,实现“碳达峰”,其反应可表示为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH=-49kJ·ml-1。今年2月我国科研团队在CO2电化学还原反应机理的研究上取得新突破,明确两电子转移CO2电化学还原反应的控速步骤为CO2吸附过程。CO2催化加氢制甲醇的反应通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)△H1=41kJ·ml-1
②CO(g)+2H2(g)=CH3OH(g)△H2
反应过程中各物质的相对能量变化情况如图所示。下列说法不正确的是
A.步骤①反应的△S>0
B.步骤②反应的△H2=-90kJ·ml-1
C.升高温度,各步骤的正、逆反应速率均增大
D.CO2催化加氢制甲醇的总反应速率由步骤②决定
【答案】D
【解析】步骤①反应能自发,即G=△H-T△S<0,而此反应的△H>0,故△S>0,A正确;步骤②的反应热△H=生成物的总能量-反应物的总能量=-49kJ/ml-41kJ/ml=-90kJ/ml,B正确;升高温度,各步的反应物和生成物的活化分子百分数均增大,各步的正逆反应速率均加快,C正确;步骤①的活化能高于步骤②,即步骤①的反应速率更慢,是总反应的决速步,D错误。
11.室温下,下列实验探究方案及现象能达到探究目的的是
【答案】D
【解析】未告知醋酸和盐酸的浓度,只比较pH值大小,无法判断醋酸为强电解质还是弱电解质, A错误;加入足量盐酸后沉淀指部分溶解,则说明沉淀中有硫酸钡,则说明亚硫酸钠被空气氧化为硫酸钠,B错误;氯水过量,溶液变为蓝色,有可能是过量的氯水将碘化钾氧化成了碘单质,无法比较出溴单质和碘单质氧化性的强弱, C错误;KSCN溶液可用于检验Fe3+,滴加氯水后,若溶液变红,则说明Fe2+被氧化成了Fe3+,可以证明Fe2+具有还原性,D正确。
12.为二元弱碱。室温下,配制一组的与的混合溶液,溶液中相关组分的物质的量分数随溶液pH变化的曲线如下图所示,下列说法正确的是
A.由图可知的
B.的溶液中:
C.等物质的量的和混合溶液中
D.在的水溶液中,
【答案】C
【解析】随着pH的升高,X2+第一步反应变为X(OH)+,X(OH)+第二步反应变为X(OH)2,pH=6.2时,;pH=9.2时,。根据图像左侧的交叉点,pH=6.2时,,的=10-6.2,A项错误;的溶液中:,但是加入盐酸,溶液的体积增加,故<0.05ml/L,B项错误;X2+的水解程度大于X(OH)+的水解程度,则等物质的量的和混合溶液,C项正确;的水溶液显酸性,,D项错误。
13.CO2CH4重整可获得H2。CO2CH4重整反应的热化学方程式如下。
反应Ⅰ:CH4(g)+CO2(g)===2CO(g)+2H2(g);ΔH1=247 kJ·ml-1。
反应Ⅱ:H2(g)+CO2(g)===CO(g)+H2O(g);ΔH2=41 kJ·ml-1。
反应Ⅲ:CH4(g)===C(s)+2H2(g);ΔH3=75 kJ·ml-1。
1.01×105 Pa下,将n起始(CO2)∶n起始(CH4)=1∶1的混合气体置于密闭容器中,不同温度下重整体系中,平衡时各气体组分的物质的量分数如图所示。下列说法不正确的是( )
A. 曲线X表示CO2
B. 反应CH4(g)+3CO2(g)===4CO(g)+2H2O(g)进行的程度很小
C. 500 ℃,1.01×105 Pa时,向平衡体系中再充入一定量的CO2,达新平衡后, eq \f(c(CO)·c(H2O),c(CO2)·c(H2)) 的值保持不变
D. 随着温度升高, eq \f(n(CO),n(H2)) 的值变小,原因是反应Ⅲ增大的程度小于反应Ⅱ增大的程度
【答案】D
【解析】A项,对于反应Ⅰ,参加反应的CH4和CO2的量相等,起始时两者又等量,所以余下的CH4和CO2的量应相等,反应Ⅱ中生成H2O,从题图看,CO的物质的量分数比H2的略高,说明反应Ⅱ消耗CO2的量要比反应Ⅲ消耗的CH4的量要多,故曲线X为CO2,曲线Y为CH4,正确;B项,将“反应Ⅰ”+“反应Ⅱ”×2,可得反应CH4(g)+3CO2(g)===4CO(g)+2H2O(g),该反应的ΔH>0,且为气体体积增大的反应,所以反应不易正向进行,正确;C项, eq \f(c(CO)·c(H2O),c(CO2)·c(H2)) 表示反应Ⅱ的化学平衡常数,平衡常数仅与温度有关,所以500 ℃下,仅改变CO2的量,平衡常数不变,正确;D项,反应Ⅲ增大的程度小于反应Ⅱ增大的程度,则n(CO)增大值比n(H2)大,则 eq \f(n(CO),n(H2)) 的值变大,错误
第Ⅱ卷
二、非选择题:共4题,共61分。
14.(15分)铜-钢双金属废料和铜烟灰是铜的重要二次资源。
Ⅰ.从铜-钢双金属废料中浸出铜的工艺流程如下:
(1)25℃时,随溶液的不同,甘氨酸在水溶液中分别以、或为主要形式存在。内盐是两性化合物,请用离子方程式表示其水解使水溶液呈碱性的原因: 。
(2)浸出剂的制备:主要原料有甘氨酸(简写为)、溶液和固体。取一定量固体溶于水,随后依次加入 (填“”或“”,下同)、 ,所得碱性浸出剂的主要成分为甘氨酸铜、等。
(3)浸出:将经打磨的铜钢废料投入浸出剂,控制温度50℃,通入空气,并搅拌。浸出剂不与钢作用,但与铜反应,最终铜全部转化为进入溶液,从而实现铜、钢分离。
①浸出时发生的反应过程为、 。
②其它条件不变时,空气流量对铜浸出速率的影响如图1所示。当空气流量超过时,铜浸出速率急剧下降的可能原因是 。
Ⅱ.从铜烟灰(主要成分为)中回收铜的主要步骤为:酸浸→萃取→反萃取→电解。
已知:溶于无机酸。
(4)酸浸:将铜烟灰用硫酸浸出,控制其他条件相同,铜浸出率与温度的变化关系如图2所示。随温度升高,铜浸出率先增大后减小的可能原因是 。
(5)萃取、反萃取:向浸出液(浓度为)中加入有机萃取剂萃取,其原理可表示为:(水层)(有机层)(有机层)(水层)。
向萃取所得有机相中加入硫酸,反萃取得到水相(浓度达)。该工艺中设计萃取、反萃取的目的是 。
【答案】(1)
(2)HL CuSO4
(3)① ②空气中的氧气没有足够的时间参与反应,导致反应速率下降
(4)该酸浸过程为放热反应,温度升高时,反应速率加快,但是温度过高,则平衡逆向移动,导致浸出率降低
(5)实现的提取和富集
【解析】(1)仿照CH3COO-水解反应,该羧酸根离子结合水电离的H+生成相应的羧酸和OH-,溶液显碱性,水解的离子方程式为:。(2)若先加入CuSO4,则CuSO4会和NaOH生成Cu(OH)2沉淀,故随后依次加入HL,再加入CuSO4。(3)①根据题给信息最终铜全部转化为CuL2,以及浸出过程中需要通入空气,再结合浸出时的第一步反应,则其第二步反应为:;②空气流量铜的浸出速率急剧下降,其可能的原因是:空气中的氧气没有足够的时间参与反应,导致反应速率下降。(4)由于该酸浸过程为放热反应,从动力学角度,即反应速率角度考虑,温度升高时,反应速率加快;从热力学角度,即平衡移动角度考虑,温度过高,平衡逆向移动,导致浸出率降低。(5)由于FeO、Fe2O3、Zn3(PO4)2均能够溶于硫酸,则浸出液中有Cu2+、Fe2+、Fe3+、Zn2+,根据信息,加入有机萃取剂将Cu2+从浸出液中提取到有机层中,然后分液后在有机相中加入硫酸,再将Cu2+反萃取到水层中,实现Cu2+的提取和富集。
15.(15分)有机物F是一种新型大环芳酰胺的合成原料,可通过以下方法合成:
(1)A中采用杂化方式的碳原子有 个。
(2)的反应类型为 。
(3)若B直接硝化,最后主要产物的结构简式为 。
(4)写出一种符合下列条件的B的同分异构体的结构简式: 。
①能与溶液发生显色反应;
②分子中含有2个苯环,共有3种不同化学环境的氢原子。
(5)已知:,写出以、和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
【答案】(1)8
(2)取代反应
(3)
(4)或
(5)
【解析】由流程可知,AB的反应为取代反应,BC是进行取代位置的保护,如果直接硝化反应,会在硝基的间位上引入硝基,则达不到实验目的,CD为硝化反应,在苯环的对位上引入硝基,DE为酰胺键的水解反应,即取代反应,最后再进行硝基的还原得到最后产物;(1)A中苯环上的碳原子和酯基上的碳原子都采用的是杂化,故有8个碳原子采用杂化。(2)对比D和E的结构可知,D在酸性条件下发生水解反应得到E,反应类型为取代反应。(3)B到C时为了在苯环的对位上引入基团,若B直接硝化,则会在B的苯环上的间位上引入硝基,则最后得到的产物会是。(4)B的结构简式为,其同分异构体能与溶液发生显色反应,说明有酚羟基,分子中含有2个苯环,则刚好把碳原子和不饱和度用完,说明其侧链为两个氨基和两个酚羟基,共有3种不同化学环境的氢原子,则结构为对称结构,故满足条件的同分异构体有或。(5)、和为原料制备;上的碳原子要减少2个,则先与溴单质发生加成反应得到,再发生消去反应得到,再利用信息反应得到,再与酯化得到,最后利用流程图中A到B的反应得到目标产物。
16.(15分)实验室以氟碳铈矿(主要成分为CeFCO3)为原料制备CeO2粗品,并测定粗品中CeO2的含量。
(1)酸洗。氟碳铈矿和浓硫酸发生反应,生成Ce2(SO4)3等。酸洗不宜在玻璃器皿中进行,其原因是 。
(2)焙烧。Ce2(SO4)3在空气中高温焙烧可得到CeO2和SO3,其反应方程式为__________________________。
(3) 测定粗品中CeO2的含量。部分实验操作如下:
步骤Ⅰ 称取0.500 0 g样品置于锥形瓶中,加入蒸馏水和浓硫酸,边搅拌边加入双氧水,低温加热至样品反应完全。
步骤Ⅱ 煮沸,冷却后滴入催化剂硝酸银溶液,加入过量的(NH4)2S2O8溶液,将Ce(Ⅲ)氧化为Ce(Ⅳ),低温加热至锥形瓶中无气体产生[2(NH4)2S2O8+2H2O eq \(=====,\s\up7(△)) 4NH4HSO4+O2↑]。再次煮沸、冷却,用硫酸亚铁铵标准溶液滴定。
① “步骤Ⅰ”中加入双氧水的作用是 。
② “步骤Ⅱ”中“再次煮沸”的时间不宜太短,其原因是 。
③ 请补充完整制备(NH4)2Fe(SO4)2·6H2O晶体的实验方案:称取一定质量的铁粉, ,
低温干燥,即可得到硫酸亚铁铵晶体。
已知:(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2·6H2O。
须使用的试剂:1 ml·L-1 H2SO4溶液、95%的乙醇溶液、(NH4)2SO4固体。
【答案】(1)反应生成的HF会腐蚀玻璃
(2)2Ce2(SO4)3+O2 eq \(=====,\s\up7(焙烧)) 4CeO2+6SO3
(3)①在H2SO4酸性环境下H2O2将CeO2还原为Ce(Ⅲ)(或Ce3+)
②防止没有分解的(NH4)2S2O8与硫酸亚铁铵反应,使硫酸亚铁铵滴定量增多,造成CeO2含量的测定结果偏大
③加入适量1 ml·L-1 H2SO4溶液反应至无明显气泡产生(1分),过滤、洗涤,称量残余固体质量(1分),向滤液中加入计算量的(NH4)2SO4固体,充分溶解(1分),加热浓缩,冷却结晶(1分),过滤,用95%的乙醇溶液洗涤晶体(1分)
【解析】(1) CeFCO3中氟元素与浓硫酸反应会生成HF,HF可以与玻璃中的SiO2反应生成SiF4气体,会腐蚀玻璃。(2) Ce2(SO4)3在空气中反应,O2将Ce(Ⅲ)氧化为Ce(Ⅳ),生成CeO2,根据Ce和O得失电子守恒配平反应。(3) ① 步骤Ⅰ中CeO2与H2O2反应,步骤Ⅱ中Ce(Ⅲ)被(NH4)2S2O8溶液氧化为Ce(Ⅳ),说明步骤Ⅰ中CeO2与H2O2反应生成了Ce(Ⅲ),CeO2作氧化剂,H2O2作还原剂,H2O2的作用即为将CeO2还原生成Ce(Ⅲ)。②测定粗品中CeO2的含量的实验原理为:先将固体CeO2通过浓硫酸溶解,加入H2O2将其还原为Ce(Ⅲ),然后加入(NH4)2S2O8再将Ce(Ⅲ)氧化为Ce(Ⅳ),最后用硫酸亚铁铵滴定Ce(Ⅳ),Fe2+具有还原性,Ce(Ⅳ)具有氧化性,两者发生氧化还原反应,根据消耗的硫酸亚铁铵的量,由Ce守恒,可以计算出CeO2的量。步骤Ⅱ中“再次煮沸”是将过量的(NH4)2S2O8除去,因为(NH4)2S2O8具有强氧化性,可以与硫酸亚铁铵反应,导致消耗的硫酸亚铁铵的量变大,计算出的CeO2结果变大。③ 铁粉与H2SO4溶液生成FeSO4,根据铁粉溶解的量,可以计算出生成的FeSO4的量,FeSO4与(NH4)2SO4以1∶1反应,根据FeSO4的量可以计算出需要加入的(NH4)2SO4的量,两者刚好完全反应生成(NH4)2Fe(SO4)2溶液,通过加热浓缩、冷却结晶,可得(NH4)2Fe(SO4)2·6H2O晶体,过滤出晶体,用95%的乙醇溶液洗涤晶体,乙醇易挥发,可以减少能耗。
17.(16分)苯乙烯是合成橡胶和塑料的重要原料,可由乙苯为原料制得。
(1) 利用“乙苯脱氢反应”可制备苯乙烯。
C6H5C2H5(g)⇌C6H5CH===CH2(g)+H2(g);ΔH=a kJ·ml-1
图1
保持气体总压不变,原料气按以下A、B、C三种投料方式进行:
A. 乙苯
B. n(乙苯)∶n(N2)=1∶10
C. n(乙苯)∶n(CO2)=1∶10
三种投料分别达到平衡时,乙苯转化为苯乙烯的转化率[ eq \f(n(C6H5CHCH2),n总(C6H5C2H5)) ×100%]与温度的关系如图1所示。
① a (填“>”“<”或“不能确定”)0。
② 相同温度下,投料方式B乙苯的平衡转化率比投料方式A的高,其原因是________________________。
③ 相同温度下,投料方式C乙苯的平衡转化率比投料方式B的高,其可能原因是_________________。
④ 工业上利用“乙苯脱氢反应”生产苯乙烯时,会产生少量积碳。使用相同条件下的水蒸气代替N2,可较长时间内保持催化剂的催化活性,其原因是 。
(2) CO2用于制备苯乙烯有助于实现“碳中和”。
① 在催化剂X作用下,CO2参与反应的机理如图2所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。根据元素电负性的变化规律,图2所示的反应机理中步骤Ⅰ和步骤Ⅱ可描述为__________________________________________________。
图2
图3
② 保持混合气体总压(p)等其他条件不变,CO2的分压[p(CO2)= eq \f(n(CO2),n(乙苯)+n(CO2)) ×p]与乙苯转化率的关系如图3所示。p(CO2)>14 kPa时,乙苯转化率下降的原因是_________________________________。
【答案】(1)①>
②加入一定量N2使“乙苯脱氢反应”的Qc
④水蒸气与积碳发生反应H2O(g)+C(s)===CO(g)+H2(g),可消除催化剂表面的积碳
(2)①乙苯αH带部分正电荷,被带部分负电荷的B1位点吸引,随后解离出H+并吸附在B1位点上,(B1位点上的)H+与B2位点上CO2中带部分负电荷的O作用生成,带部分正电荷的C吸附在带部分负电荷的B2位点上 ②过多的CO2会占据带部分负电荷的B1位点,使得乙苯αH的脱除速率降低,乙苯转化率下降
【解析】(1)①由题图1可知,温度升高,乙苯的平衡转化率增大,则正反应为吸热反应,a>0;②总压不变,通入N2使n(乙苯)∶n(N2)=1∶10,相比不通N2时,相当于减小了反应体系中反应相关气体的分压,有助于平衡向正反应方向移动(Qc
A
B
C
D
生成NH3
干燥NH3
收集NH3并验满
吸收多余NH3
选项
探究方案及现象
探究目的
A
用pH计测量醋酸、盐酸的pH,比较溶液pH大小
醋酸是弱电解质
B
向久置的溶液中加入足量溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
不能被空气氧化
C
向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色
氧化性:
D
向盛有溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
具有还原性
A
B
C
D
生成NH3
干燥NH3
收集NH3并验满
吸收多余NH3
选项
探究方案及现象
探究目的
A
用pH计测量醋酸、盐酸的pH,比较溶液pH大小
醋酸是弱电解质
B
向久置的溶液中加入足量溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
不能被空气氧化
C
向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色
氧化性:
D
向盛有溶液的试管中滴加几滴KSCN溶液,振荡,再滴加几滴新制氯水,观察溶液颜色变化
具有还原性
江苏省名校2024年高考化学模拟卷(一)含答案: 这是一份江苏省名校2024年高考化学模拟卷(一)含答案,共10页。试卷主要包含了02×1024,6ml等内容,欢迎下载使用。
江苏省名校2024年高考化学模拟卷(三)含答案: 这是一份江苏省名校2024年高考化学模拟卷(三)含答案,共11页。试卷主要包含了02×1023,2~10等内容,欢迎下载使用。
江苏省名校2024年高考化学模拟卷(二)含答案: 这是一份江苏省名校2024年高考化学模拟卷(二)含答案,共10页。试卷主要包含了下列化学反应表示错误的是等内容,欢迎下载使用。












