






专题二 物质结构与性质 主观题突破 3.分子结构与性质原因解释课件-2024年高考化学二轮复习
展开(1)分子构型与分子极性的关系
(2)键的极性对化学性质的影响
应用示例按要求回答问题:(1)酸性:CCl3COOH_____CHCl2COOH(填“>”或“<”下同),其原因是______________________________________________________________________________________。(2)酸性:CH3COOH______CH3CH2COOH,其原因是________________________________________________________________________________________。
Cl3C—的极性大于Cl2HC—的极性,导致CCl3COOH的羧基中的羟
基的极性更大,更易电离出H+
因,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱
(3)溶解性①“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂,若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。②“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶,而戊醇在水中的溶解度明显减小。
2.氢键及其对物质性质的影响
氢键不属于化学键,氢键的作用力要大于范德华力。
对物理性质的影响:(1)分子间氢键使物质沸点较高例如,沸点:NH3>PH3(NH3分子间形成氢键)、H2O>H2S(H2O分子间形成氢键)、HF>HCl(HF分子间形成氢键)、C2H5OH>CH3OCH3(C2H5OH分子间形成氢键)。
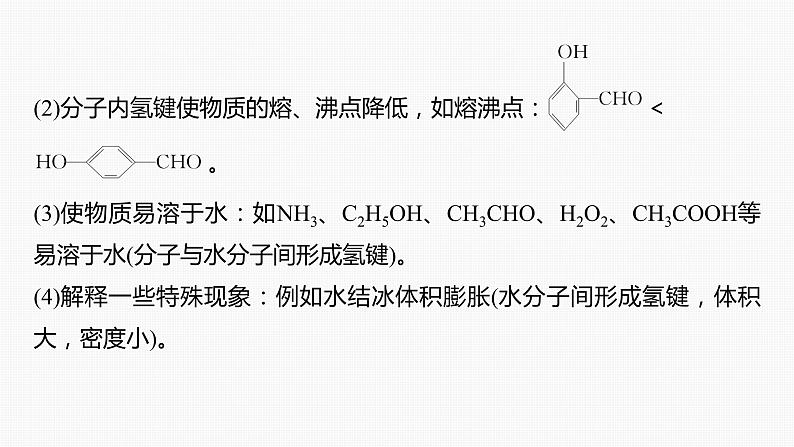
(2)分子内氢键使物质的熔、沸点降低,如熔沸点: <
(3)使物质易溶于水:如NH3、C2H5OH、CH3CHO、H2O2、CH3COOH等易溶于水(分子与水分子间形成氢键)。(4)解释一些特殊现象:例如水结冰体积膨胀(水分子间形成氢键,体积大,密度小)。
1.[2023·湖北,16(5)]导致SiCl4比CCl4易水解的因素有______(填标号)。a.Si—Cl键极性更大b.Si的原子半径更大c.Si—Cl键键能更大d.Si有更多的价层轨道
a项,Si—Cl键极性更大,易受到极性强的H2O的影响,易水解;b项,Si的原子半径大,非金属性弱,Si—Cl键的极性强,分子中Si原子带有一定的正电荷,容易受到极性H2O的吸引,使之容易水解;c项,Si—Cl键键能更大,更稳定,与水解无关;d项,Si位于第三周期,3d轨道更易和H2O分子中的O原子配位。
2.[2021·全国甲卷,35(3)]甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是__________________________________________________________________________。
甲硫醇不能形成分子间氢键,而水和甲
醇均能形成氢键,且水比甲醇形成的氢键多
3.[2020·山东,17(2)]NH3、PH3、AsH3的沸点由高到低的顺序为__________________(填化学式,下同),还原性由强到弱的顺序为_________________,键角由大到小的顺序为_________________。
NH3、PH3、AsH3
4.[2020·全国卷Ⅱ,35(2)]Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________________________________________________________________________________________________________。
物,熔点高,其他三种均为共价化合物,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高
5.[2018·全国卷Ⅱ,35(3)]如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______________________________________。
S8相对分子质量大,分子间范德华
1.H2S的熔点为-85.5 ℃,而与其具有类似结构的H2O的熔点为0 ℃,极易结冰成固体,二者物理性质出现差异的原因是_________________________________________________________。
H2O分子间极易形成氢
键,而H2S分子间只存在较弱的范德华力
2.NH3常用作制冷剂,原因是_________________________________________________________。
NH3分子间能形成氢键,沸点高,易液化,
3.硝酸和尿素的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:________________________________________________________________________________。
尿素分子间存在氢键,使其熔、沸点升高,而
硝酸分子内存在氢键,使其熔、沸点降低
4.氨极易溶于水的原因为_______________________________________________________________________。
氨和水都是极性分子,依据“相似相溶”规律,
且氨分子与水分子间能形成氢键
5.N2H4与O2的相对分子质量相近,但N2H4的熔点(2 ℃)、沸点(114 ℃)分别远远高于O2的熔点(-218 ℃)、沸点(-183 ℃),原因是___________________________________________________________________。
间存在氢键,O2分子之间为范德华力,氢键比范德华力更强
6.H2O、PH3、KH按熔点由高到低的顺序排列为______________,熔点差异的原因是____________________________________________________________。
KH为离子晶体,H2O、PH3均为分子晶体,H2O分子间
7.硼酸分子的结构简式可写为B(OH)3,其晶体为层型片状结构,容易在层与层之间裂解,这是因为在平面层内硼酸分子之间通过______结合,而层与层之间通过___________结合。
8. 的分子内部存在氢键,画出氢键结构:__________。
9.HSCN的结构有两种,其中硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N==C==S),原因是_______________________________________________________。
异硫氰酸分子间可形成氢键,而硫氰酸分子间
10.卤素对物质性质有明显影响。(1)常温下,ClCH2COOH、ICH2COOH和CH3COOH电离常数由大到小的顺序为__________________________________。
ClCH2COOH>ICH2COOH>CH3COOH
电负性:Cl>I>H,键的极性:Cl—C>I—C>H—C,键的极性越大,羧基中O—H的极性越大,更易电离出H+,羧酸酸性更强,故电离常数由大到小的顺序为ClCH2COOH>ICH2COOH>CH3COOH。
(2)吡啶()具有碱性和芳香性。研究发现,吡啶中N原子的电子云密度越大,碱性越强。N原子的杂化类型是_____。在下列物质中,碱性最强的是____(填字母,下同),最弱的是____。
吡啶分子中N原子形成2个σ键,还有1个孤电子对,因此杂化类型是sp2杂化。I、Cl的电负性强,C—I、C—Cl的极性强,使N原子核外的电子偏离更多,N原子的电子云密度减小,Cl的电负性大于I,故c的碱性最弱,而甲基是推电子基团,使N原子核外电子云密度增大,故d的碱性最强。
专题三 主观题突破 2.电离能、电负性、化学键、杂化方式与空间结构类原因解释题 2024年高考化学二轮复习课件+讲义: 这是一份专题三 主观题突破 2.电离能、电负性、化学键、杂化方式与空间结构类原因解释题 2024年高考化学二轮复习课件+讲义,文件包含专题三主观题突破2电离能电负性化学键杂化方式与空间结构类原因解释题pptx、专题三主观题突破2电离能电负性化学键杂化方式与空间结构类原因解释题教师版docx、专题三主观题突破2电离能电负性化学键杂化方式与空间结构类原因解释题docx等3份课件配套教学资源,其中PPT共44页, 欢迎下载使用。
专题七 主观题突破 4.实验方案的设计及原因解释 课件-2024年高考化学二轮复习: 这是一份专题七 主观题突破 4.实验方案的设计及原因解释 课件-2024年高考化学二轮复习,共22页。PPT课件主要包含了真题演练,考向预测等内容,欢迎下载使用。
专题二 物质结构与性质 主观题突破 2.电离能、电负性、化学键、空间结构原因解释课件-2024年高考化学二轮复习: 这是一份专题二 物质结构与性质 主观题突破 2.电离能、电负性、化学键、空间结构原因解释课件-2024年高考化学二轮复习,共31页。PPT课件主要包含了真题演练,FOCl,O>Ti>Ca,离子键,分子晶体,考向预测,强电负性OC,N元素,Na+和Ne电,H2O中等内容,欢迎下载使用。












