



所属成套资源:新人教版化学选择性必修2课件PPT全册
人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件
展开
这是一份人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件,共29页。PPT课件主要包含了课前导入,电子式,结构式,非极性键,极性键,极性键和非极性键,极性分子,非极性分子,HCl,大小相等方向相反等内容,欢迎下载使用。
微波炉经常用来加热饭菜,你知道这是为什么吗?
目标一 共价键的极性
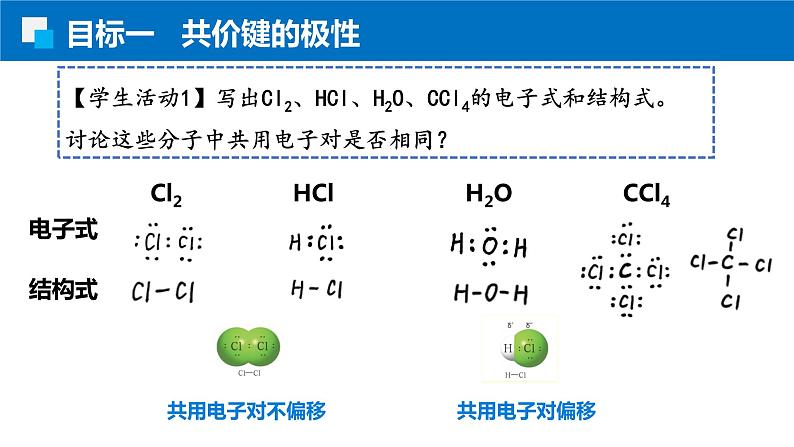
【学生活动1】写出Cl2、HCl、H2O、CCl4的电子式和结构式。讨论这些分子中共用电子对是否相同?
Cl2 HCl H2O CCl4
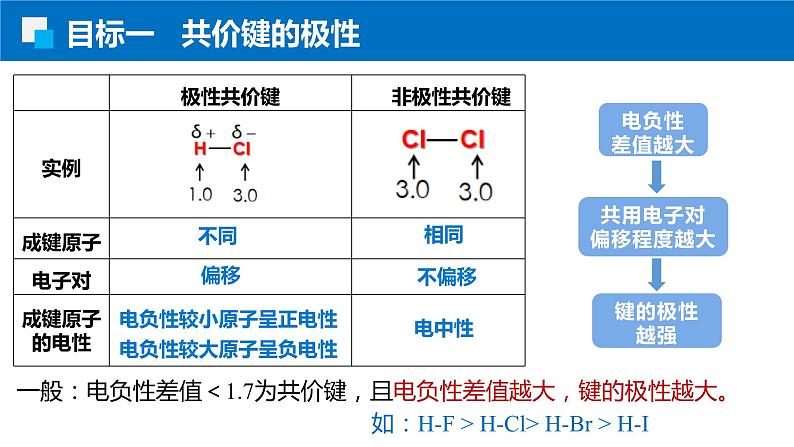
电负性较小原子呈正电性
电负性较大原子呈负电性
一般:电负性差值<1.7为共价键,且电负性差值越大,键的极性越大。
如:H-F > H-Cl> H-Br > H-I
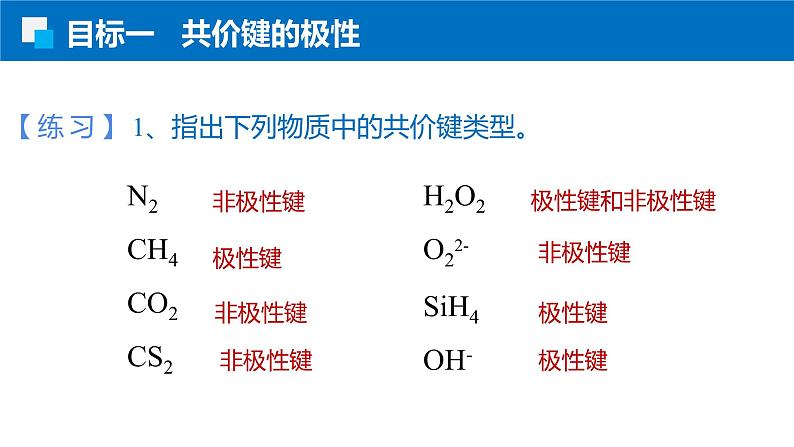
【练习】1、指出下列物质中的共价键类型。
N2CH4CO2CS2
H2O2O22-SiH4OH-
目标二 极性分子和非极性分子
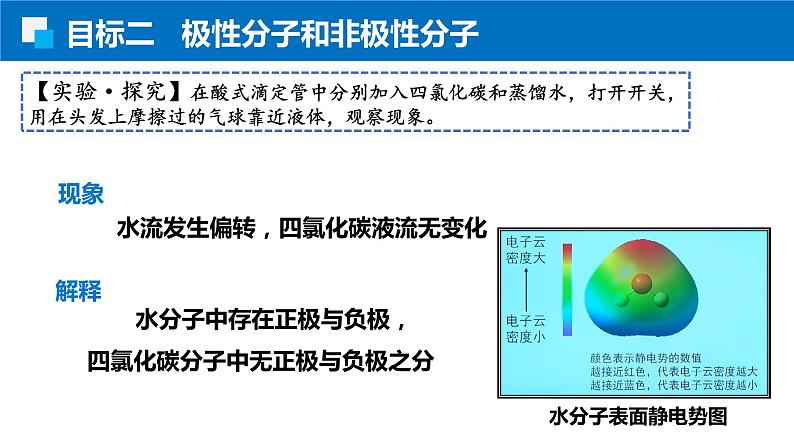
【实验·探究】在酸式滴定管中分别加入四氯化碳和蒸馏水,打开开关,用在头发上摩擦过的气球靠近液体,观察现象。
水流发生偏转,四氯化碳液流无变化
水分子中存在正极与负极,四氯化碳分子中无正极与负极之分
像水分子这样,分子中正电中心和负电中心不重合的分子叫做极性分子。
像四氯化碳分子这样,分子中正电中心和负电中心重合的分子叫做非极性分子。
【问题·思考】含有极性键的分子一定是极性分子吗?
正四面体形,空间构型对称
分子的正电中心与负电中心是否重合
H2 O2 Cl2
HCl HF
同种原子构成的双原子分子是非极性分子。
不同原子构成的双原子分子是极性分子。
相同原子构成的多原子分子大多是非极性分子。
极性的表示方法—极性向量
电负性: 2.1 3.0
极性向量:描述极性键的电荷分布情况。 方向: 大小:
由正电中心指向负电中心
电负性差值越大,键的极性越大,极性向量越大
非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
正电中心与负电中心重合
正电中心与负电中心不重合
(1)根据中心原子的化合价判断
中心原子的化合价绝对值 =
中心原子的化合价绝对值 ≠
(2)中心原子的孤电子对数
大气高空的臭氧层,保护了地球生物的生存 空气质量的重要指标 有机合成的氧化剂 替代氯气的净水剂……
臭氧是极性分子(极性微弱)
【归纳整理】常见ABn型分子的极性
极性分子中一定含有极性键,可能含有非极性键;非极性分子中可能含极性键,也可能含非极性键。
目标三 键的极性对化学性质的影响
例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
pKa(pKa=−lgKa)pKa越小,酸性越强
表2-6不同羧酸的pKa
烃基越长推电子效应越大
使羧基中的羟基的极性越小
随着烃基加长,酸性的差异越来越小。
酸性:甲酸>乙酸>丙酸
烃基是推电子基团,即将电子推向羟基,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
为什么钠和水的反应比钠和乙醇的反应剧烈?
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
Cl原子数目越多,吸引电子能力越大
使羧基中的羟基极性越大
酸性:CCl3COOH>CHCl2COOH>CH2ClCOOH
酸性:CF3COOH>CCl3COOH
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的羟基的极性更大,更易电离出氢离子。
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—导致三氯乙酸羧基中的羟基的极性最大,更易电离出氢离子 。
1.键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大。2.与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越大。3.烃基是推电子基团,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
键的极性对化学性质的影响
相关课件
这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质备课ppt课件,共60页。PPT课件主要包含了极性键,共价键的极性,学习目标,分子的极性,负电荷两中心重合,ClCl,HCl,非极性键,非极性分子,极性分子等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt,共33页。
这是一份高中第三节 分子结构与物质的性质示范课课件ppt,共30页。PPT课件主要包含了教材分析,教学目标,教学重点,教学难点,共价键的极性,教学流程,教学过程,只含非极性键的分子,含有极性键的分子,向量和不等于零等内容,欢迎下载使用。











