

四川省成都市蓉城名校联盟2023-2024学年高一上学期期末联考化学试题含答案
展开考试时间75分钟,满分100分
注意事项:
1.答题前,考生务必在答题卡上将自己的姓名、座位号、准考证号用0.5毫米的黑色签字笔填写清楚,考生考试条形码由监考老师粘贴在答题卡上的“贴条形码区”。
2.选择题使用2B铅笔填涂在答题卡上对应题目标号的位置上,如需改动,用橡皮擦擦干净后再填涂其它答案;非选择题用0.5毫米的黑色签字笔在答题卡的对应区域内作答,超出答题区域答题的答案无效;在草稿纸上、试卷上答题无效。
3.考试结束后由监考老师将答题卡收回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 P 31 S 32 Cl 35.5 Fe 56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法正确的是
A.腐蚀覆铜板的“腐蚀液”是FeCl2溶液
B.钟乳石的形成涉及氧化还原反应
C.生铁和钢是含碳量不同的两种铁碳合金
D.氧化钠可用在呼吸面具中作氧气的来源
2.NA表示阿伏加德罗常数的值。下列说法正确的是
A.0.5 ml Na2O与0.5 ml Na2O2所含Na+总数相同
B.1 ml MnO2与足量浓盐酸充分反应生成氯气22.4 L
C.0.15 ml·L−1 NaOH溶液中离子数为0.3NA
D.标准状况下,22.4 L乙醇所含分子数为NA
3.在无色溶液中,下列离子能大量共存的是
A.NH4+、Al3+、OH−、SO42−B.Ba2+、Mg2+、Cl−、NO3−
C.Na+、H+、MnO4−、OH−D.Fe2+、Na+、Cl−、NO3−
4.溶液导电能力取决于自由移动离子的浓度、离子所带电荷数和离子种类。若忽略离子种类对溶液导电能力的影响,离子浓度越大,所带电荷数越多,溶液导电能力越强。下列溶液的导电性最强的是
A.1.5 ml·L−1 Na2SO4溶液B.2.0 ml·L−1 MgCl2溶液
C.1.5 ml·L−1 HCl溶液D.2.5 ml·L−1 Ba(OH)2溶液
5.下列离子反应方程式错误的是
A.向氧化钠中滴加稀盐酸:Na2O + 2H+ = 2Na+ + H2O
B.铝锅不能煮碱性的食物:2Al + 2Na+ + 2OH− + 6H2O = 2Na[Al(OH)4]+ 3H2↑
C.向稀盐酸中滴加碳酸钠溶液:CO32− + 2H+ = CO2↑ + H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2+ + 2OH− + 2H+ + SO42− = BaSO4↓ + 2H2O
6.右图是元素周期表中磷元素的相关信息,根据图示信息可推知下列选项错误的是
A.磷原子的核电荷数为15
B.红磷、白磷是磷元素的同位素
C.P4的摩尔质量约为124 g·ml−1
D.内层电子总数是M层电子数的2倍
7.下列说法错误的是
① 干燥的沙土可用于扑灭着火的金属钠
② 钠能从硫酸铜溶液中置换出金属铜
③ Na2O2能与水反应生成NaOH,为碱性氧化物
④ NaHCO3可作胃酸中和剂和食用碱
⑤ Fe2O3俗称铁红,常作油漆、涂料、油墨和橡胶的红色颜料
⑥ 合金因加入其他原子改变了金属原子的层状排列而硬度变大
A.①②B.①④C.②③D.⑤⑥
8.高铁酸钾(K2FeO4)作净水剂时会产生Fe3+,该过程既能消毒杀菌,也能吸附水中悬浮物。制备K2FeO4的一种方法的化学原理可用离子方程式表示为:
3ClO− + 2Fe3+ + 10OH− = 2FeO42− + 3Cl− + 5H2O
下列说法错误的是
A.K2FeO4中铁元素的化合价为+6价
B.ClO−作氧化剂,Fe3+被还原
C.0.6 ml ClO−参与反应时生成0.4 ml FeO42−
D.K2FeO4净水时会生成Fe(OH)3胶体
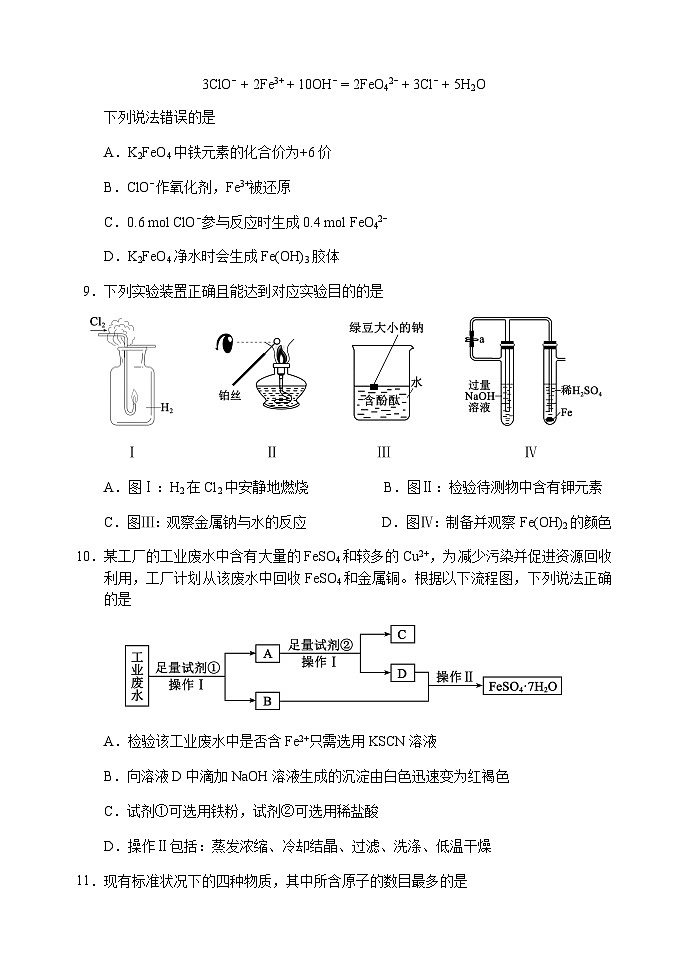
9.下列实验装置正确且能达到对应实验目的的是
Ⅰ Ⅱ Ⅲ Ⅳ
A.图Ⅰ:H2在Cl2中安静地燃烧B.图Ⅱ:检验待测物中含有钾元素
C.图Ⅲ:观察金属钠与水的反应D.图Ⅳ:制备并观察Fe(OH)2的颜色
10.某工厂的工业废水中含有大量的FeSO4和较多的Cu2+,为减少污染并促进资源回收利用,工厂计划从该废水中回收FeSO4和金属铜。根据以下流程图,下列说法正确的是
A.检验该工业废水中是否含Fe2+只需选用KSCN溶液
B.向溶液D中滴加NaOH溶液生成的沉淀由白色迅速变为红褐色
C.试剂①可选用铁粉,试剂②可选用稀盐酸
D.操作Ⅱ包括:蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥
11.现有标准状况下的四种物质,其中所含原子的数目最多的是
A.36.5 g HClB.5.6 L H2OC.3.01×10−23个SO2D.1.5 ml CH4
12.下列选项所选用除杂试剂错误的是
13.物质类别和核心元素的价态是学习元素化合物性质的重要视角。如图为氯元素的“价—类”二维图,a、b、c、d、e均为含氯元素的物质,下列有关说法错误的是
A.a、d均是一元酸且d见光易分解生成a
B.干燥的b能使有色鲜花变色
C.c的化学式为Cl2O,可用于自来水杀菌消毒
D.e可作棉麻、纸张的漂白剂和游泳池的消毒剂
14.某兴趣小组为测定某含铁氧化物中铁元素的百分含量,其操作流程如下:
下列说法正确的是
A.操作Ⅰ、操作Ⅲ均为过滤
B.操作Ⅱ若未使用H2O2,则固体d的质量小于32 g
C.灼烧需要的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳等
D.该含铁氧化物中n(Fe):n(O) = 1:2
二、非选择题:本题共4小题,共58分。
15.(10分)
某澄清透明溶液可能含有H+、Cu2+、NH4+、Fe3+、Ca2+、SO42−、Cl−、NO3−、CO32−,为确定溶液中离子组成,进行实验操作如下:
① 取少量该溶液,加入紫色石蕊溶液显红色;
② 取少量该溶液,加入过量BaCl2溶液,有白色沉淀生成,且不溶于稀硝酸;
③ 取②中反应后的上层清液,加入酸化的AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸;
④ 取少量原溶液,加入过量的NaOH溶液,有蓝色沉淀生成,加热时产生的气体可使紫色石蕊溶液显蓝色。
已知:NH4+ + OH−NH3↑ + H2O。
回答下列问题:
(1)根据操作①~④,溶液中一定存在的离子是_______,溶液中肯定不存在的离子是_______。
(2)操作③中发生反应的离子方程式为_______,该步骤_______(填“能”或“不能”)确定原溶液是否含Cl−。
(3)操作④中生成的沉淀的化学式为_______。
(4)已知溶液中各离子的物质的量浓度均为0.1 ml·L−1,还能确定溶液中存在的离子是_______。
16.(14分)
三氧化二砷(As2O3)是砒霜的主要成分,呈白色粉末状,微溶于水生成亚砷酸,不溶于乙醇,剧毒,可用于治疗急性早幼粒白血病。利用某酸性含砷废水(主要含AsO33−)可提取三氧化二砷,工艺流程如图所示:
已知:① As2S3易溶于过量Na2S溶液中;
② As2O3 + 6NaOH = 2Na3AsO3 + 3H2O。
(1)从物质类别角度判断,As2O3属于_______(填“酸”“碱”“盐”或“氧化物”)。
(2)Na2S的电离方程式为_______。
(3)“Ⅰ沉砷”过程中加入“FeSO4”的目的是_______。
(4)操作M为_______。
(5)As2S3在“Ⅱ焙烧”过程中的化学方程式为_______,滤渣Y为_______。
(6)Ⅰ~Ⅲ步骤中属于非氧化还原反应的有_______(填序号);
(7)当“氧化”过程消耗2.5 ml H2O2时,“还原”过程至少消耗气体X的体积为_______L(标准状况下)。
17.(18分)
金属单质A、B和气体D、M以及物质C、E、F、G、H、I、J之间存在如下的转化关系(图中部分产物和反应条件没有标出),其中A在空气中燃烧,火焰为黄色。
Ⅰ.请根据以上信息回答下列问题:
(1)D的化学名称为_______,I的化学式为_______。
(2)B和水反应的化学方程式为_______,并用双线桥表示电子转移方向和数目。
(3)J和水反应的化学方程式为_______,常温下,J与CO2反应生成一种白色固体,写出该固体的一种用途:_______。
(4)酸性条件下,G + 双氧水→H。该过程中涉及的离子方程式为_______,双氧水可用_______代替(填标号)。
A.氯水 B.O2 C.高锰酸钾溶液 D.碘化钾溶液
(5)将少许饱和H的水溶液滴入沸水中,煮沸一段时间形成红褐色溶液后停止加热,此时形成的分散系为_______(填标号);用一束光照射该分散系可见光亮的“通路”,该现象称为_______效应。
A.溶液 B.胶体C.浊液
Ⅱ.某实验小组认为M的水溶液也能与B发生反应,实验探究过程及实验现象如下图所示:
(6)① 根据实验ⅱ中观察到溶液变为红色,可推知M的水溶液能与B发生反应,则试剂X是_______;
② 实验ⅲ中观察到溶液无明显变化,其原因可能是_______(可结合离子方程式解释)。
18.(16分)
“84消毒液”因在1984年由北京某医院研制使用而得名,在新冠疫情期间广泛使用。某实验小组用Cl2和NaOH溶液反应制备NaClO溶液,并配制一定物质的量浓度的NaClO溶液,装置如下:
回答下列问题:
(1)仪器a的名称是_______,仪器b的作用是_______。
(2)实验室用装置A制备氯气的离子方程式为_______。
(3)实验过程中需要控制装置C的温度,若温度过高易发生副反应:
Cl2 + NaOHNaCl + NaClO3 + H2O(未配平)
则副反应中氧化产物与还原产物的物质的量之比为_______;为避免副反应发生,应对装置C采取的措施是_______。
(4)“84消毒液”的使用说明书指出其不可与洁厕剂(含HCl)混用,原因是_______(用离子方程式解释)。
(5)该兴趣小组欲按体积比为1:50的稀释比例配制500 mL的NaClO溶液,并进行定量的物质的量浓度测定。
ⅰ.配制该溶液时,选用的量筒的规格为_______(填标号,下同),容量瓶的规格为_______;
A.5 mLB.10 mLC.15 mL
D.250 mLE.500 mLF.1000 mL
ⅱ.配制过程中,下列操作会导致溶液浓度偏小的是_______(填标号)。
A.用胶头滴管定容时俯视刻度线
B.使用容量瓶时,发现容量瓶中有少量蒸馏水
C.定容加水时超过刻度线后,用胶头滴管吸出多余的水
D.洗涤量取浓溶液的量筒,并将洗涤液转移至容量瓶
(6)经测定,该兴趣小组自制的NaClO溶液的质量分数为10%,ρ = 1.18 g·mL−1,则该NaClO溶液的物质的量浓度为_______ml·L−1(保留1位小数)。
2023~2024学年度上期高中2023级期末联考
化学参考答案及评分标准
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1~5 CABDB 6~10 BCBCD 11~14 BDCC
二、非选择题:本题共4小题,共58分。
注意:1.本试卷中其他合理答案,可参照此评分标准酌情给分。
2.方程式未写条件或条件不完全、不写“↓”或“↑”均扣一分,不配平不得分。
15.(10分)
(1)H+、Cu2+、NH4+、SO42−(2分,对两个或三个给1分)
Fe3+、Ca2+、CO32−(2分,对一个或两个给1分)
(2)Ag+ + Cl− = AgCl↓(2分)不能(1分)
(3)Cu(OH)2(1分)
(4)Cl−、NO3−(各1分,共2分)
16.(14分)
(1)氧化物(1分)
(2)Na2S = 2Na+ + S2−(2分)
(3)除去过量的Na2S,避免As2S3溶于过量Na2S溶液造成损失(2分,答出“除去过量Na2S”即可)
(4)过滤(1分)
(5)2As2S3 + 9O22As2O3 + 6SO2(2分,条件写“△”或“高温”也可)
Fe2O3(或氧化铁,2分)
(6)Ⅰ、Ⅲ(2分,各1分,见错不给分)
(7)56(2分)
17.(18分)
(1)氢气(1分)Fe(OH)3(1分)
(2)3Fe + 4H2O(g)Fe3O4 + 4H2
失去3×e−
得到8×e−
(方程式2分,没有反应条件或多写气体符号扣1分;双线桥2分,1根线桥1分;共4分)
(3)2Na2O2 + 2H2O = 4NaOH + O2↑(2分)
食用碱、制皂、造纸、制玻璃、去油污等(1分,写出一个即可,其他合理答案也给分)
(4)2H+ + H2O2 + 2Fe2+ = 2Fe3+ + 2H2O(2分)AB(各1分,共2分)
(5)B(1分)丁达尔(1分)
(6)① KSCN溶液(1分)
② Fe + 2Fe3+ = 3Fe2+(2分,或“KSCN被氯水氧化”,合理答案也给分)
18.(16分)
(1)分液漏斗(1分)安全警示(1分,或“防堵塞”,其它合理答案可给分)
(2)MnO2 + 4H+ + 2Cl−Mn2+ + 2H2O + Cl2↑(2分)
(3)1:5(2分)降温(2分,或“充分搅拌”,其他合理答案也给分)
(4)2H+ + Cl− + ClO− = Cl2↑ + H2O(2分)
(5)ⅰ.B(1分)E(1分)
ⅱ.C(2分)
(6)1.6(2分)【解析】
1.C
A.腐蚀覆铜板的“腐蚀液”是FeCl3溶液,A错误;
B.钟乳石的形成不涉及氧化还原反应,B错误;
C.生铁和钢是含碳量不同的两种铁碳合金,C正确;
D.过氧化钠可用在呼吸面具中作氧气的来源,D错误。
2.A
A.由关系Na2O~2Na+,Na2O2~2Na+可知,二者物质的量相同时,所含Na+总数相同,A正确;
B.1 ml MnO2与足量浓盐酸充分反应生成氯气1 ml,因缺少标准状况条件,体积不一定是22.4 L,B错误;
C.由n = cV可知,因未知溶液体积,故无法计算溶液中离子数,C错误;
D.标准状况下,乙醇为液体,无法通过采用Vm = 22.4 L·ml−1进行计算,D错误。
3.B
A.各离子均为无色,NH4+与OH−生成NH3·H2O,Al3+与OH−生成Al(OH)3,不符合题意,A错误;
B.各离子均为无色,且相互不反应,符合题意,B正确;
C.MnO4−为紫色,H+与OH−要反应生成H2O,不符合题意,C错误;
D.Fe2+为浅绿色,不符合题意,D错误。
4.D
A.1.5 ml·L−1 Na2SO4溶液,离子浓度为4.5 ml·L−1,且1 ml Na2SO4阴阳离子所带电荷数为4NA;
B.2.0 ml·L−1 MgCl2溶液,离子浓度为6 ml·L−1,且1 ml MgCl2阴阳离子所带电荷数为4NA;
C.1.5 ml·L−1 HCl溶液,离子浓度为3 ml·L−1,且1 ml HCl阴阳离子所带电荷数为2NA;
D.2.5 ml·L−1 Ba(OH)2溶液,离子浓度为7.5 ml·L−1,且1 ml Ba(OH)2阴阳离子所带电荷数为4NA;
综上,D正确。
5.B
B.铝锅不能煮碱性的食物:2Al + 2OH− + 6H2O = 2[Al(OH)4]− + 3H2↑,B错误。
6.B
A.该原子的核电荷数为15,A正确;
B.红磷、白磷是磷元素的同素异形体,不是同位素,B错误;
C.磷的摩尔质量约为31 g·ml−1,C正确;
D.内层K层和L层电子总数为10,M层电子数为5,二者为2倍关系,D正确。
7.C
① 金属钠着火可用干燥的沙土扑灭,①正确;
② 钠不能从硫酸铜溶液中置换出铜,②错误;
③ Na2O2与水反应生成NaOH和O2,不是碱性氧化物,③错误;
④ NaHCO3可作胃酸中和剂和食用碱,④正确;
⑤ Fe2O3俗称铁红,常作油漆、涂料、油墨和橡胶的红色颜料,⑤正确;
⑥ 合金因其他原子改变了金属原子的层状排列而硬度变大,⑥正确;
综上,C正确。
8.B
A.K2FeO4中K为+1价,O为-2价,Fe为+6价,A正确;
B.ClO−化合价由+1降低到-1价,作氧化剂,Fe3+为还原剂,被氧化,B错误;
C.3ClO−~2FeO42−,故每0.6 ml ClO−参与反应生成0.4 ml FeO42−,C正确;
D.根据题干信息,K2FeO4作净水剂时会产生Fe3+,Fe3+在溶液中能形成Fe(OH)3胶体,具有吸附悬浮物的作用,D正确。
9.C
A.图Ⅰ:正确实验操作是将点燃的氢气插入氯气中燃烧,A错误;
B.图Ⅱ:焰色试验检测钾元素的存在需要透过蓝色钴玻璃观察,B错误;
C.图Ⅲ:观察金属钠与水的反应,将绿豆大小的金属钠投入水中,C正确;
D.图Ⅳ:铁粉、稀硫酸应放入左边试管,NaOH溶液应放入右边试管,D错误。
10.D
A.根据题干信息,检验该工业废水中是否含Fe2+需选用KSCN溶液之外,还需要双氧水等氧化性溶液,A错误;
B.溶液D为FeSO4溶液,向其中滴加NaOH溶液生成沉淀由白色迅速变为灰绿色,最终转化为红褐色,B错误;
C.试剂①是铁粉,试剂②是稀硫酸,若试剂②使用稀盐酸会引入新杂质Cl−,C错误;
D.操作Ⅱ包括:蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥,D正确。
11.B
A.标准状况下,36.5 g HCl的物质的量为36.5 g ÷ 36.5 g·ml−1 = 1 ml,所含原子的数目为2NA;
B.5.6 L H2O的物质的量为5.6 × 103 mL × 1 g·mL−1 ÷ 18 g·ml−1≈311 ml,所含原子的数目约为311 ml × 3 = 933 ml = 933NA,
C.3.01 × 10−23个SO2的物质的量为0.5 ml,所含原子的数目为0.5 ml × 3 = 1.5 ml = 1.5NA;
D.1.5 ml CH4的原子数目为1.5 ml × 5 = 7.5 ml = 7.5NA;
综上,所含原子的数目关系为:B > D > A > C,B正确。
12.D
A.Cl2可将FeCl2转化为FeCl3:Cl2 + 2FeCl2 = 2FeCl3,A正确;
B.CO2可将Na2CO3转化为NaHCO3:CO2 + H2O + Na2CO3 = 2NaHCO3,B正确;
C.CO2与NaOH溶液反应:CO2 + 2NaOH = Na2CO3 + H2O,C正确;
D.除去Cl2中的HCl需要选用饱和NaCl溶液,D错误;
13.C
A.a为HCl,d为HClO,HClO见光易分解生成HCl,A正确;
B.b为Cl2,干燥的Cl2能使有色鲜花变色,B正确;
C.c的化学式为ClO2,可用于自来水杀菌消毒,C错误;
D.e为NaClO,是漂白液的有效成分,可用作棉麻、纸张的漂白剂和游泳池的消毒剂,D正确。
14.C
A.操作Ⅰ为搅拌、操作Ⅲ为过滤,A错误;
B.操作Ⅱ若未使用H2O2,导致沉淀c为Fe(OH)2和Fe(OH)3,二者充分灼烧均转化为Fe2O3,并不影响固体d的质量,B错误;
C.灼烧需要的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳等,C正确;
D.固体d为32 g Fe2O3,n(Fe2O3) = 0.2 ml,n(Fe) = 0.4 ml,则30.4 g FexOy中,
,n(Fe):n(O) = 4:5,D错误。
15.(10分)
根据题干信息,该溶液为透明澄清溶液,不能确定是否含有色离子;
① 取少量该溶液,滴入紫色石蕊溶液显红色,可知溶液含有H+,则溶液中不存在CO32−;
② 取少量该溶液,加入过量BaCl2溶液,有白色沉淀生成,且不溶于稀硝酸,说明沉淀为BaSO4,可知原溶液中含有SO42−,则溶液中不存在Ca2+;
③ 取②中反应后的上层清液,加入酸化的AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸,说明沉淀为AgCl,但是②中加入过量BaCl2溶液时,引入了Cl−,不能确定原溶液中是否含有Cl−;
④ 取少量原溶液,加入过量的NaOH溶液,有蓝色沉淀生成,该沉淀为Cu(OH)2,原溶液中含有Cu2+,且不含Fe3+;加热时产生气体使紫色石蕊溶液显蓝色,说明该气体为NH3,原溶液中含有NH4+。
综上,根据实验操作①~④,可推知溶液中一定存在的离子是H+、Cu2+、NH4+、SO42−,溶液中肯定不存在的离子是Fe3+、Ca2+、CO32−。
(4)已知溶液中阳离子的物质的量浓度均为0.1 ml·L−1,即c(H+) + c(Cu2+)×2 + c(NH4+) - c(SO42−)×2 = 0.2 ml·L−1,故确定溶液中一定还含有浓度均为0.1 ml·L−1的Cl−和NO3−。
16.(14分)
(3)“Ⅰ沉砷”过程中,根据题干信息:As2S3易溶于过量Na2S溶液中,故加入FeSO4的目的是除去过量Na2S,避免As2S3溶于过量Na2S溶液造成损失。
(4)分离溶液和难溶物As2S3、FeS的操作为过滤。
(5)As2S3在“Ⅱ焙烧”过程中的化学方程式为2As2S3 + 9O22As2O3 + 6SO2,As2S3、FeS在“Ⅱ焙烧”过程中的产物As2O3、Fe2O3进入“Ⅲ碱浸”,根据已知信息:As2O3 + 6NaOH = 2Na3AsO3 + 3H2O,Fe2O3不与NaOH反应。综上,滤渣Y为Fe2O3。
(6)“Ⅰ沉砷”过程中,FeSO4 + Na2S → FeS + Na2SO4,化合价没有变化;AsO33− + Na2S → As2S3,化合价没有变化;“Ⅱ焙烧”涉及As2S3、FeS分别与空气中氧气反应转化为As2O3、Fe2O3和SO2;“Ⅲ碱浸”过程中,As2O3 + 6NaOH = 2Na3AsO3 + 3H2O,化合价没有变化;综上,Ⅰ~Ⅲ过程中属于非氧化还原反应的有Ⅰ、Ⅲ。
(7)As2O3被H2O2氧化后,又被SO2还原为As2O3,实际为H2O2氧化SO2,由反应:H2O2 + SO2 = H2SO4,得关系H2O2~SO2。综上,“氧化”过程消耗2.5 ml H2O2时,“还原”过程至少消耗气体SO2的体积为22.4 L·ml−1 × 2.5 ml = 56 L(标准状况下)。
17.(18分)
结合题干信息和转化关系图,A在空气中燃烧,火焰为黄色,可推知A为金属Na;气体M为黄绿色,可推知M为Cl2;红褐色沉淀I为Fe(OH)3,则B为金属单质Fe;故J为Na2O2,C为NaOH,D为H2,E为Fe3O4,F为HCl。
(4)2H+ + H2O2 + 2Fe2+ = 2Fe3+ + 2H2O,双氧水是氧化剂,代替双氧水可选择有氧化性的氯水、O2、高锰酸钾溶液,G中有Cl−,高锰酸钾溶液可氧化Cl−生成污染性的氯气,综上A、B符合题意。
(6)① 根据实验ⅱ中观察到溶液变为红色,可推知铁粉与氯水反应生成Fe3+,与KSCN溶液反应显红色;
② 7 min后,实验ⅲ中观察到溶液无明显变化,说明Fe粉已将Fe3+转化为Fe2+,或KSCN溶液被氯水氧化。
18.(16分)
(3)3Cl2 + 6NaOH5NaCl + NaClO3 + 3H2O,NaCl是还原产物,NaClO3是氧化产物,故氧化产物与还原产物之比为1:5;根据题干信息,温度过高副反应发生,故采取降温或充分搅拌等控温方式
(4)酸性条件下Cl−和ClO−发生归中反应生成了氯气。
(5)ⅰ.该兴趣小组欲按体积比1:50稀释比例配制500 mL NaClO溶液,设需要浓NaClO溶液x mL,则,x = 10 mL,故选用量筒规格10 mL,容量瓶规格为500 mL;
ⅱ.A选项,定容时俯视刻度线,会导致溶液体积偏小,根据公式,导致配制的物质的量浓度偏高;B选项,容量瓶中有少量蒸馏水对配制溶液的物质的量浓度没有影响;C选项,定容加水超过刻度线,用胶头滴管吸出多余的水时,会带走少量溶质,导致配制溶液的物质的量浓度偏低;D选项,洗涤量取浓溶液的量筒,并将洗涤液转移至容量瓶会导致溶质的物质的量偏大,配制的溶液的物质的量浓度偏高;综上,C选项符合题意。
(6)根据,将题干数据带入公式,解得c ≈ 1.6 ml·L−1。
选项
主要物质
杂质
除杂试剂
A
FeCl3溶液
FeCl2
Cl2
B
NaHCO3溶液
Na2CO3
CO2
C
CO
CO2
NaOH溶液
D
Cl2
HCl
饱和NaHCO3溶液
资料卡片:“84消毒液”的使用说明书
① 有效成分:NaClO
② 注意事项:不可与洁厕剂或其他消毒液混合使用,特别是盐酸等酸性物质,否则会产生有毒气体引发中毒……
③ 用法用量:
消毒对象
稀释比例
消毒时间(min)
消毒方法
餐饮器具
1:100
10
擦拭、浸泡、喷洒
环境,物体表面
1:50
10~15
擦拭、喷洒
四川省成都市蓉城名校联盟2023-2024学年高二上学期期末联考化学试题含答案: 这是一份四川省成都市蓉城名校联盟2023-2024学年高二上学期期末联考化学试题含答案,共15页。试卷主要包含了8 kJ·ml−1;,3 kJ·ml−1,7×10−17等内容,欢迎下载使用。
四川省成都市蓉城名校联盟2023-2024学年高一上学期期末联考化学试题(Word版附答案): 这是一份四川省成都市蓉城名校联盟2023-2024学年高一上学期期末联考化学试题(Word版附答案),共13页。试卷主要包含了5 Fe 56,5 ml Na2O与0,5 g HClB.5等内容,欢迎下载使用。
四川省成都市蓉城名校联盟2023-2024学年高二上学期期末联考化学试题(Word版附解析): 这是一份四川省成都市蓉城名校联盟2023-2024学年高二上学期期末联考化学试题(Word版附解析),共11页。试卷主要包含了8 kJ·ml−1;,3 kJ·ml−1,7×10−17等内容,欢迎下载使用。












