

2022年高三化学寒假同步练习(含答案):04实验化学起步 课时2 练习1
展开
这是一份2022年高三化学寒假同步练习(含答案):04实验化学起步 课时2 练习1,共8页。试卷主要包含了实验成功的关键,蓝瓶子实验等内容,欢迎下载使用。
基础过关]
一、实验成功的关键
1.下列说法正确的是 ( )
A.催化剂只能加快化学反应速率
B.光是影响某些化学反应速率的外界条件之一
C.决定化学反应速率的主要因素是浓度
D.不管什么反应,增大浓度,或加热,或加压,都可以加快反应速率
2.利用维生素C能使淀粉碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C浓度的大小。要得出正确结论,在实验时需要控制的条件是 ( )
A.实验时必须向两烧杯中同时滴加液体
B.淀粉碘溶液的体积和浓度必须相等
C.胶头滴管滴出的果汁的滴数必须相等
D.胶头滴管滴出的每滴果汁的体积不需要相等
3.要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的合理顺序是 ( )
①加足量氯水 ②加足量酸性高锰酸钾溶液 ③加足量硫氰化钾溶液
A.①③ B.②③ C.③① D.①②③
4.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 ml·L-1的硫酸,其他试剂任选。填写下列空白。
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是______,A中反应的离子方程式是_____________________________________________________________________。
(2)实验开始时应先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程_______________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,所观察到的现象是_______________________
___________________________________________________________________________。
二、蓝瓶子实验
5.下列说法不正确的是 ( )
A.亚甲基蓝是一种蓝色染料
B.亚甲基白是一种白色染料
C.亚甲基蓝具有可燃性
D.亚甲基白具有可燃性
6.下列说法不正确的是 ( )
A.微热可以促使亚甲基蓝变为亚甲基白
B.微热可以促使亚甲基白变为亚甲基蓝
C.碱性条件下,亚甲基蓝易变为亚甲基白
D.酸性条件下,亚甲基蓝易变为亚甲基白
7.向葡萄糖稀溶液中滴入几滴0.1%亚甲基蓝溶液,振荡,现象是__________________;加入几毫升30%NaOH溶液,振荡,现象是________________________________;加热所得溶液,现象是__________________;向上述溶液中用玻璃管吹气,现象是__________________;静置,现象是______________________。
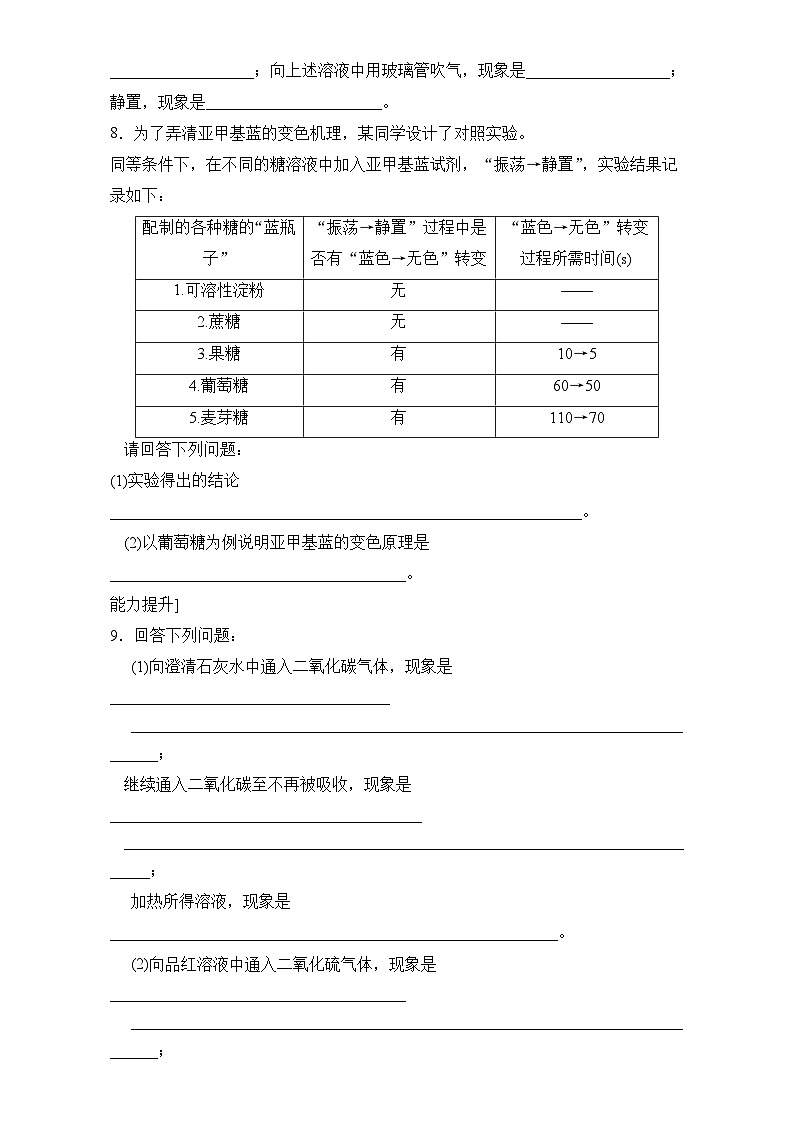
8.为了弄清亚甲基蓝的变色机理,某同学设计了对照实验。
同等条件下,在不同的糖溶液中加入亚甲基蓝试剂,“振荡→静置”,实验结果记录如下:
请回答下列问题:
(1)实验得出的结论___________________________________________________________。
(2)以葡萄糖为例说明亚甲基蓝的变色原理是_____________________________________。
能力提升]
9.回答下列问题:
(1)向澄清石灰水中通入二氧化碳气体,现象是___________________________________
___________________________________________________________________________;
继续通入二氧化碳至不再被吸收,现象是_______________________________________
___________________________________________________________________________;
加热所得溶液,现象是________________________________________________________。
(2)向品红溶液中通入二氧化硫气体,现象是_____________________________________
___________________________________________________________________________;
继续通入二氧化硫至不再被吸收,现象是_______________________________________;
加热所得溶液,现象是_______________________________________________________。
(3)向葡萄糖溶液中滴几滴稀亚甲基蓝溶液,振荡,现象是_________________________
___________________________________________________________________________;
再加入氢氧化钠溶液,静置,现象是____________________________________________
___________________________________________________________________________;
振荡,现象是_______________________________________________________________
___________________________________________________________________________。
10.方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2沉淀。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀硫酸和________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是,用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_______________________________
__________________________________________________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2沉淀。
(1)在试管Ⅰ里加入的试剂是____________。
(2)在试管Ⅱ里加入的试剂是____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是____________________________________________________________
________________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______________________
________________________________________________________________________。
11.下表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题;
(1)实验4和5表明,______________________对反应速率有影响,______________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因。
拓展探究]
12.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有_______________________________________
__________________________________________________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________
__________________________________________________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是____________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有_________________________
__________________________________________________________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______,V6=______,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________________________________________
_________________________________________________________________________。
答案
1.B 2.B 3.C
4.(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开 H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)白色沉淀很快变为灰绿色,最终变为红褐色
5.B 6.D
7.溶液呈现蓝色 溶液先变无色然后变蓝色 再次呈现无色 溶液又变蓝色 溶液再次呈现无色
8.(1)可溶性淀粉和蔗糖为非还原性糖;使用不同的还原性糖,亚甲基蓝的振荡周期不同
葡萄糖
(2)亚甲基蓝(蓝色、氧化态) 亚甲基白(无色、还原态)
氧气
9.(1)溶液变浑浊 溶液变澄清 溶液又变浑浊
(2)品红褪色 无明显变化 溶液恢复红色
(3)溶液呈蓝色 溶液由蓝色变无色 溶液由无色变蓝色
10.方法一:(1)铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀硫酸、铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
11.(1)固体反应物的表面积 表面积越大 1和2
(2)3和4
(3)开始反应温度 6和7
(4)一定量的金属跟足量的硫酸反应放出的热量相同。
12.(1)Zn+CuSO4===ZnSO4+Cu,Zn+H2SO4===ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率
(3)Ag2SO4
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等
(5)①30 10 17.5
②灰黑 暗红
③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积
配制的各种糖的“蓝瓶子”
“振荡→静置”过程中是否有“蓝色→无色”转变
“蓝色→无色”转变过程所需时间(s)
1.可溶性淀粉
无
——
2.蔗糖
无
——
3.果糖
有
10→5
4.葡萄糖
有
60→50
5.麦芽糖
有
110→70
实验
序号
金属
质量/g
金属状态
eq \f(cH2SO4,ml·L-1)
eq \f(VH2SO4,mL)
溶液温度/℃
金属消失的时间/s
反应前
反应后
1
0.10
丝
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
3
0.10
丝
0.7
50
20
36
250
4
0.10
丝
0.8
50
20
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
丝
1.0
50
20
35
125
7
0.10
丝
1.0
50
35
50
50
8
0.10
丝
1.1
50
20
34
100
9
0.10
丝
1.1
50
20
44
40
实验
混合溶液
A
B
C
D
E
F
4 ml·L-1H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
相关试卷
这是一份2022年高三化学寒假同步练习(含答案):12物质的分离和提纯 课时2 练习1,共6页。试卷主要包含了渗析原理应用,蒸馏原理应用,蒸发与分馏原理的应用等内容,欢迎下载使用。
这是一份2022年高三化学寒假同步练习(含答案):11物质的分离与提纯 课时1 练习2,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2022年高三化学寒假同步练习(含答案):06实验化学起步 课时3 练习,共2页。









