

备战中考化学考点总复习 专题12 酸碱中和与pH【考点精讲】(全国通用)(原卷版+解析版)
展开备考指导
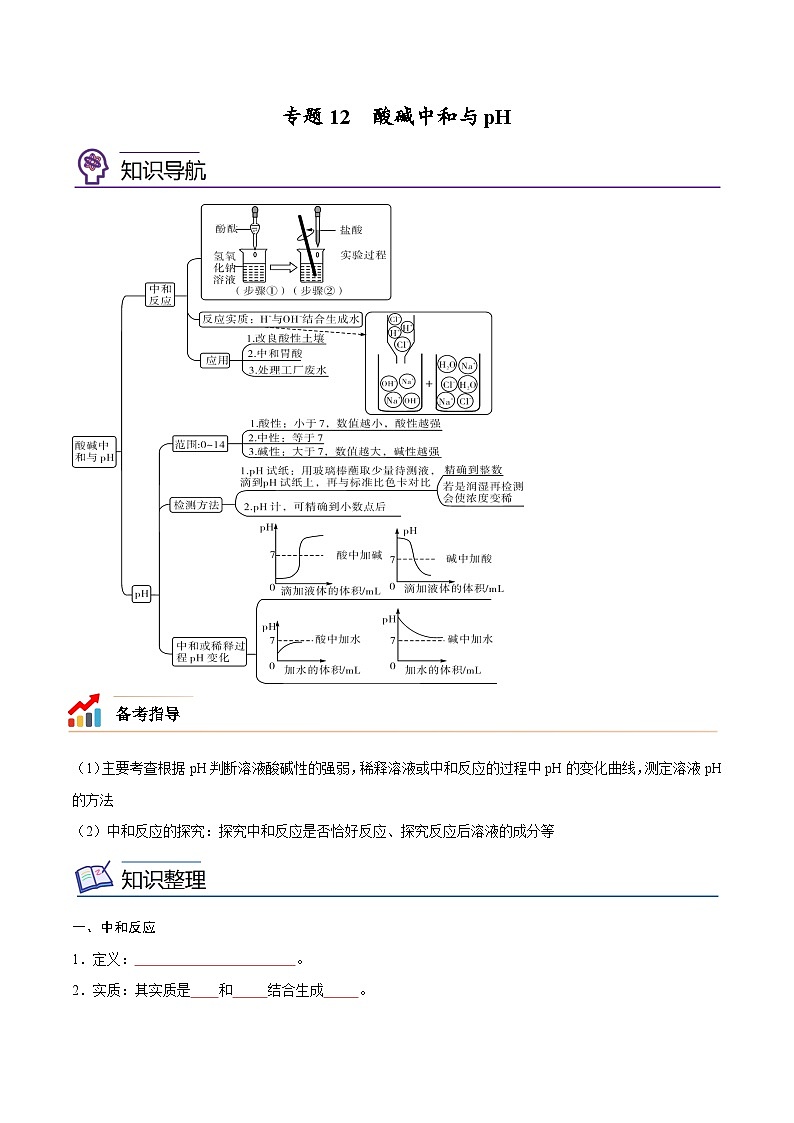
(1)主要考查根据pH判断溶液酸碱性的强弱,稀释溶液或中和反应的过程中pH的变化曲线,测定溶液pH的方法
(2)中和反应的探究:探究中和反应是否恰好反应、探究反应后溶液的成分等
一、中和反应
1.定义: 。
2.实质:其实质是 和 结合生成 。
3.温馨提示:中和反应不属于四大基本反应类型,基本反应类型有:①、置换反应;②
③ ④化合反应;但是中和反应属于其中的 。
4.应用:
(1)用于医药卫生
① 胃酸过多可以服用某些 物质的药物,以中和过多的胃酸。胃舒平的主要成分是Al(OH)3,其治疗胃酸的化学方程式 。
② 因为铝元素对人体的健康有影响,现在普遍采用Mg(OH)2代替Al(OH)3治疗胃酸过多,反应的化学方程式是 。
(2)改变土壤的酸碱性
如:酸性土壤不利于作物的生长,于是人们将适量的 加入土壤以中和酸性。
(3)处理工厂的废水
如:硫酸厂的污水可以用 进行中和处理,化学方程式: 。
调节溶液的酸碱性
八、溶液酸碱度的表示法——pH
1.溶液的pH与酸碱性关系
① pH=7,溶液呈 ;
② pH<7,溶液呈 ,pH越小,酸性 ,即:H+的浓度越高酸性越强;
③ pH>7,溶液呈 ,pH越大,碱性 ,即:OH-的浓度越高碱性越强。
pH值:1 2 3 4 5 6 7 8 9 10 11 12 13 14
酸性增强 中性 碱性增强
2.pH的测定:最简单的方法是使用pH试纸
(1)①在洁净干燥的 板上放一片pH试纸;②用洁净干燥的 蘸取待测试液;③滴在 (试纸不能预先用水润湿)上,④ 将试纸显示的颜色与 对照,⑤便可读出溶液的pH(注意:读数精确到 。(简记为:放、蘸、滴、对、读)
(2)pH试纸不能用水预先润湿否则,若溶液是酸性的则酸性减弱pH会 ;若溶液是碱性的则碱性减弱pH会 ;若溶液是中性则没有影响 。
3.酸碱性与酸碱度关系:
考点1:中和反应及其用途
【例1】(中和反应的分辨)下列化学反应中属于中和反应的是( )
A.Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O B.Zn + H2SO4 ZnSO4 + H2↑
C.Mg(OH)2 + 2HCl MgCl2 + 2H2O D.CuSO4 + 2NaOH Na2SO4 + Cu(OH)2↓
【例2】(中和反应的微观图)(2021·河南)氢氧化钠溶液与盐酸反应的化学方程式为______,如图是该反应的微观示意图,则该反应前后没有发生变化的离子有______,从微观角度看,该化学反应的实质是______。
【例3】(中和反应的用途)下列做法利用了酸碱中和反应原理的是( )
A.用食醋腌木瓜放入食盐进行调味 B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松 D.服用含氢氧化铝的药物治疗胃酸过多症
中和反应是一个常考点,考查有关反应的pH变化图象、中和反应的应用、中和实验的探究等,特别注意酸溶液加入碱溶液中与碱溶液加入酸溶液中的pH图象的区别;酸与碱发生中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如某些非金属氧化物与碱溶液的反应也生成盐和水,但不属于中和反应。
1.下列药物可用于冶疗胃酸过多,且原理属于中和反应的是( )
A.氧化镁粉 B.Al(OH)3 C.VC泡腾片 D.苏打水(主要成分为NaHCO3)
2.下列关于中和反应的说法,正确的是( )
A.纯碱(Na2CO3)和稀盐酸混合后发生中和反应
B.有盐和水生成的反应一定是中和反应
C.进行中和反应时,可用玻璃棒搅拌使反应充分进行并帮助反应散热
D.中和反应的发生必须借助酸碱指示剂进行判断
3.将盐酸滴入到氢氧化钠溶液中,右图所反映的是( )
A.反应后的溶液显碱性
B.反应后溶液中存在的粒子只有Na+ 和Cl-
C.反应的实质是H+ 和OH- 结合生成水
D.反应前后各元素的化合价均发生变化
4.蚊子、蜂、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛,要消除肿痛,可涂下列物质中的( )
A.硼酸 B.食用醋 C.氢氧化钠溶液 D.稀氨水或肥皂水
5.(2021·山东)某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100 g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当pH=13时,溶液中所含的溶质是______(填化学式)。
(2)当恰好中和时,消耗的稀硫酸的质量为______。
(3)计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
考点2:常见酸碱指示剂与pH
【例4】(酸碱指示剂)下列溶液能使紫色石蕊溶液变成蓝色的是( )
A.澄清石灰水B.NaCl溶液 C.稀硫酸D.KNO3溶液
【例5】(PH认识)(2021·浙江衢州市·中考真题)如图是我们常见的水果及其近似pH,其中酸性最强的是( )
A.西瓜pH=6.6B.葡萄pH=5.1
C.猕猴桃pH=3.3D.桔子pH=3.6
【例6】(酸雨的分辨)下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性 B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨 D.酸溶液的pH越小酸性越强
【例7】(中和稀释PH变化)在一定质量的NaOH溶液中逐滴加入稀盐酸,如图中能正确表示溶液的pH变化的是(横坐标表示加入稀盐酸的质量,纵坐标表示溶液的pH)( )
1.碱性溶液能使酚酞变红,但使酚酞变红的不一定是碱,如碳酸钠溶液。
2.不能使酚酞溶液变红的溶液不一定是酸溶液,也可能是中性溶液。
3.不能使酚酞溶液变红的溶液不一定是酸性溶液,也可能是中性溶液。
1.(2021·湖南株洲市·中考真题)下表列出了一些物质在常温下的近似pH。下列有关说法正确的是( )
A.所有的食物均呈酸性
B.pH<7的雨水称为酸雨
C.向肥皂水中滴加酚酞,溶液呈红色
D.清理厨房顽固油渍时,将厕所清洁剂与炉具清洁剂混合使用,效果更佳
2.(2022年江苏省连云港市中考)下列是人体几种体液的正常pH范围,其中呈酸性的是( )
A.胰液7.5~8.0B.胆汁7.1 ~7.3
C.血浆7.35~7.45D.胃液0.9 ~1.5
3.(2022年四川省成都市中考)部分水果及饮料的pH如下:
下列说法正确的是( )
A.西瓜汁显碱性B.橘子汁中滴入酚酞,溶液变红
C.苏打水显酸性D.胃酸过多的人应该少饮柠檬水
4.下列各组物质的反应,需要加入酸碱指示剂才能判断反应发生的是( )
A.Fe和CuSO4溶液 B.Ba(OH)2溶液和稀H2SO4
C.澄清石灰水和CO2 D.Ca(OH)2溶液和稀盐酸
5.(2022河北中考)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是( )
A. N点时的溶液一定呈红色
B. P点时的溶液能与纯碱发生反应
C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
考点3:中和反应的实验探究
1. 探究过程
2. 实验分析
(1)反应的实质:酸溶液中的H+和碱溶液中的OH-结合生成了水(H++OH-══H2O)。
(2)酸、碱是否发生反应以及反应的程度的判断
① 借助酸碱指示剂(酚酞溶液)的颜色变化:向碱溶液中滴入最后一滴酸,溶液由红色变无色,则反应完全;向酸溶液中滴入最后一滴碱,溶液由无色变红色,则反应完全
② 借助溶液的温度的变化:酸碱反应时会发生放热现象,温度会上升,当温度上升到最高时,表示反应完全(注意:若是酸溶液中直接加入氢氧化钠固体,温度上升,则不能判断两者一定发生反应,因为氢氧化钠固体溶于水会放热)
③ 借助溶液的pH变化:若溶液的pH=7时,表示反应完全
【例6】(2022年山东省泰安市中考)在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老帅引导下开展实验探究活动,请你参与下列活动。
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。
(1)测定溶液pH变化的方法
甲同学在实验过程中测得pH变化如图1所示,则该同学是将_______(填字母序号)。
a.氢氧化钾溶液滴入稀硫酸中 b.稀硫酸滴入氢氧化钾溶液中
(2)测混合过程中的温度变化
乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是_______(填“放热”或“吸热”)反应。图2中B点表示的含义是_______。
(3)借助于酸碱指示剂
丙同学通过图3所示实验,他观察到溶液由红色变成无色,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为_______。
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】
猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4)丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是_______。
(5)同学们经过反思与讨论,最后认为方案一中的Fe2O3粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出可用药品的字母序号_______。
A.Mg B.CuO C.KCl D.Na2CO3
(6)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑_______。
1. (2021·黑龙江绥化市)中和反应在日常生活和工农业生产中有广泛的应用。
(1)向盛有一定量稀盐酸的密闭隔热容器中,加入氢氧化钠固体,利用数字传感器测出反应时间与溶液温度变化的图象如图所示。
①甲同学得出结论:稀盐酸和氢氧化钠反应过程中放热。乙同学不同意他的观点,乙同学的理由是______。
②丙同学取少量反应后的溶液于试管中,加入无色酚酞溶液,无明显现象,于是三位同学对反应后溶液中溶质的成分作出猜想:
猜想一:NaCl 猜想二:NaCl和NaOH 猜想三:______
③同学们经过讨论后认为猜想______一定不正确。
④为了验证其余猜想,丙同学进行如下探究。
(2)丁同学在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀硫酸,边不断振荡试管,至溶液颜色______为止,说明氢氧化钠和稀硫酸恰好完全反应,该反应的化学方程式为______。
(3)结合上述实验,中和反应的实质是______。
指示剂
pH值
石蕊
酚酞
酸性
无色
中性
无色
碱性
A
B
C
D
物质
厕所清洁剂
橘子
西瓜
鸡蛋清
肥皂
炉具清洁剂
pH
1~2
3~4
6-7
7-8
9-10
12~13
实验装置示意图
实验步骤
实验现象
实验结论
(1)向烧杯中加入10 mL氢氧化钠溶液,滴入几滴酚酞溶液溶液
溶液变红色
碱能使酚
酞变红色
(2)向上述烧杯中边滴加稀盐酸边搅拌,直至溶液恰好变无色为止
溶液红色逐渐
变浅直至消失
氢氧化钠与盐酸发
生了反应:NaOH+HCl═NaCl+H2O
(3)取上述溶液约3 mL放入蒸发皿中加热
液体蒸干后出
现白色固体
氢氧化钠与盐酸反应
生成了氯化钠
实验方案
实验操作
实验现象
实验结论
方案一
取少量反应后的溶液于试管中,加入Fe2O3粉末
_______
溶液中有H2SO4猜想二正确
方案二
取少量反应后的溶液于试管中,滴加BaCl2溶液
②产生白色沉淀
溶液中有H2SO4,猜想二正确
实验操作
实验现象
实验结论
另取少量反应后的溶液于试管中,加入锌粒
______
猜想三正确
专题12 酸碱中和与pH
备考指导
(1)主要考查根据pH判断溶液酸碱性的强弱,稀释溶液或中和反应的过程中pH的变化曲线,测定溶液pH的方法
(2)中和反应的探究:探究中和反应是否恰好反应、探究反应后溶液的成分等
一、中和反应
1.定义:酸和碱作用生成盐和水的反应。
2.实质:其实质是H+和OH结合生成H2O。
3.温馨提示:中和反应不属于四大基本反应类型,基本反应类型有:①、置换反应;②复分解反应 ③分解反应④化合反应;但是中和反应属于其中的复分解反应。
4.应用:
(1)用于医药卫生
① 胃酸过多可以服用某些碱性物质的药物,以中和过多的胃酸。胃舒平的主要成分是Al(OH)3,其治疗胃酸的化学方程式3HCl + Al(OH)3 ==AlCl3 + 3H2O。
② 因为铝元素对人体的健康有影响,现在普遍采用Mg(OH)2代替Al(OH)3治疗胃酸过多,反应的化学方程式是2HCl + Mg (OH)2 == MgCl2+ 2H2O。
(2)改变土壤的酸碱性
如:酸性土壤不利于作物的生长,于是人们将适量的熟石灰加入土壤以中和酸性。
(3)处理工厂的废水
如:硫酸厂的污水可以用熟石灰进行中和处理,化学方程式:H2SO4 + Ca(OH)2 == CaSO4+ 2H2O。
调节溶液的酸碱性
二、溶液酸碱度的表示法——pH
1.溶液的pH与酸碱性关系
① pH=7,溶液呈中性;
② pH<7,溶液呈酸性,pH越小,酸性越强,即:H+的浓度越高酸性越强;
③ pH>7,溶液呈碱性,pH越大,碱性越强,即:OH-的浓度越高碱性越强。
pH值:1 2 3 4 5 6 7 8 9 10 11 12 13 14
酸性增强 中性 碱性增强
2.pH的测定:最简单的方法是使用pH试纸
(1)①在洁净干燥的玻璃片或白瓷板上放一片pH试纸;②用洁净干燥的玻璃棒蘸取待测试液;③滴在pH试纸(试纸不能预先用水润湿)上,④立即将试纸显示的颜色与标准比色卡对照,⑤便可读出溶液的pH(注意:读数精确到整数。(简记为:放、蘸、滴、对、读)
(2)pH试纸不能用水预先润湿否则,若溶液是酸性的则酸性减弱pH会偏大;若溶液是碱性的则碱性减弱pH会偏小;若溶液是中性则没有影响pH不变。
3.酸碱性与酸碱度关系:
考点1:中和反应及其用途
【例1】(中和反应的分辨)下列化学反应中属于中和反应的是( )
A.Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O B.Zn + H2SO4 ZnSO4 + H2↑
C.Mg(OH)2 + 2HCl MgCl2 + 2H2O D.CuSO4 + 2NaOH Na2SO4 + Cu(OH)2↓
【答案】C
【解析】中和反应是指酸和碱反应生成盐和水。
【例2】(中和反应的微观图)(2021·河南)氢氧化钠溶液与盐酸反应的化学方程式为______,如图是该反应的微观示意图,则该反应前后没有发生变化的离子有______,从微观角度看,该化学反应的实质是______。
【答案】 Na+、C1- 氢离子与氢氧根离子结合生成水(或)
【解析】
氢氧化钠溶液与盐酸反应生成氯化钠和水,反应的化学方程式为:NaOH+HC1=NaC1+H2O,如图是该反应的微观示意图,则该反应前后没有发生变化的离子Na+、C1-,从微观角度看,该化学反应的实质是氢离子与氢氧根离子结合生成水或者H++OH-=H2O 。
【例3】(中和反应的用途)下列做法利用了酸碱中和反应原理的是( )
A.用食醋腌木瓜放入食盐进行调味 B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松 D.服用含氢氧化铝的药物治疗胃酸过多症
【答案】D
【解析】A、用食醋腌木瓜放入食盐进行调味,没有发生酸与碱生成盐和水的反应,没有运用中和反应原理,故选项错误;
B、铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,是利用了酸能与金属氧化物反应生成盐和水,没有运用中和反应原理,故选项错误;
C、焙制蛋糕时加入碳酸氢钠使蛋糕膨松,主要是利用了碳酸氢钠受热生成碳酸钠、水和二氧化碳,没有运用中和反应原理,故选项错误;
D、Al(OH)3与胃酸中的盐酸反应生成氯化铝和水,是酸和碱的反应,是利用了中和反应原理,故选项正确。故选D。
中和反应是一个常考点,考查有关反应的pH变化图象、中和反应的应用、中和实验的探究等,特别注意酸溶液加入碱溶液中与碱溶液加入酸溶液中的pH图象的区别;酸与碱发生中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如某些非金属氧化物与碱溶液的反应也生成盐和水,但不属于中和反应。
1.下列药物可用于冶疗胃酸过多,且原理属于中和反应的是( )
A.氧化镁粉 B.Al(OH)3 C.VC泡腾片 D.苏打水(主要成分为NaHCO3)
【答案】B
【解析】胃酸主要成分为盐酸,用于冶疗胃酸过多需要能与盐酸反应,氧化镁和Al(OH)3可以,但是氧化镁是金属氧化物,与盐酸反应不是中和反应。
2.下列关于中和反应的说法,正确的是( )
A.纯碱(Na2CO3)和稀盐酸混合后发生中和反应
B.有盐和水生成的反应一定是中和反应
C.进行中和反应时,可用玻璃棒搅拌使反应充分进行并帮助反应散热
D.中和反应的发生必须借助酸碱指示剂进行判断
【答案】C
【解析】
A.中和反应是指酸和碱反应,纯碱是盐不是碱,不符合题意;
B.有盐和水生成的反应还可以是金属氧化物与酸的反应,例如氧化铁与盐酸反应生成氯化铁和水,不符合题意;
C.中和反应是放热反应,,可用玻璃棒搅拌使反应充分进行并帮助反应散热,符合题意;
D.有颜色的碱不需要指示剂,不符合题意。
3.将盐酸滴入到氢氧化钠溶液中,右图所反映的是( )
A.反应后的溶液显碱性
B.反应后溶液中存在的粒子只有Na+ 和Cl-
C.反应的实质是H+ 和OH- 结合生成水
D.反应前后各元素的化合价均发生变化
【答案】 C
【解析】
A.反应后生成氯化钠溶液,溶液显中性,不符合题意;
B.反应后溶液中还有水分子,不符合题意;
C.反应的实质是H+ 和OH- 结合生成水,符合题意;
D.反应前后各元素的化合价均没有车发生变化,不符合题意。
4.蚊子、蜂、蚂蚁等昆虫叮咬人后,会向人体注入一种叫蚁酸(甲酸)的物质,使皮肤红肿疼痛,要消除肿痛,可涂下列物质中的( )
A.硼酸 B.食用醋 C.氢氧化钠溶液 D.稀氨水或肥皂水
【答案】D
【解析】蚁酸(甲酸)显酸性,应涂抹显碱性的物质并且应该对人无害。
5.(2021·山东)某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100 g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)当pH=13时,溶液中所含的溶质是______(填化学式)。
(2)当恰好中和时,消耗的稀硫酸的质量为______。
(3)计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
【答案】(1)Na2SO4、NaOH
(2)50 g
(3)解:设100 g炉具清洁剂中NaOH的质量为x
解得x=4 g
该炉具清洁剂中氢氧化钠的质量分数
答:该炉具清洁剂中氢氧化钠的质量分数为4%。
考点2:常见酸碱指示剂与pH
【例4】(酸碱指示剂)下列溶液能使紫色石蕊溶液变成蓝色的是( )
A.澄清石灰水B.NaCl溶液 C.稀硫酸D.KNO3溶液
【答案】A
【解析】A、澄清石灰水显碱性,能使紫色石蕊溶液变成蓝色,故选项正确。
B、氯化钠溶液显中性,不能使紫色石蕊溶液变色,故选项错误。
C、稀硫酸显酸性,能使紫色石蕊溶液变红色,故选项错误。
D、硝酸钾溶液显中性,不能使紫色石蕊溶液变色,故选项错误。
故选:A。
【例5】(PH认识)(2021·浙江衢州市·中考真题)如图是我们常见的水果及其近似pH,其中酸性最强的是( )
A.西瓜pH=6.6B.葡萄pH=5.1
C.猕猴桃pH=3.3D.桔子pH=3.6
【答案】C
【分析】当溶液的pH等于7时,呈中性。当溶液的pH大于7时,呈碱性。当溶液的pH小于7时,呈酸性。当溶液的pH<7时,随着pH的减小酸性增强。
【解析】由题干中四种物质的pH可知,猕猴桃的pH最小,因此其酸性最强。
故选C。
【例6】(酸雨的分辨)下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性 B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨 D.酸溶液的pH越小酸性越强
【答案】C
【解析】pH<5.6的雨水一定是酸雨
【例7】(中和稀释PH变化)在一定质量的NaOH溶液中逐滴加入稀盐酸,如图中能正确表示溶液的pH变化的是(横坐标表示加入稀盐酸的质量,纵坐标表示溶液的pH)( )
【答案】B
【解析】NaOH溶液显碱性,PH值大于7,排除A选项,加入稀盐酸后发生中和反应,PH值减小,稀盐酸溶液显酸性,最后稀盐酸过量PH值小于7。
1.碱性溶液能使酚酞变红,但使酚酞变红的不一定是碱,如碳酸钠溶液。
2.不能使酚酞溶液变红的溶液不一定是酸溶液,也可能是中性溶液。
3.不能使酚酞溶液变红的溶液不一定是酸性溶液,也可能是中性溶液。
1.(2021·湖南株洲市·中考真题)下表列出了一些物质在常温下的近似pH。下列有关说法正确的是( )
A.所有的食物均呈酸性
B.pH<7的雨水称为酸雨
C.向肥皂水中滴加酚酞,溶液呈红色
D.清理厨房顽固油渍时,将厕所清洁剂与炉具清洁剂混合使用,效果更佳
【答案】C
【详解】
A、pH小于7呈酸性,大于7呈碱性,故鸡蛋清呈碱性,A错误。
B、pH<5.6的雨水称为酸雨,B错误。
C、肥皂水pH大于7,呈碱性,向肥皂水中滴加酚酞,溶液呈红色,C正确。
D、厕所清洁剂pH小于7呈酸性,炉具清洁剂pH大于7呈碱性,将厕所清洁剂与炉具清洁剂混合使用,会发生反应,效果降低,D错误。故选:C。
2.(2022年江苏省连云港市中考)下列是人体几种体液的正常pH范围,其中呈酸性的是( )
A.胰液7.5~8.0B.胆汁7.1 ~7.3
C.血浆7.35~7.45D.胃液0.9 ~1.5
【答案】D
【详解】酸性溶液pH<7,碱性溶液pH>7,中性溶液pH=7,胰液和胆汁以及血浆的pH>7显碱性,胃液pH<7显酸性,故选D。
3.(2022年四川省成都市中考)部分水果及饮料的pH如下:
下列说法正确的是( )
A.西瓜汁显碱性B.橘子汁中滴入酚酞,溶液变红
C.苏打水显酸性D.胃酸过多的人应该少饮柠檬水
【答案】D
【解析】
A、西瓜汁的pH小于7,显酸性,A错误;
B、橘子汁pH小于7,显酸性,滴入酚酞,溶液不变红,B错误;
C、苏打水pH大于7,显碱性,C错误;
D、柠檬水pH小于7,显酸性,胃酸的主要成分是盐酸,盐酸显酸性,故胃酸过多的人应该少饮柠檬水,D正确。
故选D。
4.下列各组物质的反应,需要加入酸碱指示剂才能判断反应发生的是( )
A.Fe和CuSO4溶液 B.Ba(OH)2溶液和稀H2SO4
C.澄清石灰水和CO2 D.Ca(OH)2溶液和稀盐酸
【答案】D
【解析】A.铁表面有红色固体生成,溶液由蓝色变为浅绿色,就可知道反应发生,不符合题意;
B.溶液有白色沉淀产生就可知道反应发生,不符合题意;
C.溶液有白色沉淀产生就可知道反应发生,不符合题意;
D.Ca(OH)2溶液和稀盐酸都是无色溶液,生成的氯化钙溶液也是无色的液体,需要加入酸碱指示剂才能判断反应发生,符合题意。
5.(2022河北中考)向含有酚酞的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是( )
A. N点时的溶液一定呈红色
B. P点时的溶液能与纯碱发生反应
C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
【答案】B
【解析】A、N点时溶液的pH等于7,显中性,N点时的溶液一定呈无色,故选项说法错误。
B、P点时溶液的pH小于7,显酸性,溶质是硫酸和氯化钠,硫酸能与纯碱发生反应,故选项说法正确。
C、M→N过程中pH大于7,但pH逐渐减小,碱性逐渐变弱,故选项说法错误。
D、M→P过程中pH小于7,且pH逐渐减小,是因为完全反应后继续滴加稀硫酸,M→P过程中硫酸钠的质量不变,故选项说法错误。
故选:B。
考点3:中和反应的实验探究
1. 探究过程
2. 实验分析
(1)反应的实质:酸溶液中的H+和碱溶液中的OH-结合生成了水(H++OH-══H2O)。
(2)酸、碱是否发生反应以及反应的程度的判断
① 借助酸碱指示剂(酚酞溶液)的颜色变化:向碱溶液中滴入最后一滴酸,溶液由红色变无色,则反应完全;向酸溶液中滴入最后一滴碱,溶液由无色变红色,则反应完全
② 借助溶液的温度的变化:酸碱反应时会发生放热现象,温度会上升,当温度上升到最高时,表示反应完全(注意:若是酸溶液中直接加入氢氧化钠固体,温度上升,则不能判断两者一定发生反应,因为氢氧化钠固体溶于水会放热)
③ 借助溶液的pH变化:若溶液的pH=7时,表示反应完全
【例6】(2022年山东省泰安市中考)在学习了常见的酸和碱后,某化学兴趣小组的同学围绕“酸碱中和反应”,在老帅引导下开展实验探究活动,请你参与下列活动。
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。
(1)测定溶液pH变化的方法
甲同学在实验过程中测得pH变化如图1所示,则该同学是将_______(填字母序号)。
a.氢氧化钾溶液滴入稀硫酸中 b.稀硫酸滴入氢氧化钾溶液中
(2)测混合过程中的温度变化
乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是_______(填“放热”或“吸热”)反应。图2中B点表示的含义是_______。
(3)借助于酸碱指示剂
丙同学通过图3所示实验,他观察到溶液由红色变成无色,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为_______。
【提出问题】针对反应后溶液中溶质的成分,大家纷纷提出了猜想。
【猜想与假设】
猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
【实验结论】通过探究,同学们一致确定猜想二是正确的。
【评价与反思】
(4)丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是_______。
(5)同学们经过反思与讨论,最后认为方案一中的Fe2O3粉末可以用下列的某些物质代替,也能得到同样的实验结论,请你选出可用药品的字母序号_______。
A.Mg B.CuO C.KCl D.Na2CO3
(6)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑_______。
【答案】 a 放热KOH和H2SO4恰好完全反应 2KOH+H2SO4=K2SO4+2H2O 固体粉末减少(或消失) 溶液变成黄色 K2SO4与BaCl2反应也会产生白色沉淀,无法证明H2SO4一定存在 ABD 反应物是不过量(或反应物是否有剩余)
【详解】实验探究:
(1)由pH变化曲线可知,溶液刚开始pH<7,呈酸性,此时溶液应是H2SO4溶液,随着溶液的加入,溶液pH逐渐增大到7,最后大于7,所以应是将KOH溶液滴入H2SO4溶液中,故选a;
(2)由图2可知,随着反应的进行溶液温度升高,说明酸碱中和反应为放热反应,B点此时温度达到最高值,证明KOH溶液和H2SO4溶液恰好反应;
(3)氢氧化钾与硫酸反应生成硫酸钾和水,反应的化学方程式为2KOH+H2SO4=K2SO4+2H2O;
进行实验:
方案一:实验结论是猜想二正确,反应后溶液中含有硫酸,取少量反应后的溶液于试管中,加入Fe2O3粉末,氧化铁与硫酸反应生成硫酸铁和水,可观察到铁锈减少(或消失),溶液变成黄色,故填:固体粉末减少(或消失),溶液变成黄色;
评价与反思:
(4)方案二是不合理的;氯化钡与硫酸钾反应也会产生白色沉淀,只能证明有硫酸根离子,而不能证明有氢离子,故填:K2SO4与BaCl2反应也会产生白色沉淀,无法证明H2SO4一定存在;
(5)A.Mg和稀硫酸反应生成气体,可以证明硫酸过量;
B.CuO和硫酸反应生成蓝色硫酸铜溶液,可以证明硫酸过量;
C.KCl和稀硫酸不反应,不可以证明硫酸过量;
D.Na2CO3和稀硫酸反应生成气体,可以证明硫酸过量;
故选ABD;
(6)分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还要考虑反应物是否过量或反应物是否有剩余,故填:反应物是否过量或反应物是否有剩余。
1. (2021·黑龙江绥化市)中和反应在日常生活和工农业生产中有广泛的应用。
(1)向盛有一定量稀盐酸的密闭隔热容器中,加入氢氧化钠固体,利用数字传感器测出反应时间与溶液温度变化的图象如图所示。
①甲同学得出结论:稀盐酸和氢氧化钠反应过程中放热。乙同学不同意他的观点,乙同学的理由是______。
②丙同学取少量反应后的溶液于试管中,加入无色酚酞溶液,无明显现象,于是三位同学对反应后溶液中溶质的成分作出猜想:
猜想一:NaCl 猜想二:NaCl和NaOH 猜想三:______
③同学们经过讨论后认为猜想______一定不正确。
④为了验证其余猜想,丙同学进行如下探究。
(2)丁同学在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀硫酸,边不断振荡试管,至溶液颜色______为止,说明氢氧化钠和稀硫酸恰好完全反应,该反应的化学方程式为______。
(3)结合上述实验,中和反应的实质是______。
【答案】(1)①氢氧化钠固体溶于水放热,也能使温度升高
②NaCl和HCl
③二
④有气泡产生
(2)恰好变成无色(或恰好由红色变成无色;“恰好”写为“刚好”、“正好”也可)
(3)氢离子和氢氧根离子结合成水分子(或酸中的氢离子和碱中的氢氧根离子结合成水分子或)
【解析】
(1)①甲同学得出结论:稀盐酸和氢氧化钠反应过程中放热。乙同学不同意他的观点,乙同学的理由是氢氧化钠固体溶于水放热,也能使温度升高,出现同样的温度曲线。
②盐酸和氢氧化钠生成氯化钠,如果盐酸过量,反应后溶液中会含有剩余的盐酸,结合猜想一、二,可知猜想三:HCl和NaCl。
③酚酞遇碱性溶液变红色,遇酸性、中性溶液不变色;加入无色酚酞溶液,无明显现象,说明不会存在氢氧化钠,故猜想二错误。
④活泼金属和酸反应生成氢气,实验结论为猜想三成立,说明溶液中存在稀盐酸,故:另取少量反应后的溶液于试管中,加入锌粒会有气泡产生。
(2)在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀硫酸,边不断振荡试管,至溶液颜色恰好由红色变成无色为止,说明氢氧化钠和稀硫酸恰好完全反应生成硫酸钠和水,该反应的化学方程式为。
(3)结合上述实验,中和反应的实质是氢离子和氢氧根离子结合成水分子(或酸中的氢离子和碱中的氢氧根离子结合成水分子或)。
指示剂
pH值
石蕊
酚酞
酸性
<7
变红色
无色
中性
=7
紫色
无色
碱性
﹥7
变蓝色
变红色
A
B
C
D
物质
厕所清洁剂
橘子
西瓜
鸡蛋清
肥皂
炉具清洁剂
pH
1~2
3~4
6-7
7-8
9-10
12~13
实验装置示意图
实验步骤
实验现象
实验结论
(1)向烧杯中加入10 mL氢氧化钠溶液,滴入几滴酚酞溶液溶液
溶液变红色
碱能使酚
酞变红色
(2)向上述烧杯中边滴加稀盐酸边搅拌,直至溶液恰好变无色为止
溶液红色逐渐
变浅直至消失
氢氧化钠与盐酸发
生了反应:NaOH+HCl═NaCl+H2O
(3)取上述溶液约3 mL放入蒸发皿中加热
液体蒸干后出
现白色固体
氢氧化钠与盐酸反应
生成了氯化钠
实验方案
实验操作
实验现象
实验结论
方案一
取少量反应后的溶液于试管中,加入Fe2O3粉末
_______
溶液中有H2SO4猜想二正确
方案二
取少量反应后的溶液于试管中,滴加BaCl2溶液
②产生白色沉淀
溶液中有H2SO4,猜想二正确
实验操作
实验现象
实验结论
另取少量反应后的溶液于试管中,加入锌粒
______
猜想三正确
备战中考化学考点总复习 专题17 气体的制取与净化【考点精讲】(全国通用)(原卷版+解析版): 这是一份备战中考化学考点总复习 专题17 气体的制取与净化【考点精讲】(全国通用)(原卷版+解析版),共30页。试卷主要包含了 气体的净化与干燥, 尾气的处理等内容,欢迎下载使用。
备战中考化学考点总复习 专题15 化学与生活【考点精讲】(全国通用)(原卷版+解析版): 这是一份备战中考化学考点总复习 专题15 化学与生活【考点精讲】(全国通用)(原卷版+解析版),共24页。试卷主要包含了化学与人体健康,化学与材料,化学与环境等内容,欢迎下载使用。
备战中考化学考点总复习 专题13 盐和化肥【考点精讲】(全国通用)(原卷版+解析版): 这是一份备战中考化学考点总复习 专题13 盐和化肥【考点精讲】(全国通用)(原卷版+解析版),共27页。试卷主要包含了粗盐提纯,盐的化学性质,化学肥料等内容,欢迎下载使用。












