




还剩18页未读,
继续阅读
所属成套资源:人教版化学选择性必修3PPT课件整套
成套系列资料,整套一键下载
新人教版高中化学选择性必修二第一章第二节第3课时《有机化合物中的化学键》课件
展开
这是一份新人教版高中化学选择性必修二第一章第二节《有机化合物中的化学键》课件,共26页。
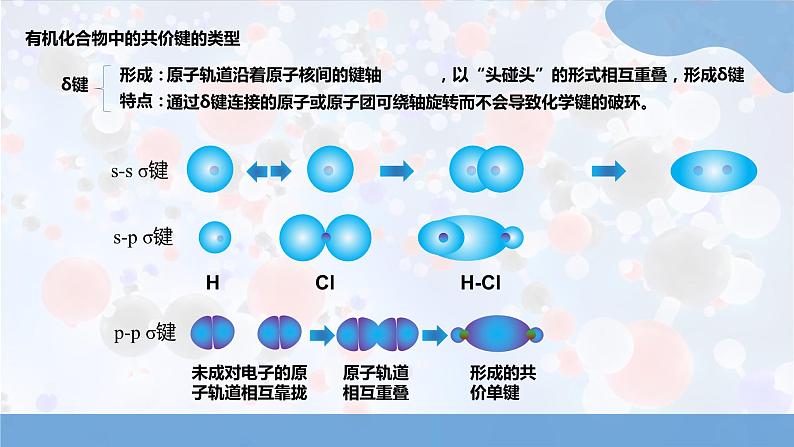
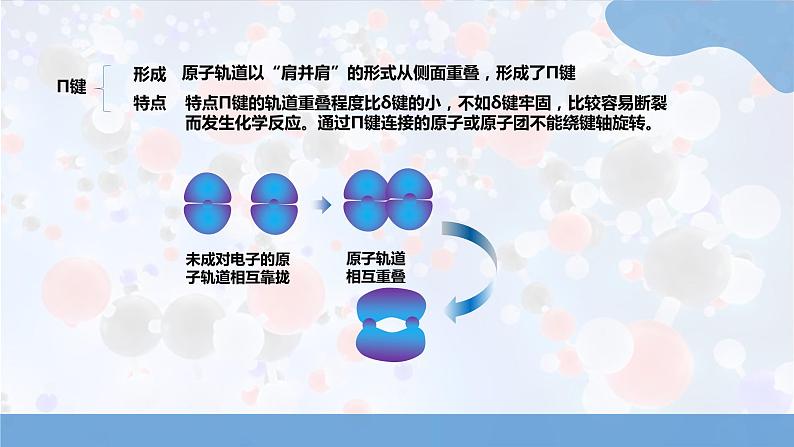
人教版高中化学选择性必修3有机物的结构特点与研究方法1.1.2有机化合物中的共价键及同分异构现象第一章3.初步学会同分异构体的书写学习目标1.进一步认识碳原子的结构特点2.掌握同分异构体现象的含义,会判断同分异构体有机化合物中的共价键有机化合物的碳原子: 通过共用电子对与其它原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大影响。HClH-Cl未成对电子的原子轨道相互靠拢原子轨道相互重叠形成的共价单键δ键s-s σ键s-p σ键p-p σ键原子轨道沿着原子核间的键轴 ,以“头碰头”的形式相互重叠,形成δ键形成:特点:通过δ键连接的原子或原子团可绕轴旋转而不会导致化学键的破环。有机化合物中的共价键的类型未成对电子的原子轨道相互靠拢原子轨道相互重叠Π键形成特点原子轨道以“肩并肩”的形式从侧面重叠,形成了Π键特点Π键的轨道重叠程度比δ键的小,不如δ键牢固,比较容易断裂而发生化学反应。通过Π键连接的原子或原子团不能绕键轴旋转。s-s 、s-p、p-pp-p“头碰头”重叠“肩并肩”重叠轴对称,可旋转镜面对称,不可旋转大小σ 键强度较大,较稳定1个σ键单键:CH2=CH2CH≡CH1个σ键、1个π键1个σ键、2个π键乙烯、乙炔中:含有π键,易断裂,发生加成反应;乙烷中:只含有σ键,较稳定只能发生取代反应。双键:三键:CH4一般情况下,有机化合物中的单键是σ键,双键中含有一个σ键和一个Π键,三键中含有一个σ键和两个Π键。以甲烷,乙烷,乙烯为例:习题演练在CH2=CH2+Br2 →CH2Br-CH2反应中,CH2=CH2分子中含有 个σ 键, 个Π键, 更易断裂。51Π键电负性与共价键极性的关系原子间电负性的差异越大——共用电子对偏移的程度越大——共价键极性越强,在反应中越容易发生断裂——官能团及其临近的化学键往往是发生化学反应的活性部位。小结归纳共价键的极性与有机反应(1)探究金属与水,乙醇反应钠钠乙醇 水现象:都有气泡产生,乙醇与钠的反应的剧烈程度小于水与钠的反应共价键的极性与有机反应“浮、游、熔、响”反应剧烈水中的O—H极性较强“沉、气、静”没有钠与水反应剧烈受乙基的影响,乙醇中的O—H极性比水中的O—H弱22羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强。有机反应的特点共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。共价键的极性与有机反应小结归纳习题演练某有机分子的架构简式为 该分子中有 个 键, 个Π键, 非极性键。根据共价键的类型可推测该物质可以发生 加成 反应和 取代反应8σ2有机化合物的同分异构现象不同点:无支链1个支链2个支链分子式相同相同点:CH3CH2CH2CH2CH3结构简式C(CH3 )4戊烷C5H12的3种同分异构体结构如图,完成下表:同分异构体:分子式相同,结构不同的现象1.同分异构体同分异构现象:具有同分异构现象的化合物。有机化合物中碳原子数目越多,其同分异构体的数目越多。同分异构现象分类:同分异构现象构造异构立体异构碳架异构官能团异构位置异构顺反异构对映异构碳链异构位置异构正戊烷 CH3CH2CH2CH2CH3异正戊烷 1-丁烯 CH2 = CH-CH2-CH32-丁烯 CH3CH = CH-CH31-氯丁烷 CH3CH2CH2CH2Cl2-丁烯 CH3CH = CH-CH3官能团异构乙醇 CH3-CH2-OH 甲醚 CH3-O-CH3CH2=CH-CH3官能团 或 取代基 在碳链中的位置不同立体异构顺反异构有机物的常见表示方法有机物常见表示方法表示原子的种类和数目(1)分子式如:乙烯C2H4,乙烷C2H6,乙醇C2H6O(2)最简式原子数目的最简整数比如:乙烯CH2,乙烷CH3,乙醇C2H6O(3)结构式一根短线代表1个共价键,将原子连接起来乙烯乙烷乙醇如:(3)结构简式省略单键“—”(C-H必定省)碳碳双键/碳碳三键不能省CH2 =CH2如:乙烯 CH3CH3乙醇CH3CH2OH乙烷(4)键线式 省去C、H元素符号,每个拐点和终点均表示连接一个碳原子。(官能团、官能团上的氢不能省)如:正戊烷异戊烷丙酸甲酯习题演练丙烯的键线式 。乙醇的键线式 。有机化合物键线式书写时注意事项(1)一般表示含有3个及以上碳原子的有机化合物。(2)只忽略碳氢键,其余的化学键不能忽略。(3)碳氢原子不标注,其余原子必须标注(含羟基,醛基和羧基中的氢原子。)(4)由键线式书写分子时不能忘记两端的碳原子。小结归纳本节课结束
人教版高中化学选择性必修3有机物的结构特点与研究方法1.1.2有机化合物中的共价键及同分异构现象第一章3.初步学会同分异构体的书写学习目标1.进一步认识碳原子的结构特点2.掌握同分异构体现象的含义,会判断同分异构体有机化合物中的共价键有机化合物的碳原子: 通过共用电子对与其它原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大影响。HClH-Cl未成对电子的原子轨道相互靠拢原子轨道相互重叠形成的共价单键δ键s-s σ键s-p σ键p-p σ键原子轨道沿着原子核间的键轴 ,以“头碰头”的形式相互重叠,形成δ键形成:特点:通过δ键连接的原子或原子团可绕轴旋转而不会导致化学键的破环。有机化合物中的共价键的类型未成对电子的原子轨道相互靠拢原子轨道相互重叠Π键形成特点原子轨道以“肩并肩”的形式从侧面重叠,形成了Π键特点Π键的轨道重叠程度比δ键的小,不如δ键牢固,比较容易断裂而发生化学反应。通过Π键连接的原子或原子团不能绕键轴旋转。s-s 、s-p、p-pp-p“头碰头”重叠“肩并肩”重叠轴对称,可旋转镜面对称,不可旋转大小σ 键强度较大,较稳定1个σ键单键:CH2=CH2CH≡CH1个σ键、1个π键1个σ键、2个π键乙烯、乙炔中:含有π键,易断裂,发生加成反应;乙烷中:只含有σ键,较稳定只能发生取代反应。双键:三键:CH4一般情况下,有机化合物中的单键是σ键,双键中含有一个σ键和一个Π键,三键中含有一个σ键和两个Π键。以甲烷,乙烷,乙烯为例:习题演练在CH2=CH2+Br2 →CH2Br-CH2反应中,CH2=CH2分子中含有 个σ 键, 个Π键, 更易断裂。51Π键电负性与共价键极性的关系原子间电负性的差异越大——共用电子对偏移的程度越大——共价键极性越强,在反应中越容易发生断裂——官能团及其临近的化学键往往是发生化学反应的活性部位。小结归纳共价键的极性与有机反应(1)探究金属与水,乙醇反应钠钠乙醇 水现象:都有气泡产生,乙醇与钠的反应的剧烈程度小于水与钠的反应共价键的极性与有机反应“浮、游、熔、响”反应剧烈水中的O—H极性较强“沉、气、静”没有钠与水反应剧烈受乙基的影响,乙醇中的O—H极性比水中的O—H弱22羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强。有机反应的特点共价键的断裂需要吸收能量,而且有机化合物分子中共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。共价键的极性与有机反应小结归纳习题演练某有机分子的架构简式为 该分子中有 个 键, 个Π键, 非极性键。根据共价键的类型可推测该物质可以发生 加成 反应和 取代反应8σ2有机化合物的同分异构现象不同点:无支链1个支链2个支链分子式相同相同点:CH3CH2CH2CH2CH3结构简式C(CH3 )4戊烷C5H12的3种同分异构体结构如图,完成下表:同分异构体:分子式相同,结构不同的现象1.同分异构体同分异构现象:具有同分异构现象的化合物。有机化合物中碳原子数目越多,其同分异构体的数目越多。同分异构现象分类:同分异构现象构造异构立体异构碳架异构官能团异构位置异构顺反异构对映异构碳链异构位置异构正戊烷 CH3CH2CH2CH2CH3异正戊烷 1-丁烯 CH2 = CH-CH2-CH32-丁烯 CH3CH = CH-CH31-氯丁烷 CH3CH2CH2CH2Cl2-丁烯 CH3CH = CH-CH3官能团异构乙醇 CH3-CH2-OH 甲醚 CH3-O-CH3CH2=CH-CH3官能团 或 取代基 在碳链中的位置不同立体异构顺反异构有机物的常见表示方法有机物常见表示方法表示原子的种类和数目(1)分子式如:乙烯C2H4,乙烷C2H6,乙醇C2H6O(2)最简式原子数目的最简整数比如:乙烯CH2,乙烷CH3,乙醇C2H6O(3)结构式一根短线代表1个共价键,将原子连接起来乙烯乙烷乙醇如:(3)结构简式省略单键“—”(C-H必定省)碳碳双键/碳碳三键不能省CH2 =CH2如:乙烯 CH3CH3乙醇CH3CH2OH乙烷(4)键线式 省去C、H元素符号,每个拐点和终点均表示连接一个碳原子。(官能团、官能团上的氢不能省)如:正戊烷异戊烷丙酸甲酯习题演练丙烯的键线式 。乙醇的键线式 。有机化合物键线式书写时注意事项(1)一般表示含有3个及以上碳原子的有机化合物。(2)只忽略碳氢键,其余的化学键不能忽略。(3)碳氢原子不标注,其余原子必须标注(含羟基,醛基和羧基中的氢原子。)(4)由键线式书写分子时不能忘记两端的碳原子。小结归纳本节课结束
相关资料
更多










