

2023-2024学年上海市青浦区高三上学期12月期终学业质量调研化学试卷含答案
展开(时间60分钟,满分100分)
考生注意:
1.本考试设试卷和答题纸两部分,所有答题必须涂或写在答题纸上;做在试卷上一律不得分。
2.答题前,考生务必在答题纸上将学校、姓名及考生号填写清楚,并在规定的区域填涂相关信息。答题时客观题用2B铅笔涂写,主观题用黑色水笔填写。
3.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
可能用到的相对原子质量: Li-7 O-16 P-31 Fe-56
一、传统能源
煤、石油等传统化石能源在燃料领域具有重要的作用。煤炭直接燃烧会产生废气,其中主要的物质包括SO2、NOx、CO2等。
1.(单选)下列说法正确的是( )
A.pH<7的降水通常称为酸雨
B.NO2、SO2、CO2都是无色气体
C.氮氧化物(NOx)会造成光化学烟雾
D.NO2、SO2、CO2的水溶液均导电,所以NO2、SO2、CO2都是电解质
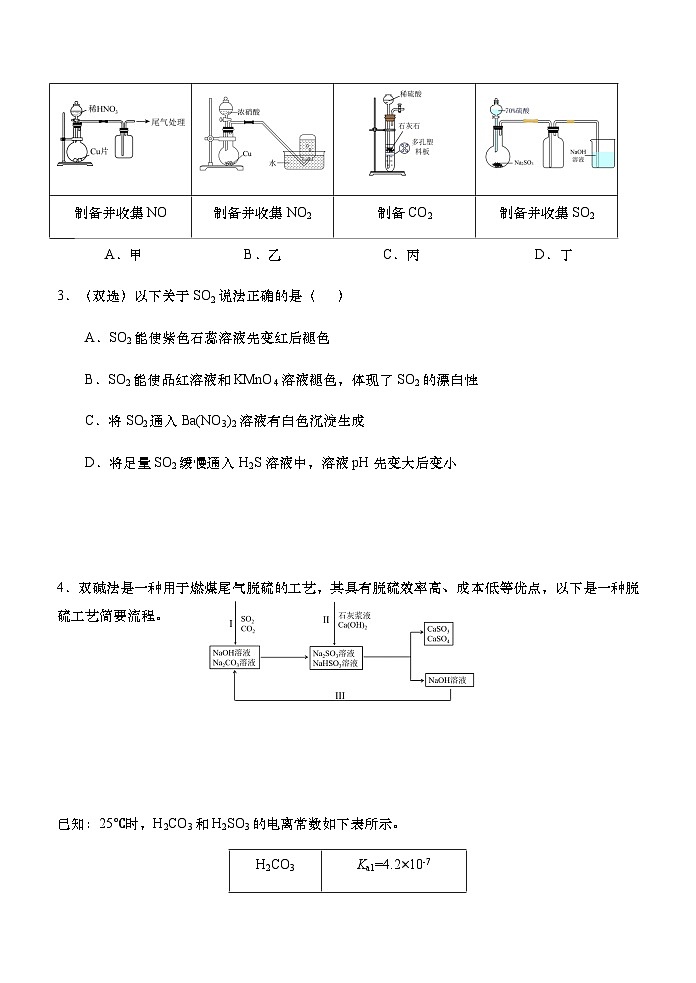
2.(单选)下列制备、收集及尾气处理装置(部分夹持装置略去),能达到实验目的是( )
A.甲 B.乙 C.丙 D.丁
3.(双选)以下关于SO2说法正确的是( )
A.SO2能使紫色石蕊溶液先变红后褪色
B.SO2能使品红溶液和KMnO4溶液褪色,体现了SO2的漂白性
C.将SO2通入Ba(NO3)2溶液有白色沉淀生成
D.将足量SO2缓慢通入H2S溶液中,溶液pH先变大后变小
4.双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。
已知:25℃时,H2CO3和H2SO3的电离常数如下表所示。
(1)等浓度的Na2CO3和Na2SO3溶液,pH(Na2CO3)_______pH(Na2SO3)(填“>”、“<”或“=”),请依据电离平衡常数分析原因: 。
(2)过程I中,NaOH溶液吸收SO2时,随着SO2的通入,会得到不同溶质组成的溶液。25℃时,H2SO3、HSO3-、SO32-的物质的量分数[]与pH的关系如右图所示。
①曲线II代表的微粒是 。
②(单选)等浓度Na2SO3和NaHSO3的混合溶液中,下列关系正确的是( )
A.c(Na+)> c(SO32-)> c(HSO3-)> c(OH-)>c(H+)
B.2c(Na+)=3[c(SO32-)+c(HSO3-)+c(H2SO3)]
C.c(OH-)= c(HSO3-)+c(H2SO3)+ c(H+)
D.c(Na+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)生成的CaSO3沉淀会被空气中氧气氧化,写出CaSO3被氧化过程的化学方程式为:_________________________________。
(4)工业上也可以用氨水吸收尾气中的SO2。氨水吸收SO2后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
铵盐溶液中n[(NH4)2SO3]: n[NH4HSO3]= 。
二、现代生物质能
生物质能是人类使用的最古老的能源。现代生物质能是将农林生物质资源、人畜粪便、生产生活污水、城市固体废弃物等通过不同形式转换为清洁燃料。发展现代生物质能在应对碳减排、气候变化和保护生态环境等方面发挥重要作用。生物质合成气是生物质热解气化后形成的包含CO、CO2、H2、CH4 等组分经重整后的可燃气体。
5.(单选)下列生物质合成气组成物质中含有非极性共价键的是( )
A.CO B.CO2 C.H2 D.CH4
6.(双选)已知CH4的燃烧热∆H1 = -891kJ·ml-1,CO的燃烧热为∆H2 = -283kJ·ml-1,下列正确的是( )
A.碳的燃烧热∆H小于∆H2
B.CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) ∆H1 = -891kJ·ml-1
C.2CO(g) + O2(g) = 2CO2(g) ∆H2 = -283kJ·ml-1
D.2CH4(g) + 3O2(g) = 2CO(g) + 4H2O(l) ∆H = -1216kJ·ml-1
生物质合成气可用于合成燃料甲醇。
已知CO(g) + 2H2(g) CH3OH(g) ∆H = -90.645 kJ·ml-1,
7.已知该反应的 ∆S = -221.381 J·ml-1·K-1,该反应的焓变和熵变随温度变化很小,可视为常数,则此反应自发进行的温度范围是 (保留至小数点后两位)。
8.某化学研究性学习小组用CO和H2模拟工业合成甲醇。
(1)(单选)学习小组考查了其他条件不变的情况下,温度和压强对反应的影响,实验结果如下图所示。下列说法正确的是( )
A.T2 > T1,P2 < P1
B.CO的平衡转化率T1 > T2,P1 < P2
C.化学反应速率vB > vA,vD < vC
D.化学平衡常数KA > KB ,KC > KD
(2)恒温条件下,在1L的恒容密闭容器内充入1ml CO和2ml H2,加入催化剂后开始反应CO(g) + 2H2(g) CH3OH(g),并用压力计监测容器内压强的变化如下:
①(双选)下列说法正确的是( )
A.当n(CO):n(H2):n(CH3OH) = 1:2:1时,反应达到平衡
B.容器内气体的平均相对分子质量不变,则反应达到平衡
C.在恒温恒容的平衡体系中充入Ar气,甲醇的产率升高
D.改变催化剂,反应物的平衡转化率不变
②从反应开始到20min时,CO的平均反应速率为 。
③其它条件不变,向容器中充入2ml CO和4ml H2,则CO的平衡转化率 (填“变大”“变小”或“不变”)
(3)为了研究CO和H2的最佳投料比,恒温下将l ml CO置于恒容密闭容器,改变H2的进料量进行实验,测得平衡时甲醇的体积分数变化如图所示。请判断a、b、c三点CO平衡转化率的大小顺序为 。
9.甲醇脱水可制备新型能源二甲醚2CH3OH(g) CH3OCH3(g)+H2O(g)。某温度下,向密闭容器中加入甲醇发生反应,t1 min时测得各组分的浓度为c(CH3OH) = 0.47ml·L-1, c(CH3OCH3) = 1.2ml·L-1,c(H2O) = 1.2ml·L-1。已知该温度下的平衡常数K = 400,则t1 min时v(正) v(逆)(填“>”、“<”或“=”),理由是: 。
三、锂离子电池
电池作为一种储能装置,广泛应用于人们的日常生活中,锂离子电池更是近些年来应用非常广泛的一种电池,当前市场上常用 LiNixCyMn1-x-yO2(简称NCM)或LiFePO4(简称LFP)做正极,用石墨做负极,石墨层中镶嵌有Li+和电子,其放电时的结构示意图如下所示。
10.锂元素在元素周期表中的位置是 ,基态氧原子的价电子轨道表示式为 。
11.NCM中的C元素形成的化合物有着丰富的颜色,常形成六配位化合物,一种化学式均为CBr(SO4)(NH3)5的化合物却有两种不同的颜色,用AgNO3溶液和BaCl2溶液探究其结构,结果如下表所示。
请写出呈红色配合物的化学式:
12.(单选)下列分子的中心原子采用sp2杂化的是( )
A.SO2 B.NH3 C.H2S D.CO2
13.(双选)已知LFP锂电池充、放电时总反应为:Li1-xFePO4 + LixC LiFePO4 + C(石墨) (Li元素化合价不发生变化),下列叙述正确的是( )
A.锂离子电池放电时,Li+从正极迁移到负极
B.锂离子电池放电时,正极电极方程式为 Li1-xFePO4 + xLi+ + x e— = LiFePO4
C.给锂离子电池充电时,石墨(C)做负极
D.给锂离子电池充电时,当外电路转移NA个电子,通过隔膜的Li+质量为7g
锂离子电池的电解质溶液中常用六氟磷酸锂(LiPF6)做溶质,早期曾用PCl5、HF、LiF反应来制备LiPF6,同时生成HCl。
14.(双选)下列描述正确的是( )
A.电负性:P > Cl > F B.第一电离能:I1(Li) < I1(B) < I1(Be)
C.沸点:HF < HCl < HBr < HI D.分子稳定性:HF > HCl > HBr > HI
锂离子电池电解液中常用有机试剂碳酸乙烯酯(EC)来溶解LiPF6,EC的结构如右下图所示:
15.EC酸性条件下水解产物为H2CO3和 (请用结构简式表示)
锂离子电池中还有一个重要内层组件—隔膜,既为Li+的传输提供通道,又隔开正、负极防止短路,当前比较成熟的隔膜主要是聚乙烯等聚烯烃类。
16.合成聚乙烯的单体分子是 (填“极性分子”或“非极性分子”),其中σ键和π键的数目之比为 。
四、制备磷酸亚铁锂
磷酸铁(FePO4)可用来制备锂离子电池的电极材料,工业上以硫铁矿(主要成分是FeS2,含少量Al2O3、 SiO2和Fe3O4)为原料,制备磷酸亚铁锂(LiFePO4),流程如下图所示:
17.“焙烧”前需将硫铁矿粉碎,目的是 。
18.滤渣1可来制造玻璃、光导纤维等材料,检验滤渣1洗涤干净的方法是 。
19.(单选)下列物质适合做“氧化”过程的氧化剂的是( )
A.过氧化氢 B.高锰酸钾 C.硝酸 D.次氯酸
20.在生成磷酸铁沉淀时,滴加氨水时pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是 。
21.工业制氨气的化学反应方程式为 。
高温
22.已知:Ksp(Fe(OH)2)=1.6×10-14。 Ksp(Al(OH)3)=1.3 × 10-33。若滤液1中含0.1 ml·L-1 Fe2+、0.001 ml·L-1 Al3+,为了使Al3+完全沉淀(即离子浓度≤1×10-5 ml·L-1)且Fe2+不沉淀,应控制pH的范围为 。
23.FePO4制备LiFePO4的化学方程式为:2FePO4+Li2CO3+H2C2O4 == 2LiFePO4+H2O↑+3CO2↑
用单线桥标出电子转移方向和数目。
24.可用0.100 ml·L-1的酸性K2Cr2O7溶液滴定Fe2+,测定产品LiFePO4的纯度。
离子反应方程式为:6Fe2+ + Cr2O72- + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O。
实验步骤:
①称量LiFePO4样品7.900 g,用稀硫酸溶解;
②将溶解后的溶液稀释为100 mL;
③量取25.00 mL 溶液,滴加2~3滴指示剂;
④用K2Cr2O7标准溶液滴定,3次重复实验平均消耗K2Cr2O7溶液20.00 mL。
请回答下列问题
(1)实验中需要的定量仪器除天平外,还有 。
(2)产品LiFePO4的纯度为 。
(3)(双选)若实验测得的产品纯度偏低,可能原因是( )
A.稀硫酸溶解样品时有少量液体溅出
B.稀释时溶液中部分Fe2+被空气中氧气氧化
C.滴定管装入K2Cr2O7标准前未润洗
D.滴定前,锥形瓶中有少量蒸馏水
五、合成燃料电池质子交换膜
氢能是一种清洁高效的新型能源,是目前能源科学研究的重点方向。氢燃料电池驱动的新能源汽车具有清洁环保、性能强劲、补能快速的优势,是理想的交通工具之一。质子交换膜是燃料电池的关键部件,也是目前的研究热点。
化合物G是一种新型质子交换膜的合成中间体,由化工原料A合成G的路线如下。
已知:I.
II.
回答下列问题:
25.(单选)原料A主要从煤焦油中提取,下列关于煤化工、石油化工的说法正确的是( )
A.通过煤的干馏可以得到煤焦油,该过程是物理变化
B.通过分馏煤焦油可以提取得到化合物A
C.根据溶解度不同,可以从石油中得到汽油、煤油等产品
D.石油裂化的目的是得到乙烯、丙烯等小分子
26.BC的化学方程式为_________________________________________________________。
27.化合物H()是D的同分异构体,写出检验H中含氧官能团的实验方法
_______________________________________________________________________________。
28.写出E的分子式_________________。
29.EF的反应类型为__________________,写出F中含氧的官能团名称________________。
30.(双选)关于上述合成过程中的有机物,下列说法正确的是( )
A.化合物A的一氯代物有5种
B.化合物E分子中所有碳原子可能共面
C.化合物F中含有碳碳双键
D.化合物G可以与NaOH溶液反应,1ml G最多消耗6 ml NaOH
31.写出一种满足下列条件的C的同分异构体的结构简式_________________。
①与FeCl3发生显色反应;②可以使Br2的CCl4溶液褪色;③核磁共振氢谱共有4个峰。
32.化合物J()也是合成某新型质子交换膜的中间体,请利用题目所给信息,由苯()及苯甲醛()为原料,合成化合物J。
(溶剂及无机试剂任选,合成路线常用的表示方式为:AB…目标产物)
参 考 答 案 2023.12
一、传统能源(共18分)
1.C(2分)
2.D(2分)
3.CD(3分)
4.(1) >(1分), H2CO3的Ka2小于H2SO3的Ka2,同温、同浓度下,CO32-的水解程度大于SO32-(2分)
(2)①HSO3- (2分) ②B (2分)
(3)2CaSO3+O2=2CaSO4(2分)
(4) 1:3(2分)
二、现代生物质能(共21分)
5.C (2分)
6.CD (3分)
7.T≤409.45K(写T<409.45K也给分) (2分)
8.(1)B (2分)
(2)①BD (3分) ②0.025ml·L-1·min-1 (2分) ③变大 (2分)
(3)c>b>a; (2分)
9.> (1分)
Qc=<400,可知t1时刻反应正向进行,所以v(正) > v(逆)。 (2分)
三、锂离子电池(共20分)
10.第二周期IA族( 2分); (2分)
11.[C(SO4)(NH3)5] Br (2分)
12.A (2分)
13.BD (3分)
14.BD (3分)
15.HOCH2CH2OH (2分)
16.非极性分子(2分);C (2分)
四、备磷酸亚铁锂(共21分)
17.增大硫铁矿与空气接触面积,燃烧更充分。(2分)
18.取最后一次洗涤液,滴加氯化钡溶液,无明显现象,说明洗涤干净。(2分)
19.A(2分)
20.磷酸铁沉淀中混有Fe(OH)3杂质(2分)
21.N2 + 3H2 2NH3(2分)
22.4.7
24.(1)100mL 容量瓶、滴定管(或移液管)(2分)
(2)96%(2分)
(3)AB(3分)
五、合成燃料电池质子交换膜(共20分)
25.B(2分)
26.
(3分)
27.取样,加入新制Cu(OH)2悬浊液,加热煮沸,若产生砖红色沉淀,则证明含有醛基。(2分)
28. C25H18O2 (2分)
29.取代反应 (1分) 羟基 (1分)
30.AD(3分)
31.
(任写一个,2分)
32.(4分)
甲
乙
丙
丁
制备并收集NO
制备并收集NO2
制备CO2
制备并收集SO2
H2CO3
Ka1=4.2×10-7
Ka2=4.8×10-11
H2SO3
Ka1=1.2×10-2
Ka2=6.2×10-8
反应时间/min
0
5
10
15
20
30
压强/MPa
25.2
21.6
19.0
17.4
16.8
16.8
CBr(SO4)(NH3)5(红色)
CBr(SO4)(NH3)5(紫色)
加入AgNO3溶液
淡黄色沉淀
无明显现象
加入BaCl2溶液
无明显现象
白色沉淀
上海市长宁区2023-2024学年高三上学期12月教学质量调研化学试卷含答案: 这是一份上海市长宁区2023-2024学年高三上学期12月教学质量调研化学试卷含答案,共8页。
37,上海市黄浦区2023-2024学年高三上学期期终调研 化学试题: 这是一份37,上海市黄浦区2023-2024学年高三上学期期终调研 化学试题,共8页。试卷主要包含了本考试分设试卷和答题纸,管道疏通剂可以疏通家庭厨卫管道等内容,欢迎下载使用。
36,上海市崇明区2023-2024学年高三上学期期末学业质量调研化学试题: 这是一份36,上海市崇明区2023-2024学年高三上学期期末学业质量调研化学试题,共10页。试卷主要包含了本考试设试卷和答题纸, Na2O, A等内容,欢迎下载使用。












