

山东省部分学校2023-2024学年高三上学期12月联考化学试卷含答案
展开本试卷满分100分,考试用时90分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H1 C12 O16 N14 F19 S32 Cl35.5 Ti48 C59
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学与生活密切相关。下列说法正确的是( )
A.高锰酸钾溶液、“84”消毒液、酒精均具有强氧化性,可用于杀菌消毒
B.纯碱溶液可去油污,是由于水解使溶液显碱性
C.石灰石可减少煤燃烧的排放,是由于石灰石可将转化为
D.用FeS作沉淀剂,可除去废水中的和
2.下列有关物质性质与用途具有对应关系的是( )
A.碳酸氢铵受热易分解,可用作氮肥
B.二氧化氯具有强氧化性,可用作有色物质的漂白剂
C.具有两性,用作阻燃剂
D.溶液显弱酸性,用作铜制线路板的刻蚀剂
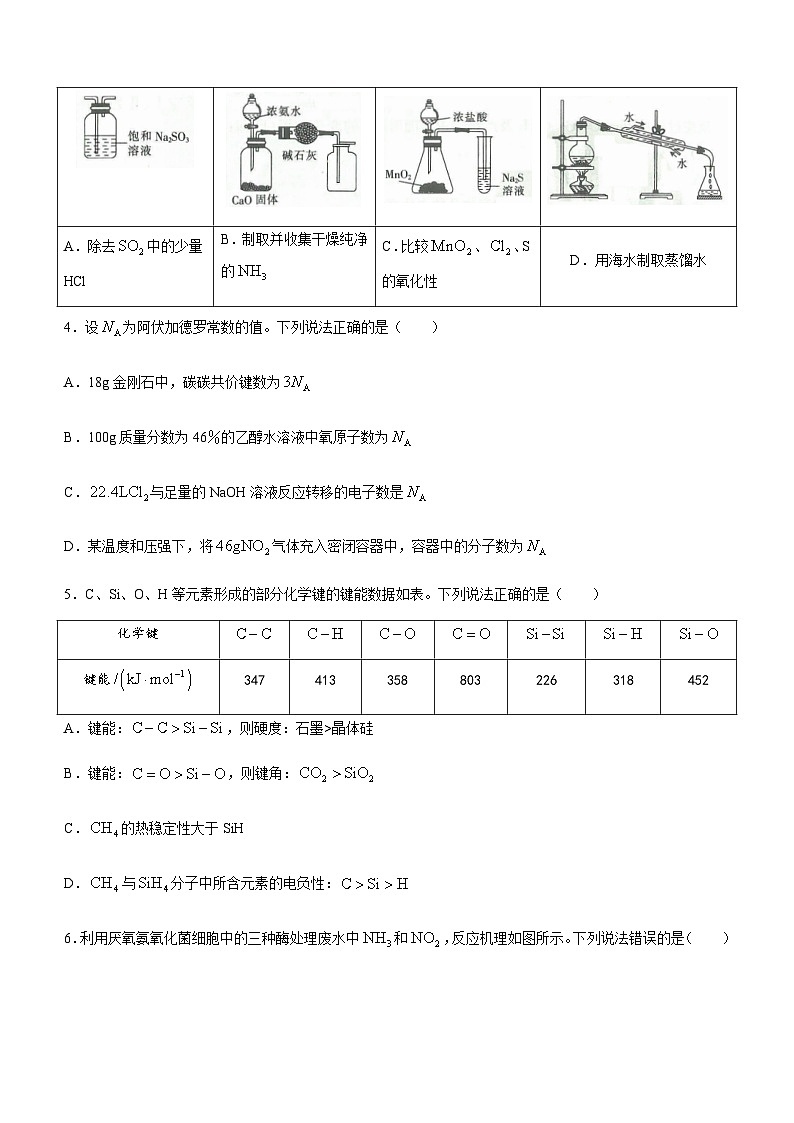
3.用下列仪器或装置进行相应实验,能达到实验目的的是( )
4.设为阿伏加德罗常数的值。下列说法正确的是( )
A.18g金刚石中,碳碳共价键数为
B.100g质量分数为46%的乙醇水溶液中氧原子数为
C.与足量的NaOH溶液反应转移的电子数是
D.某温度和压强下,将气体充入密闭容器中,容器中的分子数为
5.C、Si、O、H等元素形成的部分化学键的键能数据如表。下列说法正确的是( )
A.键能:,则硬度:石墨>晶体硅
B.键能:,则键角:
C.的热稳定性大于SiH
D.与分子中所含元素的电负性:
6.利用厌氧氨氧化菌细胞中的三种酶处理废水中和,反应机理如图所示。下列说法错误的是( )
A.中存在极性键和非极性键
B.高温条件下处理废水速率更高
C.反应一段时间后溶液酸性减弱
D.在HH酶作用下的反应方程式为
7.下列实验能达到目的的是( )
8.钙钛矿具有独特的晶体结构,广泛应用于传感器、固体电阻器等诸多领域。图1、2均为钙钛矿型化合物,其中图1中另两种离子为、,图2中另两种离子为和。
图1 图2
下列说法错误的是( )
A.钛酸钙的化学式为B.图2中,Y为
C.中含有配位键D.晶胞中与每个紧邻的有12个
阅读下列材料,完成第9~10题。
海洋是一个十分巨大的资源宝库,海水中含量最多的是H、O两种元素,还含有Na、Cl、Mg、Br、Ca、S等元素。海水资源的利用主要包括海水淡化、海水晒盐,从海水中制取镁、钾、溴等化工产品。海水淡化是解决淡水资源短缺的有效途径之一,其方法主要有蒸馏法、电渗析法和离子交换法等。海水晒盐余液又称苦卤,可从苦卤中提取镁、溴。
9.“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
下列有关说法错误的是( )
A.“氧化1”过程中主要反应的离子方程式为
B.“吹出”后剩余溶液中可能大量存在的离子有、、
C.从“氧化1”到“吸收”是为了富集溴
D.从“氧化2”所得溶液中分离出单质溴的方法是用酒精萃取分液
10.可用电渗析法淡化海水,处理废水的同时进行海水淡化的原理如图所示。下列说法正确的是( )
A.X极的电极反应式为
B.d口流出淡水
C.乙室中海水浓度变大
D.将海水淡化室的阴阳膜互换,则不能获得淡水
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.工业上用脱硫制备纯PbO的过程为:。已知:制备过程中杂质不溶于NaOH溶液,PbO溶解在NaOH溶液中,存在平衡:,溶解度曲线如图所示。下列说法正确的是( )
A.PbO溶解在NaOH溶液中吸收热量B.“碱浸1”操作应在100℃左右进行
C.使用35%NaOH溶液有利于PbO提纯D.T点溶液中再加入NaOH固体可使溶液到S点
12.盐酸羟胺()用途广泛,可利用如图装置来制备。以盐酸为离子导体,向两电极分别通入NO和。下列说法正确的是( )
A.Pt电极为原电池的正极
B.通过离子交换膜到右极室
C.一段时间后,含Fe的催化电极所在极室的pH增大
D.每生成1ml盐酸羟胺电路中转移
13.赖氨酸[,用HR表示]是人体必需氨基酸。常温下,赖氨酸与足量盐酸反应可得盐酸盐(),呈酸性,在水溶液中存在平衡:。下列叙述正确的是( )
A.的水溶液稀释10倍后,
B.的水溶液中水的电离程度减小
C.水溶液
D.NaR水溶液中的水解平衡常数与的关系为
14.一定条件下,1-苯基丙炔()可与HCl发生催化加成,反应如下:
反应过程中及产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅱ为放热反应),下列说法正确的是( )
A.反应Ⅲ的焓变:
B.平衡后再充入HCl,短时间内产物Ⅱ的占比变大
C.反应活化能:反应Ⅰ>反应Ⅱ
D.反应进行70min后,分离可获得高产率的产物Ⅱ
15.常温下,用溶液分别滴定和两种酸溶液,得到如图所示的曲线:。其中为酸的电离常数,Z为完全反应时理论上消耗NaOH溶液的体积。下列有关说法正确的是( )
A.
B.两溶液均恰好完全反应时,溶液中存在:
C.各滴入14.00mLNaOH溶液时,HX对应溶液,则HY对应溶液
D.当时,两溶液存在:
三、非选择题(共5小题,满分60分)
16.(12分)金属镁及其化合物除了在传统工业有广泛应用,还用在催化、光电等领域。回答下列问题:
(1)下列Mg原子电子排布表示的状态中,能量最高和最低的分别是__________(填标号)。
(2)Mg和在高温下制备Si,同时生成MgO。MgO的熔点高于的原因是__________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA可用于水的软化,软化水过程中形成的一种螯合物如图所示。1ml该配合物中通过螯合作用形成的配位键有__________ml,配合物中碳原子的杂化方式为__________,键角1__________(填“>”“<”或“=”)键角2。
(4)某光电材料含、、三种微粒,该化合物晶胞如图1所示,该晶胞沿y轴的投影如图2所示,已知该晶胞的晶胞参数分别为anm、bnm、cnm,。Y代表__________微粒(填微粒符号),若m点原子的分数坐标为,则p点原子的分数坐标为__________;晶胞中m、n之间的距离为__________。
图1 图2
17.(12分)硫酸锌是一种重要的无机化工原料,可用于生产防腐剂、立德粉、媒染剂等。一种利用菱锌矿(主要成分为,含及Ca、Mg、Fe、Al、Mn、Cu等元素的化合物)制备的工艺流程如下:
已知:①,;
②25℃时部分金属阳离子完全沉淀pH如下表:
回答下列问题:
(1)“焙烧”过程中,金属元素均转化为金属氧化物,能提高焙烧效率的措施有__________。
(2)滤渣1的主要成分为__________;得到黄铵铁矾[]的化学方程式为__________。
(3)试剂X最适宜的有__________(填化学式)。
(4)“氧化除杂”过程中发生反应的离子方程式为__________;“转化除杂”主要除去的杂质离子为__________(填离子符号)。
(5)若取1L“沉钙、镁”后溶液,测得、浓度均为,则至少需通入__________gHF气体才能使、沉淀完全。
18.(12分)是一种重要的有机化工原料,是一种金黄色液体,沸点为138℃。学习小组在实验室利用下述装置制备并测定其纯度(加热和夹持装置略)。
已知:①单质硫沸点为445℃;
②能被氧化为,(是一种暗红色液体)沸点为59℃;
③和均易水解,水解生成S、和HCl,水解生成S和两种强酸。
回答下列问题:
(1)组装仪器,装置合理的连接顺序是a→__________(按气流顺序填各接口编号)。仪器m的作用为__________。
(2)检查装置气密性后开始实验:①打开,通一段时间;②关闭,加热装置B,控制温度为140℃;③加热A处蒸馏烧瓶,当观察到F处U形管内出现大量金黄色液体,停止加热A;④打开,继续通一段时间。
加热装置B采用的加热方式为__________,当B处三颈烧瓶内充满黄绿色气体时,停止加热B,反应仍可以继续进行,可能的原因是__________,停止加热A后继续通一段时间的目的是__________。
(3)学习小组若长时间未观察到F处有金黄色液体生成,可以采取的措施为__________;最终所得粗产品需经过__________(填操作名称)进一步提纯。
(4)测定粗产品纯度:称量mg产品,加稀盐酸振荡保证反应充分,通水蒸气将和HCl全部蒸出后,配成100mL溶液,取25mL于锥形瓶中,用溶液滴定至终点,消耗VmLNaOH溶液。则样品中纯度的表达式为__________。
19.(12分)金属钌在电子制造、化学工业及催化剂生产等行业中有关键作用,六氯钌酸铵[]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到、,。中Ru元素的化合价为__________,生成的化学方程式为
(2)“氧化蒸馏”过程中蒸出、,生成的离子方程式为__________。
(3)“酸吸收”过程中加入乙醇的作用是__________。
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为,溶液中存在 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有__________。
(5)检验滤液中主要阴离子的实验方法是__________,“洗涤”时最合适的试剂为__________。
20.(12分)乙烯是重要的有机化工基础原料,在国民经济中占重要地位。工业上利用和反应脱氢制. 的相关反应如下:
反应Ⅰ:
反应Ⅱ:
(1)物质的标准摩尔生成焓是指由最稳定的单质合成标准压力下单位物质的量的物质的反应焓变,用符号表示。
TK、101kPa时,在恒压密闭容器中充入和发生反应,测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时测得放出的热量Q__________49.2kJ(填“>”“<”或“=”)。
(2)在923K和110kPa条件下,向体积固定的容器中充入. 与一定量发生反应Ⅰ和反应Ⅱ,平衡时、和CO的物质的量分数随起始投料比的变化关系如图所示。图中曲线p表示CO,则表示的曲线为__________(填“m”或“n”)。当时,平衡时体系中__________ml,反应Ⅰ的平衡常数__________kPa。
(3)在一定条件下,科学家研究一种乙烷催化氧化脱氢转化为乙烯的反应历程如图所示。
①图示历程包含__________个基元反应,写出速率最慢基元反应的化学方程式:__________。
②一定温度下,用C基催化剂研究催化脱氢,该催化剂对键和键的断裂均有高活性,易形成碳单质。研究发现,C基催化剂在短时间内会失活,其失活的可能原因是__________。
山东省部分学校2023-2024学年高三上学期12月联考
化学参考答案
1.D2.B3.D4.A
5.C6.B7.C8.B
9.D10.C11.AC12.C
13.B14.AD15.BD
16.(12分)
(1)c、b(1分)
(2)氧离子半径小于氯离子半径,所以MgO的离子键强,晶格能大,熔点较高(2分)
(3)6(1分)、(1分)>(1分)
(4)(2分) (2分) (2分)
17.(12分)
(1)将矿石粉碎(或其他合理答案),1分
(2)、(2分)
(2分)
(3)ZnO或(答案合理即可)(1分)
(4)(2分) (2分)
(5)1.4(2分)
18.(12分)
(1)defgbcjkhi(2分) 吸收多余的氯气,防止空气中的水蒸气进入U形管(2分)
(2)油浴加热(1分) S与的反应为放热反应,反应放出的热量使反应持续进行(1分) 将装置中残留的氯气完全排入装置E中,防止污染空气(1分)
(3)减缓或停止通入(2分) 蒸馏(1分)
(4)(2分)
19.(12分)
(1)+4(1分) (2分)
(2)(2分)
(3)做还原剂,还原、(2分)
(4)增大酸吸收时盐酸用量(浓度),(适当)升高温度进行沉降反应(2分)
(5)取适量滤液于试管中,滴加溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解,则证明滤液中存在(2分) 乙醇(1分)
20.(12分)
(1)<(2分)
(2)m(1分) 0.324(2分) 8.8(2分)
(3)①3(1分) (2分)
②积碳在其表面快速沉积使其活性降低(2分)
A.除去中的少量HCl
B.制取并收集干燥纯净的
C.比较、、S的氧化性
D.用海水制取蒸馏水
化学键
键能
347
413
358
803
226
318
452
实验目的
实验方法或操作
A
探究NaClO溶液酸碱性
用玻璃棒蘸取NaClO溶液点在pH试纸上
B
测定中和反应的反应热
酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
C
浓度对化学反应速率的影响
探究量取同体积不同浓度的溶液,分别加入少量等体积等浓度的溶液,对比现象
D
判断反应后是否沉淀完全
将溶液与溶液混合,反应后静置,向上层清液中再加1滴盐酸
10.1
4.7
8.2
物质
-393.3
0
-110.5
-241.8
江西省部分学校2023-2024学年高三上学期12月联考化学试题含答案: 这是一份江西省部分学校2023-2024学年高三上学期12月联考化学试题含答案,共16页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,离子方程式是化学用语之一,设为阿伏加德罗常数的值等内容,欢迎下载使用。
山东省部分学校2023-2024学年高三上学期12月联考化学试卷: 这是一份山东省部分学校2023-2024学年高三上学期12月联考化学试卷,共6页。
辽宁省部分学校2023-2024学年高三上学期12月联考 化学试卷及参考答案: 这是一份辽宁省部分学校2023-2024学年高三上学期12月联考 化学试卷及参考答案,文件包含辽宁省部分学校2023-2024学年高三上学期12月联考化学docx、辽宁省部分学校2023-2024学年高三上学期12月联考化学答案pdf等2份试卷配套教学资源,其中试卷共6页, 欢迎下载使用。












