
精品解析:湖南省长沙市雅礼集团2020-2021学年高二上学期期末考试化学试题(原卷版)
展开可能用到的相对原子质量:S-32 C-12 H-1
一、单选题(本大题共20小题,1-10题每题2分,11-20题每题3分)
1. 下列化学用语表示不正确的是
A. 乙酸的分子式:CH3COOHB. CH4分子的比例模型:
C. 苯的结构简式:D. 甲醛的结构式:
2. 下列物质的水溶液中只存在一种分子的是
A. KClB. Na2SC. CH3COOHD. NaHCO3
3. 下列说法正确的是( )
A. 煤是无机化合物,天然气和石油是有机化合物
B. 氢能属于可再生能源
C. 现实生活中,化学腐蚀现象比电化学腐蚀现象更严重
D. 铅蓄电池属于一次电池
4. 下列说法或表示法正确的是
A. 1mlS完全燃烧放热297.3kJ,其热化学方程式:S+O2=SO2,ΔH=-297.3kJ/ml
B. 氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
C. 需要加热的反应说明它是吸热反应
D. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/ml,若将含0.5mlH2SO4的浓硫酸与含1mlNaOH的溶液混合,放出的热量大于57.3kJ
5. 下列叙述不正确的是
A. 乙烷可以与氯气发生取代反应B. 聚乙烯可以用作生产食品包装材料的原料
C. 环己烷与溴苯可用水来签别D. 汽油和甘油属于同一类的有机物
6. 用惰性电极电解Na2CO3稀溶液一段时间,若保持温度不变,则下列说法错误是( )
A. 溶液的pH变大B. c(Na+)与的比值变小
C. 溶液浓度变大,可能有晶体析出D. 阳极产物与阴极产物的体积比为2∶1
7. 某学生用已知物质的量浓度的NaOH溶液来测定未知物质的量浓度的H2C2O4溶液,下列说法正确的是( )
A. 碱式滴定管旋塞处应抹上少许凡士林,可防止漏液
B. 将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C. 滴定时,通常用左手控制玻璃珠,使液体流速先快后慢,右手同一方向摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化
D. 可选择甲基橙作指示剂
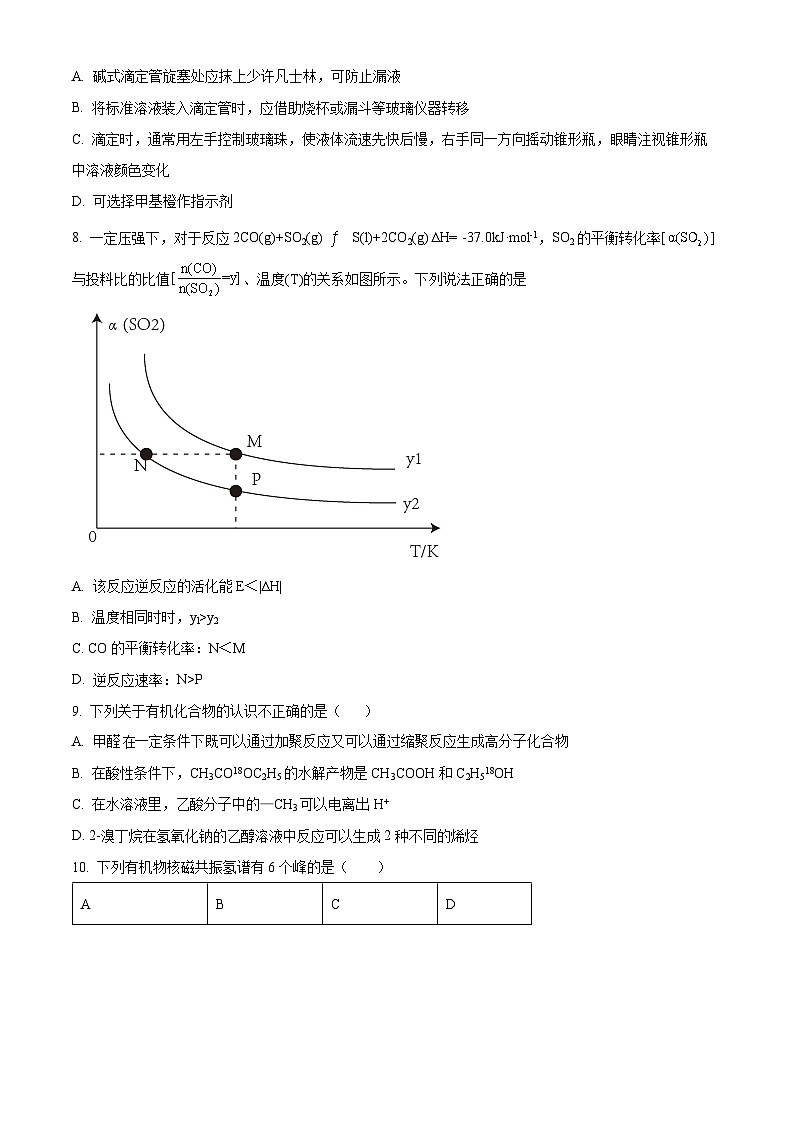
8. 一定压强下,对于反应2CO(g)+SO2(g) S(l)+2CO2(g) ∆H= -37.0kJ·ml-1,SO2的平衡转化率[]与投料比的比值、温度(T)的关系如图所示。下列说法正确的是
A. 该反应逆反应的活化能E<|∆H|
B. 温度相同时时,yl>y2
C. CO的平衡转化率:N<M
D. 逆反应速率:N>P
9. 下列关于有机化合物的认识不正确的是( )
A. 甲醛一定条件下既可以通过加聚反应又可以通过缩聚反应生成高分子化合物
B. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 2-溴丁烷在氢氧化钠的乙醇溶液中反应可以生成2种不同的烯烃
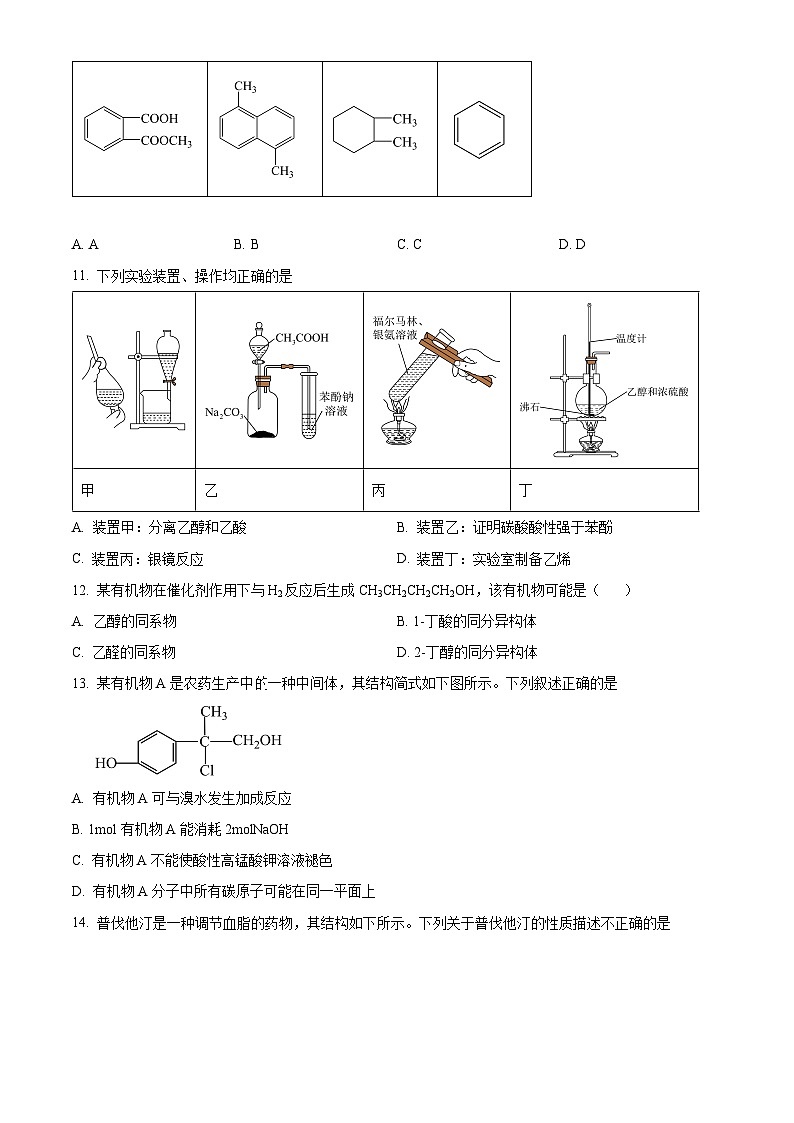
10. 下列有机物核磁共振氢谱有6个峰的是( )
A. AB. BC. CD. D
11. 下列实验装置、操作均正确的是
A. 装置甲:分离乙醇和乙酸B. 装置乙:证明碳酸酸性强于苯酚
C. 装置丙:银镜反应D. 装置丁:实验室制备乙烯
12. 某有机物在催化剂作用下与H2反应后生成CH3CH2CH2CH2OH,该有机物可能是( )
A. 乙醇的同系物B. 1-丁酸的同分异构体
C. 乙醛的同系物D. 2-丁醇的同分异构体
13. 某有机物A是农药生产中一种中间体,其结构简式如下图所示。下列叙述正确的是
A. 有机物A可与溴水发生加成反应
B. 1ml有机物A能消耗2mlNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
14. 普伐他汀是一种调节血脂的药物,其结构如下所示。下列关于普伐他汀的性质描述不正确的是
A. 该分子的分子式为C23H36O7
B. 不能与FeCl3溶液发生显色反应
C. 能发生加成、取代、消去反应
D. 1ml该物质最多可与3ml NaOH反应
15. 有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同。下列各项的事实不能说明上述观点的是
A. 苯与液溴在催化条件下才能反应,苯酚能与浓溴水反应
B. 分子中O-H键的易断裂程度:3>1>2
C. 2-丙醇能被催化氧化,2-甲基-2-丙醇不能被催化氧化
D. 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色
16. 乙苯在催化剂作用下在550~600℃时脱氢生成苯乙烯:
+H2
下列说法不正确的是( )
A. 该反应既是一个消去反应,也可以认为是一个还原反应
B. 恒压下在进料中掺入大量高温水蒸气有利于提高苯乙烯的产量
C. 乙苯可由苯和乙烯反应得到,且该反应原子利用率能达到100%
D. 等质量的苯乙烯与苯燃烧时耗氧量相同
17. 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1>t2)
下列说法正确的是
A. 反应在t1min内的平均速率为v(H2)=ml·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60ml CO和1.20 ml H2O,到达平衡时,n(CO2)=0.40 ml
C. 保持其他条件不变,向平衡体系中再通入0.20ml H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
18. T℃下的溶液中,c(H+)=10-x ml·L-1,c(OH—)=10-y ml·L-1,x与y的关系如图所示。下列说法不正确的是( )
A. T℃时,水的离子积Kw为1×10-a
B. 若a>14,则T<25
C. T℃时,若给pH=1的盐酸微热,则盐酸的pH减小
D. T℃时,pH=a-2的苛性钠溶液与pH=2的稀硫酸等体积混合,溶液的pH=0.5a
19. 我国最近在太阳能光电催化一化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
A. 该工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
20. 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
A. H2A为二元弱酸,稀释前c(H2A)=0.005ml·L-1
B. pH均为4的H2A和H2B两溶液等体积混合后,pH依然为4
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)=c(A2-)+c(B2-)+c(HB-)
D. pH=10的NaHB溶液中,离子浓度大小:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
二、非选择题(本题共4题,共50分)
21. (1)相对分子质量为54的烃的分子式为___________,其中所有碳原子在同一直线上的烃的结构简式是___________;
(2)用系统命名法给有机物命名:___________;
(3)有下列几种物质:①CH3COOH ②HC≡CH ③ ④CH3OH ⑤C6H5OH ⑥乙醛 ⑦环乙二酸乙二酯
Ⅰ.其中能使酸性高锰酸钾溶液褪色的有机物有___________;
Ⅱ.物质⑦与足量的NaOH溶液共热的化学方程式___________。
22. 以镍黄铁矿为原料制备Ni(OH)2的工艺流程如下:
已知:①高镍锍的主要成分为Ni、Fe、C、Cu的低价硫化物及合金:
②氧化性:Ni3+>C3+>H2O2>Fe3+;
③,,
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是___________;
(2)“过滤”时滤渣1的主要成分___________;
(3)结合化学用语解释“除铁”的原理是___________;
(4)“除钴”时,发生反应的离子方程式为___________;
(5)“沉镍”后需过滤、洗涤,过滤沉淀所需的玻璃仪器有烧杯、___________,若“沉镍”后的滤液中,则滤液的pH>___________;
(6)Ni(OH)2可用于制备镍氢电池。该电池是以金属氢化物为负极,氢氧化镍电极为正极,氢氧化钾溶液为电解液,电池反应为MH+NiOOH=M+Ni(OH)2,该电池的负极反应式为___________。
23. 某实验小组用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46g·cm-3。
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向B处锥形瓶中加入乙醇和浓H2SO4的混合液至浸没导管口。
③将A装置中的纯铁丝小心向下插入泥合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)A中导管的作用___________和导气。
(2)B装置中的主要化学方程式为___________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是___________。
(4)步骤④中不能用大火加热,理由是___________。
(5)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①D中小试管内CCl4作用___________;
②锥形瓶内装有水,反应后向锥形瓶内的水中滴加硝酸银溶液,若有___________产生,证明该反应属于取代反应。
24. 聚戊二酸丙二醇酯(PPG)是一种可降解聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃,化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④R1CHO+R2CH2CHO
⑤
回答下列问题:
(1)A的结构简式为___________,E和F生成G的反应类型为___________。
(2)由B生成C的化学方程式为___________。
(3)由D和H生成PPG的化学方程式为___________。
(4)D的同分异构体中能同时满足下列条件的共有___________种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是___________(写结构简式)
(5)以乙醇为起始原料,选用必要的无机试剂合成1-丁烯,写出合成路线(用结构简式表示有机物)用箭头表示转化关系,箭头上注明试剂和反应条件。___________A
B
C
D
甲
乙
丙
丁
反应时间/min
n(CO)/ml
n(H2O)/ ml
0
120
0.60
t1
0.80
t2
0.20
湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题(含解析): 这是一份湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题(含解析),共25页。试卷主要包含了5 Fe等内容,欢迎下载使用。
湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题: 这是一份湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题,共20页。
湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题(1): 这是一份湖南省长沙市雅礼教育集团2023-2024学年高二上学期期末考试化学试题(1),共8页。












