






- 1.2.1 电解质的电离(教学课件) 课件 0 次下载
- 1.2.2 离子反应(教学课件) 课件 0 次下载
- 1.3.1 氧化还原反应(教学课件) 课件 0 次下载
- 1.3.2 氧化剂与还原剂(教学课件) 课件 0 次下载
- 1.3.3 氧化还原反应方程式的配平与计算(教学课件) 课件 0 次下载
高中化学人教版 (2019)必修 第一册第二节 离子反应教学课件ppt
展开【分析反应】甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下:
请分析每位同学进行化学反应的实质离子?分析反应后体系中剩余离子种类?
1.根据离子反应发生的条件及题目限定条件,建立正确解答离子共存问题的思 维模型。2.知道除杂的原理及方法。3.掌握离子推断题的解析方法。
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”
判断多种离子能否大量共存于同一溶液中,归纳起来是一色、二性、三反应。
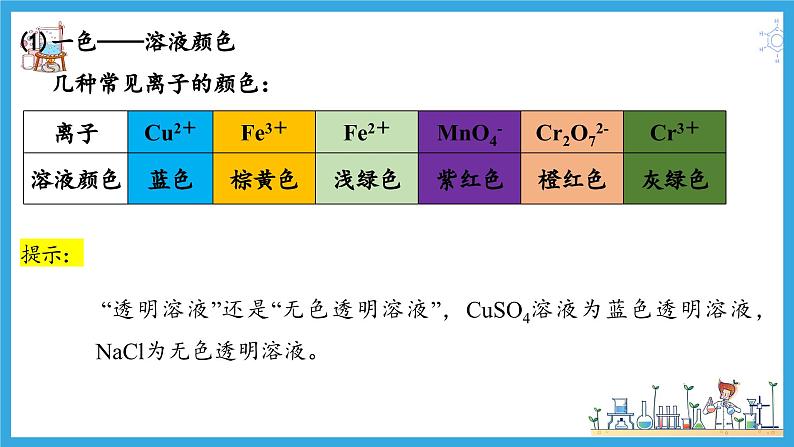
(1)一色——溶液颜色 几种常见离子的颜色:
“透明溶液”还是“无色透明溶液”,CuSO4溶液为蓝色透明溶液,NaCl为无色透明溶液。
(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸酸根离子(如CO32-、SO32-、S2-、CH3COO-等)不能大量存在。 ②在强碱性溶液中,H+及弱碱阳离子(如NH4+、Al3+、Fe3+等)不能大量存在
(3)反应——四种反应类型①复分解反应:如Ba2+与SO42-,NH4+与OH-,H+与CH3COO-等。
a、因生成难电离的物质或气体不能大量共存
b、因生成沉淀(或微溶性物质)不能大量共存
Fe2+、Pb2+、Cu2+、Ag+
Mg2+、Pb2+、Zn2+、Cu2+、Fe2+
Cu2+、Fe2+、Fe3+、Al3+
【例1】.在无色、碱性溶液中能大量共存的一组离子是( )
“三看法”判断溶液中离子能否大量共存(1)看题目要求 是“能大量共存”还是“不能大量共存”;是“一定能大量共存”还是“可能大量共存”。(2)看隐含条件①无色透明溶液: 不可能含有Cu2+、Fe3+、Fe2+、MnO4- 等有颜色的离子;也不可能含有相互反应而使溶液变浑浊的离子。
②酸性环境:“强酸性溶液”“使石蕊变红的溶液”“常温下pH<7的溶液”等,一定含有大量的H+。③碱性环境:“强碱性溶液”“使酚酞变红的溶液”“常温下pH>7的溶液”等,一定含有大量的OH-。(3)看是否反应①能否生成难溶物或微溶物。如Mg2+与OH-,Ca2+与CO32-、SO42-都不能大量共存。
②能否生成弱电解质。 如在酸性溶液中OH-不能大量存在,在碱性溶液中H+不能大量存在。③能否生成挥发性物质。如H+与 HCO3-、CO32-等不能大量共存。
离子反应在物质分离与提纯中的应用
鲁滨逊流落在荒岛上,他只能从池塘中取得一些泥水。
他能否从中提取洁净的饮用水?
[情境素材]粗盐通过简单的溶解、过滤和蒸发操作后得到的盐中仍然会有可溶性杂质CaCl2、MgCl2及一些硫酸盐等。利用化学方法可以将这些可溶性杂质进一步去除。
BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaCl
MgCl2 + 2NaOH = Mg(OH) 2 ↓+ 2NaCl
CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl
NaClNa2SO4MgCl2CaCl2
滤液:NaCl、MgCl2、CaCl2、BaCl2
滤液:NaCl、CaCl2、BaCl2、NaOH
滤液:NaCl、Na2CO3、NaOH
滤渣:CaCO3、BaCO3
CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaClBaCl2 + Na2CO3 = BaCO3 ↓+ 2NaCl
2HCl + Na2CO3 = H2O +CO2 ↑+ 2NaCl HCl + NaOH = NaCl + H2O
滤液:NaCl、Na2SO4、CaCl2、NaOH
滤渣:BaSO4、CaCO3
滤液:NaCl、Na2SO4、Na2CO3、NaOH
滤液:NaCl、BaCl2、NaOH
NaCl、HCl、BaCl2
1.物质提纯的一般思路
混合物组成分析→沉淀剂的选择→合理安排加入沉淀剂的顺序→考虑过量沉淀剂如何除去→确定实验步骤及实验操作。
2.溶液中可溶性杂质的除去原则
①不 增②不 减③易分离④易复原
应尽可能减少被分离与提纯的物质的损失
被提纯的物质容易被分离
指分离物或被提纯的物质容易复原
加入除杂试剂的顺序可以是:
1. Na2CO3必须加在BaCl2之后。
2. HCl在过滤后才加。
3. 采用加热的方法除去过量的盐酸。
【例2】(2022·广东,4)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和SO42- ,所用试剂包括BaCl2以及A.Na2CO3、NaOH、HClB.Na2CO3、HCl、KOHC.K2CO3、HNO3、NaOHD.Na2CO3、NaOH、HNO3
1.常见五种离子的检验方法
产生使湿润的红色石蕊试纸 的气体。
解析离子推断题的“四项原则”(1)肯定性原则: 据现象推断肯定存在或肯定不存在的离子。(2)互斥性原则: 如溶液中含有Ba2+,则不存在(3)进出性原则: 要注意所加试剂引入什么离子,是否造成干扰。(4)守恒原则(电中性原则): 阳离子和阴离子同时存在于溶液中且正、负电荷总量相等
【题后点拨】 电解质溶液呈电中性,即阳离子和阴离子同时存在于溶液中且正负电荷总量相等。在判断混合体系中某些离子存在与否时,有的离子并未通过实验验证,但可运用溶液中电荷守恒理论来判断其是否存在,如本题可以根据电荷守恒判断该溶液中一定含有K+。
1.(2022·西安一中高一期中)无色溶液中能大量共存的是( )
A.1∶1 B.2∶3 C.3∶4 D.5∶2
3.下列离子在指定溶液中能大量共存的是( )
4.某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是A.取少量滤液,向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不 含Ca2+B.取少量滤液,向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含 有Mg2+D.取少量滤液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀,说明矿石 中一定含有Cl-
5.有五瓶失去标签的溶液,它们分别为:
①Ba(NO3)2 ②KCl ③NaOH ④CuSO4 ⑤Na2SO4,如果不用其它任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是( )A. ①⑤③④② B.④③⑤②①C.④③①⑤②D.③④①⑤②
6 为了将混有Na2SO4、NaHCO3的NaCl提纯,并制得纯净的溶液,某学生设计了如图所示的实验方案:
高中化学人教版 (2019)必修 第一册第二节 离子反应教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教学ppt课件,共30页。PPT课件主要包含了素养要求,离子反应,离子方程式,课堂检测等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应教学ppt课件,共21页。PPT课件主要包含了学习目标,离子反应的条件,生成水弱电解质,生成沉淀,生成气体等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应公开课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应公开课课件ppt,文件包含人教版高中化学必修一123《离子反应》课件pptx、人教版高中化学必修一123《离子反应》同步练习解析版docx、人教版高中化学必修一123《离子反应》同步练习原卷版docx等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。













