





- 1.2.3 离子反应的应用(教学课件) 课件 0 次下载
- 1.3.1 氧化还原反应(教学课件) 课件 0 次下载
- 1.3.3 氧化还原反应方程式的配平与计算(教学课件) 课件 0 次下载
- 2 实验活动一 配制一定物质的量浓度的溶液(教学课件) 课件 0 次下载
- 2.1.1 活泼的金属单质—钠(教学课件) 课件 0 次下载
人教版 (2019)必修 第一册第三节 氧化还原反应教学ppt课件
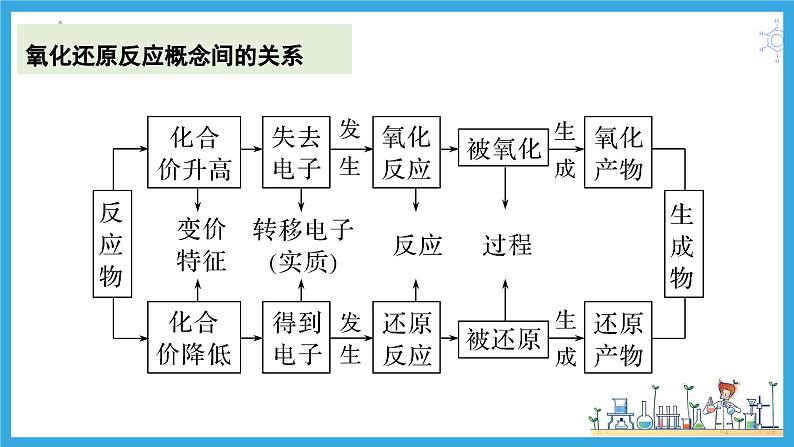
展开氧化还原反应概念间的关系
1.3 氧化还原反应第二课时 氧化剂与还原剂
1.知道常见的氧化剂和还原剂。能从构成物质的粒子等方面说明常见氧化剂和还原剂的主要性质,培养宏观辨识与微观探析的核心素养。2.认识元素在物质中可以具有不同价态,能从元素价态变化的视角说明物质的转化路径。
【情境再现】酒精、含氯消毒剂(如“84”消毒液)均可有效灭活病毒。“84”消毒液是一种高效消毒液(见下图)
【问题讨论】1.“84”消毒液的主要成分是NaClO,其中氯元素的化合价是多少?用“84”消毒液灭杀病毒,利用的是NaClO的什么性质?
提示 NaClO中氯元素的化合价是+1价,“84”消毒液能灭杀病毒是利用了NaClO的强氧化性。
1.氧化还原反应的相关概念
(1)氧化剂与还原剂氧化剂:化合价 (即 电子)的反应物还原剂:化合价 (即 电子)的反应物
氧化剂具有的性质 即物质得电子的性质,越容易得电子,氧化性越强
还原剂具有的性质即物质失电子的性质,越容易失电子,还原性越强
还原剂 氧化产物。
氧化剂 还原产物。
(3)氧化产物与还原产物氧化产物:还原产物:
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 == 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
失升氧化还原剂得降还原氧化剂
宏观判据:化合价的变化
(1)氧化剂与还原剂可能是同一个物质,也可能不同物质。(2)同一个反应中,氧化剂可能只有一个,也可能是多个。(3)氧化还原反应中氧化反应与还原反应同时存在
已知反应:5H2O2+2KMnO4+3H2SO4 = K2SO4+2MnSO4+5O2↑+8H2O,回答下列问题。(1)反应中H2O2→O2,氧元素的化合价由 到0价,因而H2O2 是 ,O2是 。(2)反应中KMnO4→MnSO4,Mn元素的化合价由 到+2价,因而KMnO4 是 ,MnSO4是 。
3.常见的氧化剂和还原剂
F2、O2、Cl2、Br2等
浓硫酸、HNO3、HClO等
KMnO4、KClO3、FeCl3等
Al、Zn、Fe、Na、Mg等
HCl、H2S、NH3等
KI、Na2S、FeCl2、Na2SO3等
4.氧化剂和还原剂的判断
a.变价元素的高价态化合物常作氧化剂,如KMnO4、FeCl3、HNO3等。
(1)从价态的变化判断氧化剂和还原剂
a.含有较低价态元素的化合物常作还原剂,如H2S、CO、SO2等。
(2)从物质的类别判断氧化剂和还原剂
①活泼性较强的非金属单质(如O2、Cl2等)和过氧化物(如H2O2、Na2O2等)通常作氧化剂。②活泼的金属单质(如Fe、Zn等)和某些非金属单质(如H2、C等)通常作还原剂。
(3)氧化还原反应中基本概念之间的关系
5.氧化性与还原性的强弱比较
(1)根据氧化还原反应方程式比较
(2)根据金属的活动性顺序判断
(3)一般地说,同种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。
例如: 判断氧化性强弱: Fe3+与Fe2+; KMnO4与MnO2 还原性强弱:S2-、S与SO3
(4)某一元素的最高价只有氧化性,没有还原性;最低价只有还原性,没有氧化性;中间价态既有氧化性又有还原性。
氧化性: Fe3+>Fe2+ KMnO4>MnO2 还原性: S2->S>SO3
(5)根据反应条件判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)发生反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
如,酸性KMnO4溶液与浓盐酸在常温下反应,MnO2与浓盐酸在加热条件下反应,均产生氯气,故氧化性:KMnO4>MnO2。
(6)根据氧化产物的价态高低判断
同一物质在相同条件下被不同氧化剂氧化,氧化的程度越大,氧化剂的氧化性越强
氧化性: Cl2>S
【点拨思路】氧化性和还原性比较的一般思路
6.生产、生活中的氧化还原反应
二氧化硫在葡萄洒中的作用
二氧化硫在葡萄酒中起到抑菌、抗氧化的作用,可以抑制微生物和酶的活性,防止葡萄酒变酸。二氧化硫在食品中还起到漂白剂、防腐剂、抗氧化剂和护色剂等。在葡萄酒中,二氧化硫是抗氧化剂,体现了二氧化硫的还原性。
什么是自由基?怎样抗氧化才有效?
氧化性和还原性及其强弱比较
1.下列古代技术的应用中,不涉及氧化还原反应的是A.古法炼铁B.化丹(Pb3O4)为铅C.煅烧贝壳D.火药爆炸
Pb元素化合价降低为0
N、C、S元素化合价改变
2.(2023·临沂十九中高一月考)下列物质间的转化,需要加入氧化剂才能实现的是( )
A.Fe2O3→Fe B.KClO3→KClC.H2SO4→SO2 D.NH3→NO
3.(2022·天津蓟州高一检测)下列对于NaH+H2O===H2↑+NaOH的说法正确的是A.该反应属于置换反应B.若该反应中有2个电子转移,则生成1个H2C.水是氧化剂D.H2只是氧化产物
4.已知下列反应:2Fe3++2I-= I2+2Fe2+, Br2+2Fe2+= 2Br-+2Fe3+, I2+SO32-+H2O = 2I-+SO42-+2H+下列反应说法正确的是( )
A.还原性强弱关系:I->Br->Fe2+>SO32-B.向FeI2溶液中滴加少量溴水,I-优先被氧化C.I2+2Br- = Br2+2I-可以顺利发生D.物质得电子越多,氧化性越强;失去电子越多,还原性越强
5.已知酸性条件下可发生反应:ClO3-+2M3++4H2O===M2O7n-+Cl-+8H+,下列说法错误的是( )
高中化学第三节 氧化还原反应课文配套课件ppt: 这是一份高中化学第三节 氧化还原反应课文配套课件ppt,共32页。PPT课件主要包含了双线桥法,标价态,连双线,注得失,不同元素,连单线,注数目,①氧化性和还原性,还原产物,氧化还原反应基本概念等内容,欢迎下载使用。
高中化学必修一 专题1.3.2 氧化剂、还原剂备课堂课件)) (共30张): 这是一份高中化学必修一 专题1.3.2 氧化剂、还原剂备课堂课件)) (共30张),共30页。
高中化学必修一 专题1.3.2 氧化剂、还原剂 (共30张): 这是一份高中化学必修一 专题1.3.2 氧化剂、还原剂 (共30张),共30页。













