





- 2.1.1 活泼的金属单质—钠(教学课件) 课件 0 次下载
- 2.1.2 钠的氧化物(教学课件) 课件 0 次下载
- 2.2.1 氯气的性质(教学课件) 课件 2 次下载
- 2.2.2 制备氯气+氯离子检验(教学课件) 课件 1 次下载
- 2.3.1 物质的量+摩尔质量(教学课件) 课件 1 次下载
人教版 (2019)必修 第一册第一节 钠及其化合物教学ppt课件
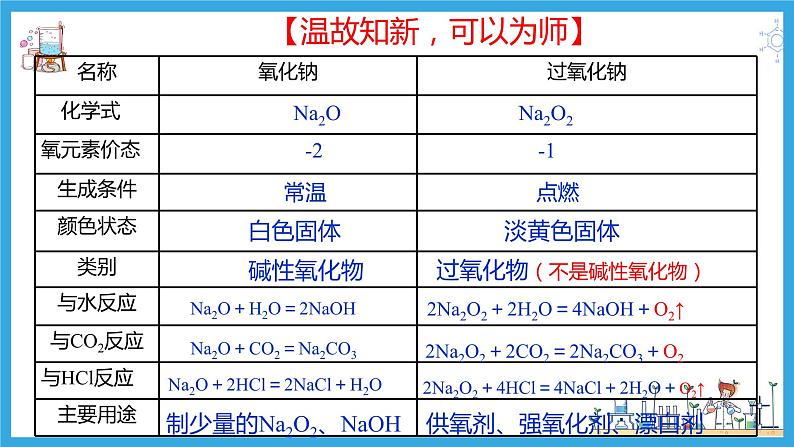
展开【温故知新,可以为师】
过氧化物(不是碱性氧化物)
-2 -1
常温 点燃
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
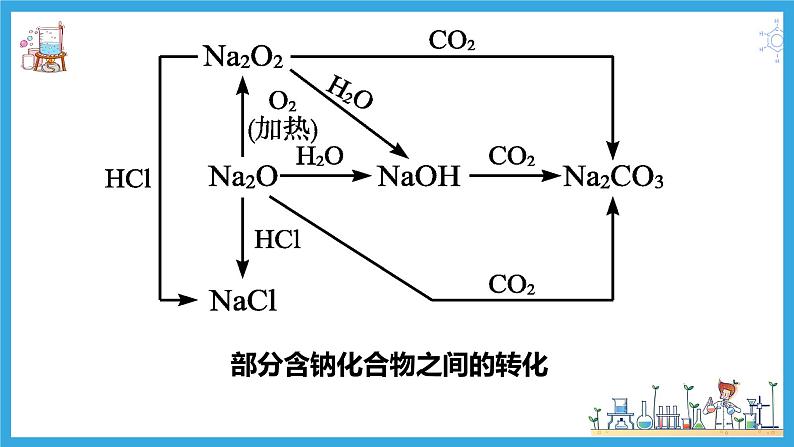
Na2O Na2O2
供氧剂、强氧化剂、漂白剂
制少量的Na2O2、NaOH
部分含钠化合物之间的转化
在烹制面包时常常用到小苏打,你知道小苏打的成分是什么吗?
大苏打(海波)
苏 打(纯碱)
1. 通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。2.了解焰色试验的操作和原理,并能作出解释。
在2支试管中分别加入少量Na2CO3和NaHCO3(各1 g),完成下列实验,并将实验现象和相应的结论填入表中。
Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
Na2CO3•10H2O
Na2CO3 >
碳酸钠粉末吸湿性很强,遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3•xH2O)。碳酸钠晶体在干燥空气中容易风化失去结晶水而变成碳酸钠粉末。
碳酸钠和碳酸氢钠都是盐,但溶液都呈碱性。日常的食用碱主要是十水碳酸钠,俗称洗涤碱;NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
2.碳酸钠、碳酸氢钠的化学性质
【实验2-5】(1)碳酸钠、碳酸氢钠的热稳定性
Na2CO3很稳定,受热不易发生分解
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
(2)探究Na2CO3和NaHCO3与稀盐酸的反应
NaHCO3+HCl=NaCl+ H2O + CO2 ↑
分步反应:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+ H2O + CO2↑
Na2CO3+2HCl=2NaCl+ H2O+CO2 ↑
思 考:向饱和Na2CO3溶液中通入过量的CO2,有何现象?为什么?
原因:Na2CO3 + CO2 + H2O = 2NaHCO3
溶解度: Na2CO3 > NaHCO3 、CaCO3 < Ca(HCO3)2
由于同温下,NaHCO3的溶解度比Na2CO3的溶解度小,所以有固体析出。
(3)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
①加入稀Na2CO3溶液,立即产生白色沉淀,离子方程式:__________ ;②加入少量稀NaHCO3溶液,无明显现象,说明稀CaCl2和少量稀NaHCO3溶液_______
Ca2++CO32-=CaCO3↓
两支试管中都产生____ 。离子方程式分别为__________________ 、________________________
HCO3-+Ca2++OH-=CaCO3↓+H2O
3.Na2CO3和NaHCO3 用途
侯氏(联合)制碱法生产原理流程:
【思考】碳酸钠与碳酸氢钠的鉴别
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
【思考】常用的除杂(提纯)方法
1.判断正误(1)碳酸氢钠可用于治疗胃酸过多(2) 在强酸性、强碱性溶液中均不能大量存在(3)Na2CO3、NaHCO3都能与NaOH溶液反应(4)Na2CO3俗称纯碱,所以Na2CO3属于碱(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液
【思考】Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
利用很多 或它们的 在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的 分析操作称为焰色试验。焰色试验是元素的 性质。
(1)检验 的存在。(2)利用焰色试验制节日烟花。
洗:将铂丝(或光洁的铁丝)用________洗净。烧:将洗净的铂丝在火焰上灼烧至与原火焰颜色相同。蘸:蘸取试样。烧:在无色火焰上灼烧,并观察火焰________。洗:再用________洗净铂丝,并在火焰上灼烧至________。
一些金属及化合物的焰色反应
4.几种金属元素的焰色
思 考: 1.在洗涤时能否把盐酸改为硝酸或硫酸?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
2.所有的金属元素都能发生颜色反应吗?
一 碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠 焰色试验
1. Na2CO3、NaHCO3性质探究
2. Na2CO3、NaHCO3的应用
3. 一些金属元素的焰色
3. 与钙盐、钡盐等反应
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 > NaHCO3
CO32- + 2H+=H2O+CO2↑
HCO3- + H+=H2O+CO2↑
反应速率:Na2CO3 < NaHCO3
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
NaOH、Ca(OH)2Ba(OH)2
区别Na2CO3和NaHCO3的方法:
加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
首先产生气体且反应较剧烈的是NaHCO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
【例1】对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是A.只要参加反应的Na2O2一定,反应生成的氧气就一定B.只要CO2和H2O(g)的总量一定,反应所消耗的Na2O2的量就一定C.只要气体的总数量一定,反应中所转移的电子的数量就一定D.只要混合气体的总数量一定,固体所增加的质量就一定
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是( )A.氯化钠 B.碳酸钠C.硫酸钠 D.碳酸氢钠
2.下列有关焰色试验的叙述正确的是( )A.可用铜丝代替铂丝进行试验B.观察钾的焰色试验要透过蓝色钴玻璃C.实验结束后,要用碳酸钠溶液洗净铂丝D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
3.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )A.反应③表明CO2具有酸性氧化物的性质B.反应④说明NaHCO3的稳定性强于Na2CO3C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给D.上述转化中发生的反应有分解反应、化合反应、置换反应等
4.某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验如图。请观察如图实验装置并分析实验原理,判断下列说法错误的是A.甲为Na2CO3,乙为NaHCO3B.甲为NaHCO3,乙为Na2CO3C.要证明物质受热能产生水,可在两支试管 内塞入沾有无水硫酸铜粉末的棉花球D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt,共23页。PPT课件主要包含了夯基提能·一遍过,浅红色,制玻璃,焙制糕点,答案B,答案D,小苏打,焰色试验等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学课件ppt,文件包含第1课时初步认识比热容pptx、加热水和煤油mp4、比较水沙石的比热容mp4、比较金属的比热熔冰mp4、水和煤油的吸热能力对比mp4、水和煤油的吸热能力对比swf等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
第10讲 碳酸钠和碳酸氢钠 焰色试验-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第10讲 碳酸钠和碳酸氢钠 焰色试验-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共40页。PPT课件主要包含了复习目标,碳酸钠和碳酸氢钠,考点一,必备知识,易错辨析,专项突破,碱金属焰色试验,考点二,真题演练等内容,欢迎下载使用。












