






- 4.1.3 原子结构与元素性质(教学课件) 课件 0 次下载
- 4.2.1 元素性质的周期性变化规律(教学课件) 课件 0 次下载
- 4.2.2 元素周期表和元素周期律的应用(教学课件) 课件 0 次下载
- 4.3.2 共价键(教学课件) 课件 0 次下载
- 4.3.3 化学键+分子间作用力(教学课件) 课件 0 次下载
高中化学人教版 (2019)必修 第一册第三节 化学键教学ppt课件
展开1.认识构成物质的微粒之间存在相互作用,了解离子键的概念。2.掌握原子、阴阳离子及离子化合物电子式的书写方法,并会用电子式表示离子化合物的形成过程。3.理解离子化合物的概念,并能识别简单的离子化合物。
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过一亿种。那么,元素的原子之间是通过什么作用形成如此丰富多彩的物质的呢?
资料卡: 1916年德国科学家柯赛尔考察了大量事实后得出结论:任何的原子都要使最外层满足8电子稳定结构。金属元素的原子易失去电子形成稳定的8电子的阳离子,非金属元素的原子易获得电子而形成稳定的带负电的阴离子;形成的阴阳离子通过静电吸引结合成化合物。
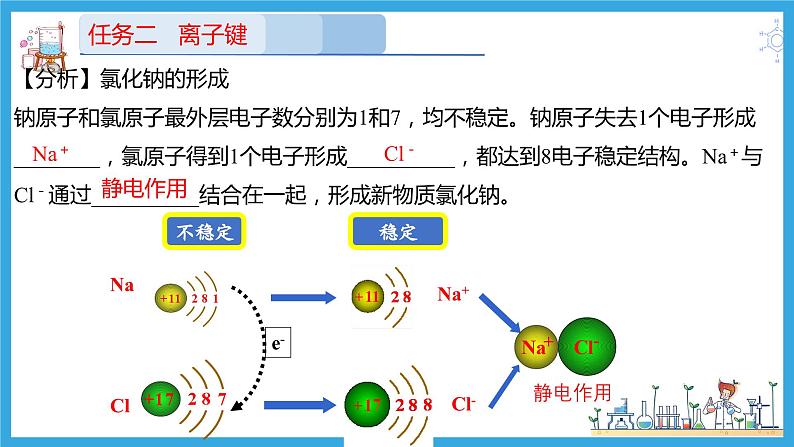
【知识回顾】氯化钠的形成过程
思考:如何从微观的角度来解析为什么金属钠和氯气能发生反应呢?(提示:从电子得失的角度分析)
剧烈燃烧,火焰为黄色,生成大量白烟
【分析】氯化钠的形成钠原子和氯原子最外层电子数分别为1和7,均不稳定。钠原子失去1个电子形成________,氯原子得到1个电子形成__________,都达到8电子稳定结构。Na+与Cl-通过__________结合在一起,形成新物质氯化钠。
带相反电荷的阴、阳离子间通过静电作用结合在一起的相互作用力
活泼金属(IA 、IIA)或NH4+与非金属(VIA 、VIIA等)
(包括静电引力和静电斥力)
(1)形成条件:一般,活泼金属原子失去电子后形成阳离子,活泼非金属原子得到电子后形成阴离子,它们均达到__________, 阴、阳离子通过静电作用形成离子键,两种离子以静电作用结合成化合物是离子化合物。
原子间发生电子得失,形成稳定结构,使体系能量降低
列举含有离子键的物质,并说明哪些微粒间存在离子键。
1. 下列说法正确的是( ) A.离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键 C.在化合物CaCl2中,两个氯离子之间也存在离子键 D.钠原子与氯原子结合成氯化钠后体系能量降低
2.(2022·北京昌平高一期末)下列物质中属于离子化合物的是( )A.Cl2 B.HCl C.NaCl D.N2
阴、阳离子通过离子键结合而形成的化合物或:含有离子键的化合物为离子化合物
2.常见的离子化合物:①强碱: 如NaOH、KOH、Ca(OH)2、Ba(OH)2等②大多数盐:如NaCl、K2SO4、NH4F等③活金属氧化物、过氧化物: 如Na2O、CaO、Na2O2等④活泼金属氢化物、碳化物、氮化物: 如NaH、CaC2、Na3N等
注:离子化合物中一定含有离子键
(1)含有离子键的化合物一定是离子化合物( )(2) 离子化合物中一定只含有离子键( ) (3) 含有金属元素的化合物一定是离子化合物( )(4) 离子化合物一定含有金属元素( )(5) IA族元素与VIIA族元素形成的化合物一定是离子化合物( )(6)离子化合中一定含有阴离子和阳离子,所以离子化合物一定能导电( )
①离子化合物中离子键一般比较牢固,破坏它需要很高的能量,所以离子化合物的熔点一般较高,常温下为固体。
②离子化合物在溶于水或受热熔化时,离子键被破坏,形成自由移动的阴、阳离子,能够导电。
4、离子化合物的判断方法
活泼金属氢/碳/氮化物
NH4 +、Na+、Mg2+等
Cl-、O2- 、H-、CO32- 、 OH-、O22-等
Cl、O 、N、F元素等
(2022·玉溪澄江一中高一期中)下列有关离子键和离子化合物的说法中正确的是( )
A.第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物B.在化合物CaF2中,两个氟离子之间也存在离子键C.NaCl固体能导电D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
离子键的三个“一定” 和两个“不一定”(1)三个“一定”①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
【思考】化学反应中一般是原子的最外层电子发生变化,所以化学反应中需要表示出最外层电子的变化,那么用什么来表示呢?
①将原子的最外层电子写在元素符号的上、下、左、右四个位置上。(2)先占位,后成对,尽可能对称。(3)同种原子不能同时用”·”和“×”
在元素周围用小黑点∙(或×)来表示原子的最外层电子,这种式子叫做电子式
例如:镁原子: ;碳原子: ; 氧原子: ;氖原子: 。
不但要画出最外层电子,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。
( 2 ) 离子的电子式:
① 简单阳离子的电子式
② 简单阴离子的电子式
一般用 表示
Na+、Li+、Mg2+、Al3+
氯离子: 硫离子:
简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示
(3)离子化合物的书写
由阴、阳离子的电子式组成,但对相同离子不能合并,同性电荷不直接相邻
[课堂练习] KF、CaO、CaCl2 、K2O、Na3N
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
3、用电子式表示离子化合物的形成过程
用电子式表示氯化钠的形成过程
①原子、离子都要标出最外层电子,离子需要标明电荷②阴离子要用括号括起来③相同的离子必须单个写、不能合起来写④不能把→改成“ = ”⑤用箭头标明电子转移的方向
【对应练习】用电子式表示下列离子化合物的形成过程:(1)BaCl2:_____________________________________;(2)NaF:________________________;(3)MgS:__________________________;(4)K2O:_____________________________。
活泼的非金属元素(ⅥA,ⅦA)
活泼的金属元素(ⅠA,ⅡA)
在元素符号周围用小黑点 · (或×)来表示粒子最外层电子的式子。
1.(2022·金华高一月考)下列各组原子序数所表示的两种元素,不能形成离子键的是( )A.6和8 B.8和11 C.12和9 D.11和17
2.下列物质中属于离子化合物的是( )
①MgF2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4A.只有②③⑤B.②③④⑤C.①②③⑤D.①③⑤⑥
3.(2022·成都高一期末)下列化合物的电子式书写正确的是( )A.B.C. D.
4.下列性质中,可以证明某化合物一定是离子化合物的是( )
A.可溶于水B.具有较高的熔点C.水溶液能导电D.熔融状态下能导电
5.(2023·长沙高一期中)下列微粒的电子式书写错误的是( )A.氯原子: B.氧离子:C.氟化钙: D.硫化钠:
6.(2022·郑州校级高一月考)下列用电子式表示物质的形成过程正确的是( )A. B. C. D.
高中化学人教版 (2019)必修 第一册第三节 化学键备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键备课课件ppt,文件包含431离子键答案docx、431离子键docx、431离子键教学课件高一化学同步备课系列人教版2019必修第一册pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学必修一 专题4.3.1 离子键: 这是一份高中化学必修一 专题4.3.1 离子键,共17页。
高中化学必修一 专题4.3.1 离子键备课堂课件)): 这是一份高中化学必修一 专题4.3.1 离子键备课堂课件)),共17页。













