

湖北省襄阳市宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题含答案
展开试卷满分:100分考试用时:75分钟
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并认真核准准考证号条形码上的以上信息,将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
可能用到的相对原子质量:H1C12N14O16
一、选择题:(本题共15小题,每小题3分,共45分。在每个小题给出的四个选项中,只有一项是符合题目要求的。)
1.2023年5月30日,神舟十六号发射的圆满成功使中国航天再一次刷新发展新高度。下列中国航天使用的“黑科技”中属于有机物的是
A.超高速飞行器的热防护材料超高温陶瓷
B.制作发动机喷管套筒的碳纤维
C.制作柔性薄膜电池的砷化镓
D.陀螺仪的浮液全氟异丙醚油
2.下列颜色变化没有涉及化学变化的是
A.Br2加入CCl4中呈橙红色B.SO2使品红溶液褪色
C.久置的浓硝酸呈黄色D.Cl2使有色鲜花褪色
3.下列离子方程式书写正确的是
A.NaHSO3的水解:
B.硫化钠溶液与少量的稀盐酸混合:
C.氯化铁溶液中加入铜粉:
D.NaOH溶液滴入NaHCO3溶液:
4.在下列溶液中,各组离子一定能够大量共存的是
A.常温下,pH=7的溶液:Na+、Cl-、SO42-、Fe3+
B.常温下,在pH=14的溶液中:NH4+、K+、NO3-、Cl-
C.常温下,由水电离的c(H+)=10-12ml/L的溶液:K+、Ba2+、Cl-、Br-
D.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
5.NA为阿伏加德罗常数的值。下列说法正确的是()
的AlCl3溶液中含有A13+的数目为0.1NA
B.常温下,1.0LpH=1的H2SO4溶液中含有H+的数目为0.2NA
C.标准状况下,22.4LSO3中含有SO3的分子数为NA
D.92gNO2与N2O4的混合气体中含有的原子总数为6NA
6.下列应用涉及的主要化学反应中生成物的总能量大于反应物的是
A.Fe2O3与A1在高温条件下的反应B.碳酸氢钠与盐酸反应
C.NH4NO3固体溶于水D.利用酒精炉加热冷水
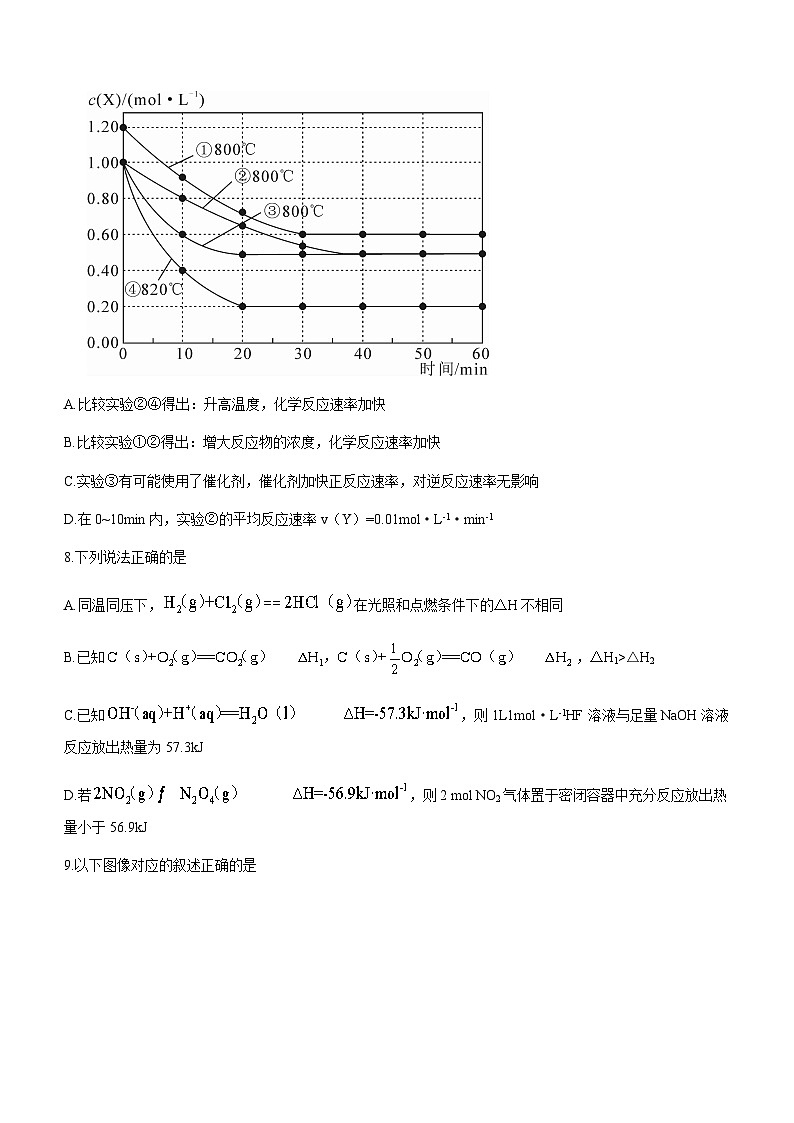
7.研究反应的速率影响因素,在不同条件下进行4组实验,Y,Z的起始浓度均为0,反应物X的浓度(ml·L-1)随反应时间(min)的变化情况如图所示。每组实验只改变一个条件,下列说法错误的是
A.比较实验②④得出:升高温度,化学反应速率加快
B.比较实验①②得出:增大反应物的浓度,化学反应速率加快
C.实验③有可能使用了催化剂,催化剂加快正反应速率,对逆反应速率无影响
D.在0~10min内,实验②的平均反应速率v(Y)=0.01ml·L-1·min-1
8.下列说法正确的是
A.同温同压下,在光照和点燃条件下的△H不相同
B.已知,△H1>△H2
C.已知,则1L1ml·L-1HF溶液与足量NaOH溶液反应放出热量为57.3kJ
D.若,则2 ml NO2气体置于密闭容器中充分反应放出热量小于56.9kJ
9.以下图像对应的叙述正确的是
A.图甲:该正向反应在任何温度下都能自发进行
B.图乙:t1时刻改变的条件只能是加入催化剂
C.图丙:对图中反应升高温度,该反应平衡常数减小
D.图丁:A的平衡转化率为50%
10.下列事实不能用勒夏特列原理解释的是()
A.实验室中常用排饱和食盐水的方法收集氯气
B.红棕色的NO2气体,加压后颜色先变深后变浅
C.合成氨工业中使用铁触媒作催化剂
D.CuCl2溶液加热后颜色由蓝绿色变为黄绿色
11.下列实验装置或操作能达到实验目的的是
12.下列实验能达到预期目的是
13.在一定温度下的密闭容器中发生反应:,平衡时测得A的浓度为0.5ml·L-1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.3ml·L-1。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y
A.Pt1电极附近发生的反应为:
B.该电池放电时电子从Pt1电极经过外电路流到Pt2电极
C.Pt2电极附近发生的反应为
D.相同条件下,放电过程中消耗的SO2和O2的体积比为2:1
15.下列溶液中有关物质的量浓度关系正确的是()
·L-1的NaHA溶液,其
·L-1 NaHCO3溶液与0.1ml·L-1NaOH溶液等体积混合,所得溶液中:
C.物质的量浓度相等CH 3COOH和CH3 COONa溶液等体积混合:
D.pH相等的CH3 COONa、NaOH和Na2CO3三种溶液:
二、非选择题:本题共4小题,共55分。
16.人体必需的一些元素在周期表中的分布情况如下:
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是____________。H2O2是一种绿色氧化剂,电子式为____________。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为____________。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是____________,原子序数为____________。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为____________。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是____________(填字母)。
A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性
B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性
C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性
D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性
17.氮、硫等非金属元素及其化合物在生产生活中应用广泛。请回答下列问题:
(1)键能是指在将1ml理想气体分子AB拆开为中性气态原子A和B所需的能量。
已知下列化学键的键能如下表:
写出1ml气态肼(H2N一NH2)在氧气中燃烧生成氮气和气态水的热化学方程式____________。
(2)已知反应过程的能量变化如图所示:
①图中E表示:____________。
②又知,请根据上图求出
反应的△H=___________kJ·ml-1。
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
可知水煤气变换的△H____________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=____________eV,写出该步骤的化学方程式____________。
18.研究反应机理以及化学平衡的原理,是揭示化学反应的规律和获得调控化学反应的理论依据。
I.一定条件下,在容积为5L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知达平衡后,降低温度,A的体积分数减小。
甲乙
(1)该反应的化学方程式为____________。
(2)在一定温度下的容积不变的密闭容器中发生该反应。下列叙述中,不能说明反应达到化学平衡状态的是____________。
A.A的消耗速率与C的生成速率比为1:2
B.容器内压强不再变化
C.混合气体平均摩尔质量不再改变
D.混合气体密度不再改变
(3)该反应的反应速率v随时间t的关系如图所示。
①根据图乙判断,在t3时刻改变的外界条件是____________。
②根据图乙判断a、b、c对应的平衡状态中,C的体积分数最大的是____________状态。
Ⅱ.在1L密闭容器中发生反应:,其化学平衡常数K与温度T的关系如下表:
回答下列问题:
(1)该反应的平衡常数表达式为K=___________;该反应的△H____________0(填“>”或“<”)。
(2)下列措施既可以提高反应速率,又可以提高H2的平衡转化率的是____________。
A.选择适当的催化剂B.增大压强
C.及时分离出H2O(g)D.升高温度
(3)830℃时,将2 ml CO2和2mlH2投入上述容器中开始反应,达到平衡时CO2的转化率为____________。
(4)800℃时,某时刻测得c(CO2)=0.5ml·L-1、c(H2)=1.5ml·L-1、c(CO)=0.5ml·L-1、c(H2O)=0.5ml·L-1,此时,v(正)____________v(逆)(填“>”“<”或“=”)。
19.水溶液中的平衡与生命活动、日常生活、工农业生产和环境保护等息息相关。
I.常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)常温下,浓度均为0.1ml/L的5种溶液:①CH3 COOH溶液;②NH3·H2O溶液;③CH3 COONH4溶液;④CH3 COONa溶液;⑤NH4Cl溶液。这些溶液中水的电离程度最大是____________(填序号)。
(2)Na2CO3溶液常用于油污的清洗的原因____________。(用离子方程式表示)
(3)若取等体积等pH的HCN和CH 3COOH两种溶液分别与足量金属锌反应,产生氢气的质量较多的是____________。
(4)向NaCN溶液通入少量CO2,离子方程式为____________。
Ⅱ.高锰酸钾是一种重要的化学试剂,利用高锰酸钾完成以下两个实验:
探究测定草酸晶体(H2C2O4·xH2O)中的x值。
第一步:称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液。
第二步:取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
第三步:用浓度为0.1000ml/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL。
(1)第三步中发生的离子方程式为____________。
(2)①滴定到达终点的判断标志是____________。
②下列操作可能造成测得x值偏小的是____________。
A.滴定终点读数时俯视
B.滴定前滴定管内有气泡,滴定后气泡消失
C.没有润洗锥形瓶
D.滴定过程中加入少量蒸馏水冲洗锥形瓶壁
③通过上述数据,求得x=____________。
宜城市六校2023-2024学年高二上学期期中考试
化学答案
一、选择题(共 15 题,每题 3 分)
一、非选择题(共 4 题,55 分)
16、(12 分)
(1)14C (1 分) (2 分)
(2) (2 分)
(3)第四周期 ⅥA 族 (2 分) 34 (1 分)
(4) (2 分) (5) BD (2 分)
17、(12 分)
(1)(1)(2 分)
(2)正反应的活化能(或者断裂 1ml SO2(g)和 1/2 mlO2(g)中的化学键所需总能量) (2分) -42.5 (2 分)
(3)小于 (2 分) 2.02 (2 分)
(或) (2 分)
18、(15 分)
Ⅰ:(1) (2 分) (2) AD (2 分)
(3) ① 升高温度 (1 分) ② a (1 分)
Ⅱ(1) (2 分) > (1 分) (2) D (2 分)
(3) 50% (2 分) (4) > (2 分)
19、(16 分)
I.(1) ③ (2 分) (2) (2 分) (3) HCN (2 分)
(4)(2 分)
Ⅱ.(1)(2 分)
(2)①最后半滴高锰酸钾溶液滴下,锥形瓶中溶液恰好由无色变成浅紫(红)色,且 30秒内不褪色 (2 分) ②B(2 分) ③2(2 分)
甲
乙
丙
丁
测定中和热
配制溶液时“摇匀”
测定化学反应速率
测定Fe2+的浓度
A
B
C
D
实验内容
实验目的
A
将0.2ml·L-1的KI溶液和0.05ml·L-1的FeCl3溶液等体积混合,充分反应后,取少许混合液向其中滴入AgNO3溶液
验证Fe3+与I-的反应有一定限度
B
将FeCl3固体溶于较浓的盐酸中,然后加水稀释
配制FeCl3溶液
C
将混合气体通入酸性高锰酸钾溶液中
除去乙烷中的乙烯
D
向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察并比较实验现象
探究浓度对反应速率的影响
化学键
N=N
O=O
N-N
N-H
O-H
键能/kJ·ml-1
946
497
193
391
463
T(℃)
650
700
800
830
1000
K
0.5
0.6
0.9
1.0
1.7
弱酸
CH2COOH
HCN
H2 CO3
NH3·H2O
电离常数(25℃)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项
D
A
B
C
D
B
C
D
D
C
B
B
A
C
C
辽宁省抚顺市六校2023-2024学年高二上学期期中考试化学试题含答案: 这是一份辽宁省抚顺市六校2023-2024学年高二上学期期中考试化学试题含答案,共11页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量,向两个锥形瓶中各加入0,化工原料异丁烯等内容,欢迎下载使用。
湖北省宜城市第一中学等六校2023-2024学年高一上学期期中考试化学试题含答案: 这是一份湖北省宜城市第一中学等六校2023-2024学年高一上学期期中考试化学试题含答案,共9页。试卷主要包含了下列叙述正确的是,下列离子方程式中不正确的是,已知某离子反应中涉及六种粒子等内容,欢迎下载使用。
湖北省武汉市东湖中学2023-2024学年高二上学期期中考试化学试题(含答案): 这是一份湖北省武汉市东湖中学2023-2024学年高二上学期期中考试化学试题(含答案),文件包含湖北省武汉市东湖中学2023-2024学年高二上学期期中考试化学试题docx、高二期中化学试卷评分细则docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。












