

湖北省仙桃市田家炳实验高级中学2023-2024学年高三上学期11月月考化学试题含答案
展开
这是一份湖北省仙桃市田家炳实验高级中学2023-2024学年高三上学期11月月考化学试题含答案,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
(总分:100分 考试时间:75分钟)
相对原子质量:H 1 C 12 O 16 Na 23 Ag 108 Zr 91
一、选择题:本题共15个小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.化学与生产、生活、科技密切相关,下列叙述正确的是( )
A.用盐酸除去铜器表面的铜绿是利用了HCl的还原性
B.维生素C和细铁粉均可作食品脱氧剂
C.纯碱常用于治疗胃酸过多和作食品膨化剂
D.碳化硅陶瓷基复合材料属于新型有机高分子材料
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
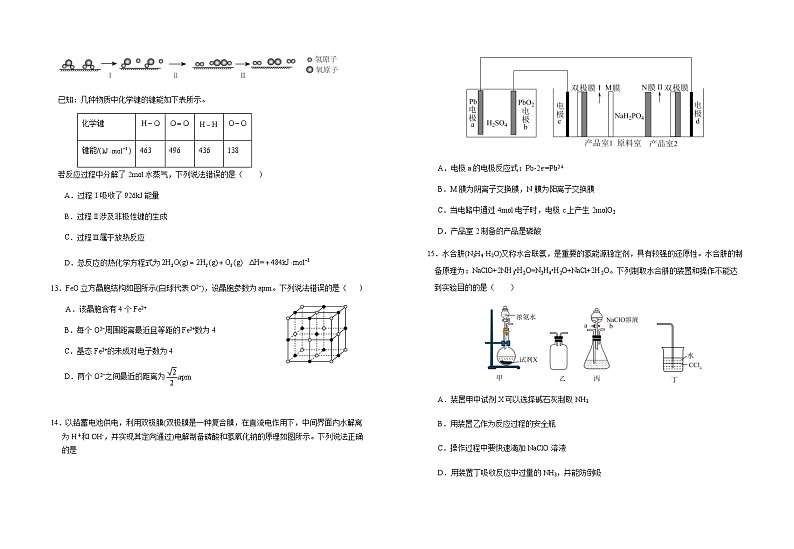
A. 7.8g Na2O2与二氧化碳充分反应,转移电子的数目为0.2NA
B.标准状况下,11.2 L SO3含有1.5 NA个氧原子
C.28g C2H4分子含有的σ键数目为4NA
D.1.8g 18O中含有的中子数为NA
3.下列实验装置图能达到相应实验目的且描述正确的是( )
A.图甲是中和热的测定实验
B.图乙可以保护钢闸门不被腐蚀
C.图丙用于铁上镀铜且硫酸铜溶液浓度不变
D.图丁中一段时间后,右侧导管内液面高于试管内液面
4.用氨水吸收硫酸工厂尾气中的SO2,发生的反应为:。下列说法正确的是( )
A.SO2分子的空间结构呈V形
B.NH3的电子式为
C.H2O是含极性键的非极性分子
D.SO32-中的S原子的杂化轨道类型为sp2杂化
5.下列离子方程式正确的是( )
A.硫化钠溶液和硝酸混合:S2−+ 2H+===H2S↑
B.用惰性电极电解饱和氯化钠溶液: 2Cl-+2H+Cl2↑+H2↑
C.向BaCl2溶液中通入CO2: Ba2+ +H2O+CO2 = BaCO3↓+ 2H+
D.向CuSO4溶液中滴加氨水至过量:Cu2+ + 4NH3·H2O = [Cu(NH3)4]2+ + 4H2O
6.下列依据热化学方程式得出的结论正确的是( )
A.已知:4P(红磷,s)=P4(白磷,s) ΔH=+29.2kJ∙ml−1,则等质量的红磷比白磷所具有的能量高
B.已知:2C2H4(g)+6O2(g)===4CO2(g)+4H2O (g ) ΔH=-3 200.8 kJ·ml-1,
则C2H4(g)的燃烧热ΔH=-1600.4 kJ·ml-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2, 则ΔH1>ΔH2
D. 已知:H+(aq)+OH-(aq)=H2O(l) ΔH=−57.3 kJ∙ml−1 ,
则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=−114.6 kJ∙ml−1
7.将NH3 、NO2设计成熔融固态氧化物燃料电池,总反应方程式为,该装置如图所示.下列关于该装置工作时的叙述正确的是( )
A.电极Y为正极,发生还原反应
B.电池工作时,氧离子从Y极向X极移动
C.X极的电极反应式:
D.若22.4L NO2参与反应,则通过外电路电子的物质的量是
8.下列实验及现象的解释或得出结论正确的是( )
9.五种短周期主族元素 X、Y、Z、M、Q 的原子序数依次增大,X 的 2p 轨道半充满,Y 的 s 能级电子数和 p 能级电子数相等, Z 是至今发现的电负性最大的元素,M 在元素周期表中处于周期序数等于族序数的位置,Q 的单质被广泛用作半导体材料。下列叙述中不正确的是( )
A.元素的第一电离能:XQ
C.气态氢化物分子的键角:Q>X>Y
D.最高价氧化物对应的水化物的酸性:X>Q>M
10.氮化硅(Si3N4)是一种重要的结构陶瓷材料。用石英砂和原料气(含N2和少量O2)制备Si3N4的操作流程如下(粗硅中含少量Fe、Cu的单质及化合物):( )
下列叙述不正确的是
A.“还原”主要被氧化为CO
B.“高温氮化”反应的化学方程式为
C.“操作X”可将原料气通过灼热的铜粉
D.“稀酸Y”可选用稀硫酸
11.下列物质性质的比较,不正确的是( )
A.微粒的半径:Al3+ < Cl- B.元素的电负性:P < S < Cl
C.共价晶体的硬度:晶体硅 > 金刚石D.离子晶体的熔点:NaCl > CsCl
12.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水蒸气,其主要过程如图所示。
已知:几种物质中化学键的键能如下表所示。
若反应过程中分解了2ml水蒸气,下列说法错误的是( )
A.过程Ⅰ吸收了926kJ能量
B.过程Ⅱ涉及非极性键的生成
C.过程Ⅲ属于放热反应
D.总反应的热化学方程式为
13.FeO立方晶胞结构如图所示(白球代表O2−),设晶胞参数为apm。下列说法错误的是( )
A.该晶胞含有4个Fe2+
B.每个O2−周围距离最近且等距的Fe2+数为4
C.基态Fe2+的未成对电子数为4
D.两个O2−之间最近的距离为
14.以铅蓄电池供电,利用双极膜(双极膜是一种复合膜,在直流电作用下,中间界面内水解离为H+和OH-,并实现其定向通过)电解制备磷酸和氢氧化钠的原理如图所示。下列说法正确的是
A.电极a的电极反应式:Pb-2e-=Pb2+
B.M膜为阴离子交换膜,N膜为阳离子交换膜
C.当电路中通过4ml电子时,电极c上产生2mlO2
D.产品室2制备的产品是磷酸
15.水合肼(N2H4·H2O)又称水合联氨,是重要的氢能源稳定剂,具有较强的还原性。水合肼的制备原理为:NaClO+2NH3•H2O=N2H4•H2O+NaCl+2H2O。下列制取水合肼的装置和操作不能达到实验目的的是( )
A.装置甲中试剂X可以选择碱石灰制取NH3
B.用装置乙作为反应过程的安全瓶
C.操作过程中要快速滴加NaClO溶液
D.用装置丁吸收反应中过量的NH3,并能防倒吸
二、非选择题(本题包括4小题,共55分)
16.(13分)以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取精银、Mn及MnO2的一种流程示意图如下。
已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是 。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有 。
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以形式浸出。
①将“浸银”反应的离子方程式补充完整
__________________+ [AgCl2]—+S
②浸出剂中H+的作用: 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:
① 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式
为 ;当电路中通过0.025NA电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为 mL(保留三位有效数字)。
17.(15分)氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:
Ⅰ.FeCl3·6H2O的制备,制备流程图如下:
(1)将废铁屑分批加入稀盐酸中,至盐酸反应完全。含有少量铜的废铁屑比纯铁屑反应快,原因为 。
(2)操作①所必需的玻璃仪器中,除烧杯外还有 。
(3)检验FeCl3溶液中是否残留Fe2+的试剂是 。
(4)为增大FeCl3溶液的浓度,向稀FeCl3溶液中加入纯Fe粉后通入Cl2。此过程中发生的主要反应的离子方程式有 。
(5)操作②为 ,冷却结晶,过滤、洗涤得到晶体。
Ⅱ.由FeCl3·6H2O制备无水FeCl3
将FeCl3·6H2O与液体SOCl2混合并加热,制得无水FeCl3。已知SOCl2沸点为77℃,反应方程式为:,装置如下图所示(夹持和加热装置略)。
(6)仪器A的名称为 ,干燥管中无水的作用是 。
(7)制备无水FeCl3的过程中可能产生少量亚铁盐,写出一种可能的还原剂:_____,并设计实验验证是该还原剂将Fe3+还原:_________________________________
18.(14分)甲醇是一种基本的有机化工原料,用途十分广泛。应用CO2催化加氢规模化生产甲醇是综合利用CO2, 实现“碳达峰”的有效措施之一。我国科学家研究发现二氧化碳电催化还原制甲醇的反应 CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H,需通过以下两步实现:
I. CO2(g)+H2(g) CO(g)+H2O(g) △H1
Ⅱ. CO(g)+2H2(g) CH3OH(g) △H2
反应过程中各物质的相对能量变化情况如图所示。
(1)___________,稳定性:过渡态1___________过渡态2(填“大于”“小于”或“等于”)
(2)基于催化剂的CO2电催化制备甲酸盐同时释放电能的装置如上图所示,该电池充电时,阳极的电极反应式为_____________,若电池工作tmin,Zn电极的质量变化为,则理论上消耗CO2的物质的量为__________。
(3) +6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有Cr2O72−)的原理示意图如下图所示。
①M极的电极反应式为 ,N极附近的pH (填“变大”或“变小”或“不变”)
②写出电解池中Cr2O72−转化为Cr3+的离子方程式 。
19.(13分)传统的锂离子电池或钠离子电池由于使用有机液态电解液而存在安全问题。发展全固态电池是解决这一问题的必然趋势。、、是常用的固体电解质。回答下列问题:
(1)基态Ti的价电子排布式为 ,PO43-的空间构型为 。
(2) NH3、PH3、AsH3的沸点由高到低的顺序是 。
(3) TiCl3是许多有机反应的催化剂,,TiCl3的熔点(340℃)显著低于TiF3的熔点(1200℃),其原因是 。
(4) Ti能形成化合物,该化合物中Ti3+的配位数为 ,在该化合物中不含 (填标号)。
A.键 B.键 C.配位键 D.离子键 E.极性键 F.非极性键
(5)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 固溶体。四方ZrO2晶胞如图所示。A原子的坐标为,B原子的坐标为,则C原子的坐标为 。该晶体密度为 (用NA阿伏加德罗常数数值,写出计算表达式)。
田家炳实验高级中学2023-2024学年高三上学期11月月考
化学答案
一、选择题
二、非选择题
16.(13分)
(1) Fe3+、Mn2+
(2) 2Fe3++Ag2S+4Cl—2Fe2++2[AgCl2]—+S 抑制水解,防止生成沉淀
(3) a (1分) NO3—+e-+2H+=NO2↑+H2O 112
17. (15分)
(1)在稀盐酸中形成原电池,加快反应速率 (2)漏斗、玻璃棒
(3)溶液(1分) (4)、
(5) )在HCl气流中蒸发浓缩
(6) 球形冷凝管(1分) 防止水蒸气进入反应装置与反应
(7) SO2(1分) 加盐酸酸化,再加BaCl2溶液,若产生白色沉淀,证明是SO2将Fe3+还原。
18.(14分)(1) 小于 (2)
(3) CH3OH-6e-+H2O=6H++CO2↑ 变大 +6Fe2++14H+=2Cr3++6Fe3++7H2O
19.(13分)(1)3d24s2 (1分) 正四面体形 (1分)
(2)
(3) TiCl3是分子晶体,TiF3是离子晶体,离子晶体的熔点高于分子晶体
(4) 6 (1分) B、F
(5)
选项
实验及现象
解释或结论
A
将灼热的木炭伸入浓硝酸中,有红棕色气体生成
木炭与浓硝酸反应生成了NO2
B
将SO2通入溴水中,溶液褪色
SO2具有还原性
C
向品红溶液中通入氯气,品红溶液褪色
氯气有漂白性
D
将盐酸与CaCO3反应生成的气体通入Na2SiO3溶液中有白色沉淀生成
C的非金属性大于Si
化学键
键能/()
463
496
436
138
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
B
D
D
A
D
C
C
B
A
D
C
C
B
B
C
相关试卷
这是一份山东省滨州市沾化实验高级中学2023-2024学年高三上学期第二次月考化学试题含答案,共11页。试卷主要包含了本试卷分第I卷两部分,可能用到的相对原子质量,利用下列装置,下列离子方程式书写正确的是,下列过程能达到实验目的的是等内容,欢迎下载使用。
这是一份湖北省沙市中学2023-2024学年高三上学期10月月考化学试题及答案,共20页。
这是一份湖北省百校联盟2023-2024学年高三上学期10月联考化学试题(月考),共10页。试卷主要包含了可能用到的相对原子质量,为阿伏加德罗常数的值等内容,欢迎下载使用。









