



【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 专题01 物质及其变化-练习.zip
展开复习要点聚焦
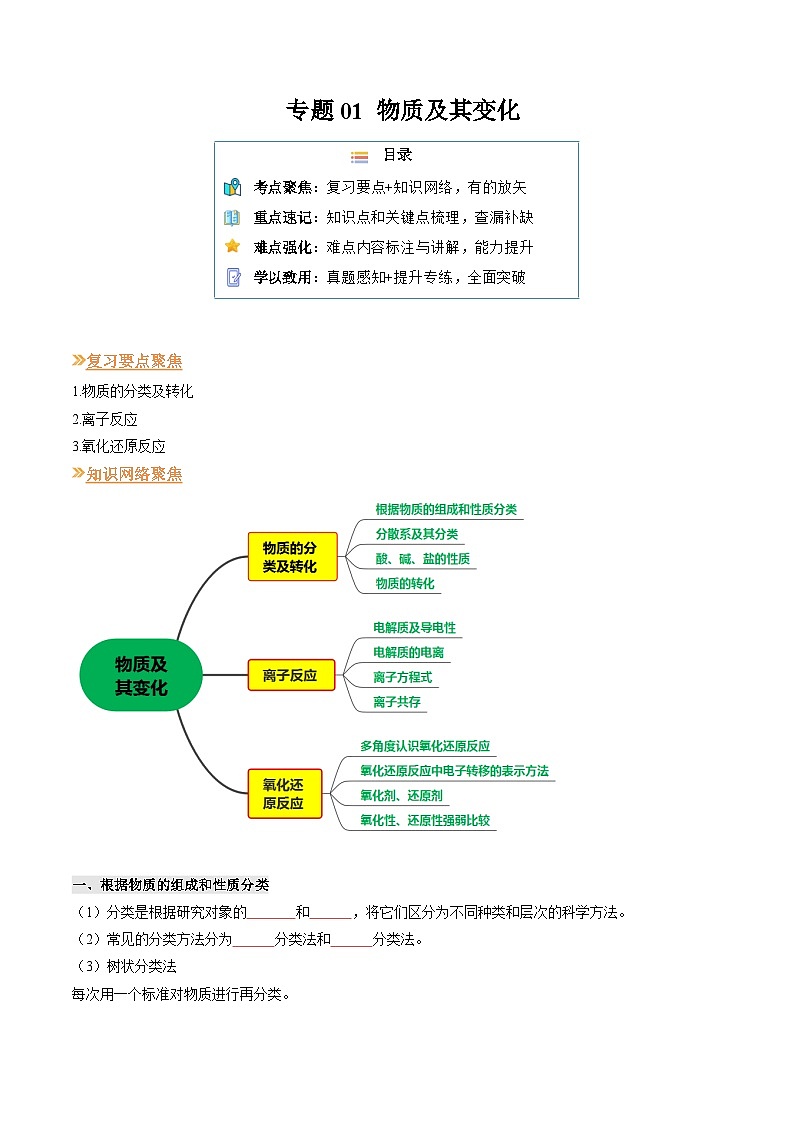
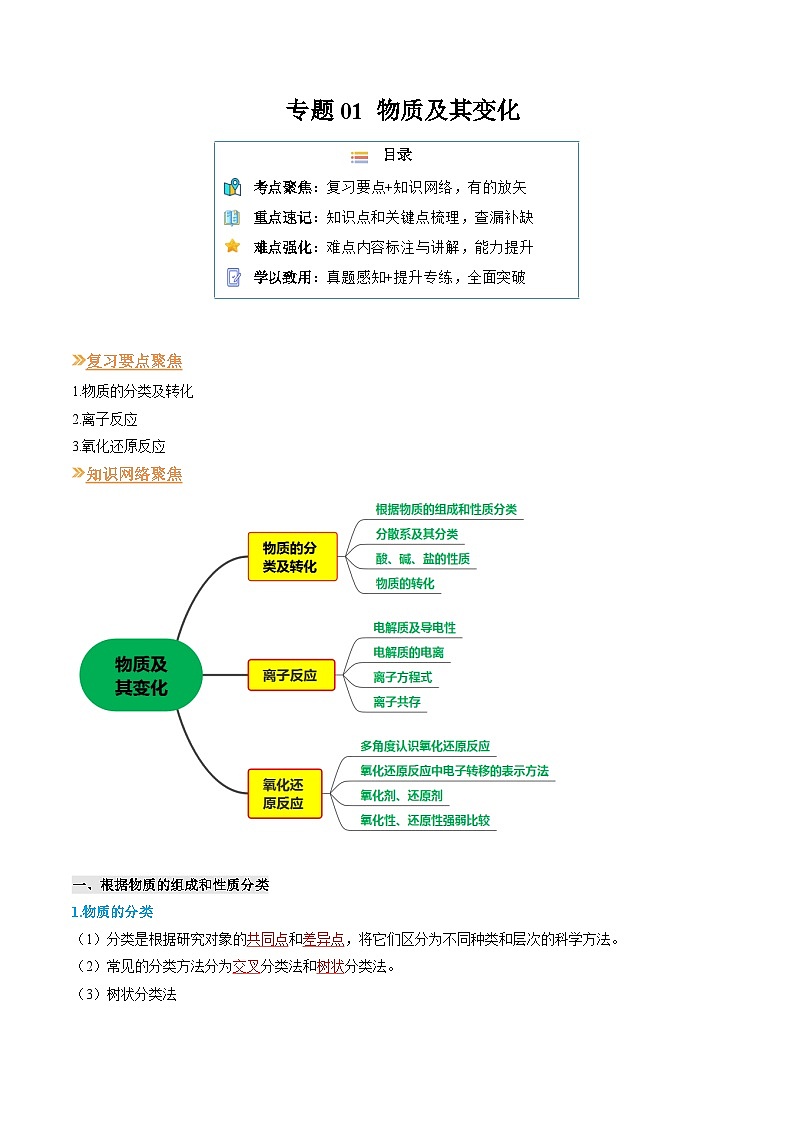
1.物质的分类及转化
2.离子反应
3.氧化还原反应
知识网络聚焦
一、根据物质的组成和性质分类
(1)分类是根据研究对象的 和 ,将它们区分为不同种类和层次的科学方法。
(2)常见的分类方法分为 分类法和 分类法。
(3)树状分类法
每次用一个标准对物质进行再分类。
物质eq \b\lc\{\rc\ (\a\vs4\al\c1(混合物如空气、漂白粉,纯净物\b\lc\{\rc\ (\a\vs4\al\c1(单质\b\lc\{\rc\ (\a\vs4\al\c1(金属单质如钠、汞,非金属单质如金刚石、氯气,稀有气体)),化合物\b\lc\{\rc\ (\a\vs4\al\c1(无机化合物,有机化合物))))))
(4)树状分类法在无机化合物分类中的应用
eq \b\lc\{\rc\ (\a\vs4\al\c1(氢化物:HCl、H2S、H2O、NH3等,氧化物\b\lc\{\rc\ (\a\vs4\al\c1(不成盐氧化物:CO、NO等,成盐氧化物\b\lc\{\rc\ (\a\vs4\al\c1(碱性氧化物:Na2O、CaO等,酸性氧化物:CO2、P2O5等,两性氧化物:Al2O3等)),过氧化物:Na2O2、H2O2等)),酸\b\lc\{\rc\ (\a\vs4\al\c1(按电离出的H+数\b\lc\{\rc\ (\a\vs4\al\c1(一元酸:HCl、HNO3等,二元酸:H2SO4、H2S等,三元酸:H3PO4等)),按酸根是否含氧\b\lc\{\rc\ (\a\vs4\al\c1(无氧酸:HCl、H2S等,含氧酸:HClO4、H2SO4等)),按酸性强弱\b\lc\{\rc\ (\a\vs4\al\c1(强酸:HCl、H2SO4、HNO3等,弱酸:CH3COOH、HF等)),按有无挥发性\b\lc\{\rc\ (\a\vs4\al\c1(挥发性酸:HNO3、HCl等,难挥发性酸:H2SO4、H3PO4等)))),碱\b\lc\{\rc\ (\a\vs4\al\c1(按水溶性\b\lc\{\rc\ (\a\vs4\al\c1(可溶性碱:NaOH、KOH、BaOH2等,难溶性碱:MgOH2、CuOH2等)),按碱性强弱\b\lc\{\rc\ (\a\vs4\al\c1(强碱:NaOH、BaOH2、KOH等,弱碱:NH3·H2O等)))),盐\b\lc\{\rc\ (\a\vs4\al\c1(正盐:BaSO4、KNO3、NaCl等,酸式盐:NaHCO3、KHSO4等,碱式盐:Cu2OH2CO3等,复盐:KAlSO42·12H2O等))))
2.有关氧化物中的“一定”和“不一定”
(1)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如SiO2、Fe2O3。
(2)能与酸反应生成盐和水的氧化物不一定是碱性氧化物,如Al2O3。
(3)能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如NO2、Al2O3。
(4)碱性氧化物都是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。
(5)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
(6)酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物,如醋酸酐(CH3CO)2O不属于氧化物。
3.纯净物和混合物判断中的特殊情况
(1)只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,红磷和白磷。
(2)结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。
(3)同位素形成的单质或化合物是纯净物,如H2与D2、H2O和D2O。
(4)常见的混合物
①气体混合物:空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)、焦炉气(主要成分是H2、C2H4、CO和CH4)、高炉煤气、石油气、裂解气。
②液体混合物:氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、浓H2SO4、盐酸、汽油、植物油、分散系(如溶液、胶体、浊液等)。
③固体混合物:碱石灰、漂白粉、高分子化合物(如蛋白质、纤维素、淀粉等)、玻璃、水泥、合金、铝热剂。
(5)分子式为C5H10的物质可能是纯净物,也可能是混合物。
二、分散系及其分类
1.分散系的概念与组成
(1)概念:把 以粒子形式分散到 中所形成的混合物。
(2)组成:分散系中 成粒子的物质叫做分散质,另一种物质叫做分散剂。
2.分散系的分类及其依据
按照分散质粒子直径的大小分类
3.胶体
(1)胶体的分类
根据分散剂的状态分类eq \b\lc\{\rc\ (\a\vs4\al\c1(气溶胶:如烟、云、雾,液溶胶:如豆浆、稀牛奶,固溶胶:如烟水晶、有色玻璃))
(2)氢氧化铁胶体的制备
①实验操作:在小烧杯中加入40 mL 蒸馏水,加热至 ,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈 色,停止加热,即可得到氢氧化铁胶体。
②反应原理:FeCl3+3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3HCl。
(3)用丁达尔效应区分 和溶液。
4.溶液、胶体、浊液三类分散系的比较
5.胶体的性质及应用
【特别提醒】
(1)胶体区别于其他分散系的本质特征是分散质粒子的直径大小(1~100 nm)。
(2)区分胶体和溶液两种分散系的最简便的方法是利用丁达尔效应。
(3)胶粒不是胶体,是分散质,一般是大量难溶物(分子)的聚集体或高分子(淀粉、蛋白质)。
(4)胶体不带电荷,胶体粒子因吸附离子往往带有电荷,但淀粉胶体的胶体粒子不带电荷。
三、酸、碱、盐的性质及转化
四、电解质及导电性
1.电解质与非电解质
(1)单质和混合物既不是电解质也不是非电解质,如Cu、NaCl溶液。
(2)电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如铁、铝等金属单质。
(3)本身电离而导电的化合物才是电解质。如CO2、SO2、NH3的水溶液能导电,但均是非电解质。
(4)电解质的强弱与电解质溶液导电能力的强弱、溶解性的大小没有直接关系。如碳酸钙,其溶解性小,溶液导电性差,但其属于强电解质。
(5)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
(6)电解质、非电解质均必须是化合物,混合物(溶液)、单质既不是电解质也不是非电解质。
2.溶液的导电性
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨等是非电解质)。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
3.电解质溶液的导电原理
电解质电离出的阴、阳离子在外加电场作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带的电荷数越多,电解质溶液的导电能力越强。同一温度下,强电解质溶液(a),弱电解质溶液(b),金属导体(c),三者的导电能力相同,若升高温度,它们的导电能力大小顺序为b>a>c。
五、电解质的电离和电离方程式
1.电解质的电离:电解质 或 时,形成自由移动的离子的过程。
2.电离方程式书写的注意事项
①符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
②质量守恒,即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
③电荷守恒,即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
3.电离方程式书写的思维模型
六、离子反应和离子共存
1.离子反应:有离子参加或有离子生成的反应统称为离子反应。
2.离子反应发生的条件:①生成 的物质、②生成 的物质、③生成 的物质、④发生 反应。
3.离子反应的本质:是溶液中某些离子的物质的量的 。
4.离子共存的判断原理
离子共存即溶液中的离子之间不能发生反应。判断溶液中的离子能否大量共存,事实上是看离子之间能否发生反应,若能发生反应,则不能大量共存;若不能发生反应,则能大量共存。
七、离子方程式
1.离子方程式:用实际参加反应的 来表示反应的式子。
2.离子方程式的意义
离子方程式不仅可以表示 ,还可以表示 。
3.电解质的“拆分”原则
(1)易溶的强电解质(强酸、强碱、大多数可溶性盐)写成离子形式。
①常见的强酸、弱酸
【特别提醒】浓盐酸、浓硝酸在离子方程式中可拆,浓硫酸一般不拆。
②常见的强碱、弱碱
③酸式盐
a.弱酸的酸式酸根离子不能拆开,如HCOeq \\al(-,3)、HS-、HSOeq \\al(-,3)等;
b.强酸的酸式酸根离子(如HSOeq \\al(-,4))在水溶液中写成拆分形式,如NaHSO4应写成Na+、H+和SOeq \\al(2-,4);而在熔融状态下HSOeq \\al(-,4)不能拆开,应写成Na+和HSOeq \\al(-,4)。
(2)固体之间的反应、浓硫酸(或浓磷酸)与固体之间的反应,不能电离出离子,所以不写离子方程式。如:
Ca(OH)2(s)+2NH4Cl(s)eq \(=====,\s\up7(△))CaCl2(s)+2NH3↑+2H2O。
八、氧化还原反应
1.氧化还原反应的本质和特征
2.氧化还原反应与四种基本反应类型间的关系
九、氧化还原反应的概念
1.基于双线桥理解氧化还原反应概念之间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
2.常见的氧化剂和还原剂
(1)常见氧化剂
常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(2)常见还原剂
常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
(3)元素化合价处于中间价态的物质既有 性,又有 性
其中:Fe2+、SOeq \\al(2-,3)主要表现 性,H2O2主要表现 性。
十、氧化性、还原性强弱比较
1.氧化性、还原性的判断
(1)氧化性是指 的性质(或能力);还原性是指 的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的 程度,与得、失电子数目的 无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
从元素的价态考虑:
最高价态——只有 ,如:浓H2SO4、KMnO4等;
最低价态——只有 ,如:金属单质、Cl-、S2-等;
中间价态——既有 又有 ,如:Fe2+、S、Cl2等。
2.氧化性、还原性强弱的比较
(1)根据化学方程式判断
氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
(2)根据反应条件和产物价态高低进行判断
①与同一物质反应,一般越易进行,则其氧化性或还原性就越强。如Na与冷水剧烈反应,Mg与热水反应,Al与水加热反应也不明显,所以还原性:Na>Mg>Al;非金属单质F2、Cl2、Br2、I2与H2反应,F2与H2暗处剧烈反应并爆炸,Cl2与H2光照剧烈反应并爆炸,Br2与H2加热到500 ℃才能发生反应,I2与H2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F2>Cl2>Br2>I2。
②当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应条件的高低进行判断:一般条件越低,氧化剂的氧化性越强,如:MnO2+4HCl(浓)eq \(=====,\s\up7(△))MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,由上述反应条件的不同,可判断氧化性:KMnO4>MnO2。
③当不同氧化剂作用于同一还原剂时,如果氧化产物价态不相同,可根据氧化产物的价态高低进行判断:氧化产物的价态越高,则氧化剂的氧化性越强,如:2Fe+3Cl2eq \(=====,\s\up7(点燃))2FeCl3,Fe+Seq \(=====,\s\up7(△))FeS,则氧化性:Cl2>S。
十一、氧化还原反应中的四种规律
1.守恒规律
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数。
元素化合价降低的总数=元素化合价升高的总数。
2.价态规律
(1)高低规律
元素处于最高价态时,只有氧化性;元素处于中间价态时,既有氧化性又有还原性;元素处于最低价态时,只有还原性,即“高价氧,低价还,中间价态两边转”。
应用:判断物质的氧化性、还原性。
(2)归中规律
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
如:
H2S中S元素为-2价,与产物中的单质S的0价近,所以H2S生成S。
3.强弱规律
还原剂 + 氧化剂===氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物。即“强制弱”或“前强后弱”。
应用:物质间氧化性(或还原性)强弱的比较或判断氧化剂(或还原剂)和有还原性(或氧化性)的物质在一定条件下能否发生反应。
4.先后规律
(1)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,因为还原性:Fe2+>Br-,所以氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,因为还原性:I->Fe2+,所以氯气的量不足时首先氧化I-。
(2)同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
反应:判断物质的氧化性、还原性强弱或判断反应的先后顺序。
十二、氧化还原反应方程式的配平及计算
1.氧化还原反应方程式配平的基本原则
(1)得失电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2.氧化还原方程式配平的一般步骤
【方法技巧】
(1)全变从左边配:氧化剂、还原剂中某元素化合价是全变的,一般从左边反应物着手配平。
(2)自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
(3)缺项配平法:先将得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加水,然后进行两边电荷数配平。
(4)当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
(5)在有机物参与的氧化还原反应方程式的配平中,一般有机物中H显+1价,O显-2价,根据物质中元素化合价代数和为零的原则,确定碳元素的平均价态,然后进行配平。
十三、氧化还原反应的计算
1.计算依据
(1)氧化剂获得电子总数等于还原剂失去电子总数,即得失电子守恒。
(2)氧化剂中元素降价总数等于还原剂中元素升价总数,即化合价升降守恒。
2.守恒法解题的思维流程
(1)找出氧化剂、还原剂及相应的还原产物和氧化产物。
(2)找准一个原子或离子得失电子数(注意化学式中粒子的个数)。
(3)根据题中物质的物质的量和得失电子守恒列出等式。
n(氧化剂)×变价原子个数×化合价变化值(高价-低价)=n(还原剂)×变价原子个数×化合价变化值(高价-低价)。
强化点一 “五审法”判断离子方程式的正误
1.看离子反应是否符合客观事实。如铁与稀硫酸的反应不能写成2Fe+6H+===2Fe3++3H2↑,应写成Fe+2H+===Fe2++H2↑。
2.看各物质的化学式拆写是否正确。如石灰石与稀盐酸的反应不能写成COeq \\al(2-,3)+2H+===H2O+CO2↑,应写成CaCO3+2H+===Ca2++H2O+CO2↑。注意:微溶物在生成物中当成沉淀,不拆写,若为反应物且为澄清溶液则拆成离子,如Ca(OH)2。
3.看是否漏写参加反应的离子。如硫酸铜溶液和氢氧化钡溶液的反应,离子方程式不能写成SOeq \\al(2-,4)+Ba2+===BaSO4↓,应写成Cu2++SOeq \\al(2-,4)+Ba2++2OH-===Cu(OH)2↓+BaSO4↓。
4.看原子和电荷是否守恒。如Cu与AgNO3溶液反应的离子方程式不能写成Cu+Ag+===Cu2++Ag,而应写成Cu+2Ag+===Cu2++2Ag。
5.看反应物或生成物的配比是否正确。如稀硫酸与Ba(OH)2溶液的反应不能写成H++OH-+SOeq \\al(2-,4)+Ba2+===BaSO4↓+H2O,应写成2H++2OH-+SOeq \\al(2-,4)+Ba2+===BaSO4↓+2H2O。
强化点二 “三看”突破溶液中离子能否大量共存
1.看要求
是“能大量共存”还是“不能大量共存”;是“一定大量共存”还是“可能大量共存”。
2.看条件
题干是否有隐含条件:①“无色透明”溶液不存在有色离子,例如:Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnOeq \\al(-,4)(紫红色);②酸性溶液不能大量存在与H+反应的离子;③碱性溶液不能大量存在与OH-反应的离子。
3.看反应
(1)能否生成难溶物或微溶物。如Mg2+与OH-,Ca2+与COeq \\al(2-,3)、SOeq \\al(2-,4)都不能大量共存;
(2)能否生成水。如在酸性溶液中OH-不能大量共存,在碱性溶液中H+不能大量共存;
(3)能否生成挥发性物质。如H+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-等不能大量共存。
强化点三 离子推断的“四项基本原则”
1.肯定性原则:据现象推断存在或肯定不存在的离子。
2.互斥性原则:如溶液中含有Ba2+,则不存在大量的COeq \\al(2-,3)、SOeq \\al(2-,4)。
3.进出性原则:要注意所加试剂引入什么离子,是否造成干扰。
4.守恒原则(电中性原则):阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
1.(2023上·广东汕头·高一校考期中)金灶镇某村林某某考上重点大学,村委放映3夜“投影”(露天电影)并通报表彰。如图,可观察到投影机与屏幕之间有一条光束。产生光束的根本原因是
A.灰尘分散于空气形成胶体
B.空气中的“烟”或雾产生了丁达尔效应
C.空中的某些灰尘直径在1-100nm之间
D.投影机投射的光线特别强
2.(2023上·河北唐山·高一统考期中)下列说法正确的是①能导电的物质一定是电解质②胶体和溶液都是混合物③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质④丁达尔效应可用于区别蛋白质溶液与葡萄糖溶液⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物
A.①②④B.①③⑤C.③④⑤D.②④⑤
3.(2023上·广东汕头·高一校考期中)下列说法中正确的是
A.固态NaCl均不导电,所以NaCl均是非电解质
B.酒精在水溶液里和熔融状态时均不导电,所以它是非电解质
C.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
D.铜、石墨均导电,所以它们是电解质
4.(2023上·广东汕头·高一校考期中)下列物质在给定条件下的转化不能一步实现的是
A.Fe2O3FeFeCl2B.H2O2O2 H2O
C.CaCl2溶液CaCO3CO2D.CuSO4溶液CuCuO
5.(2023上·安徽安庆·高一校考期中)表中关于物质的分类正确的是
6.(2023上·广东东莞·高一校考期中)下列化学用语运用正确的是
A.和互为同素异形体
B.中铁元素的化合价是+3
C.氧化还原反应中电子转移方向和数目的表示:
D.在水溶液中的电离方程式:
7.(2023上·河北衡水·高一校考期中)一定条件下,当溶液中XO与H2O2分子个数比恰好为2∶3时,溶液中XO离子被还原为较低价态,则X元素的化合价变为
A.+2B.+3C.+4D.+5
8.(2023上·四川成都·高一校考期中)在下列条件的溶液中,一定能大量共存的离子组是
A.澄清透明溶液:
B.含有的溶液中:
C.常温下使石蕊试液变蓝的溶液:
D.加入铁粉放出的溶液:
9.(2023上·吉林·高一校联考期中)下列离子方程式书写正确的是
A.与浓盐酸反应制:
B.稀硫酸与氢氧化钡溶液混合:
C.大理石与醋酸反应产生二氧化碳:
D.用氯化铁溶液氧化:
10.(2023上·湖南长沙·高一校考期中)某离子反应中涉及H2O、ClO-、、H+、N2、Cl-六种微粒。其中N2的数目随时间变化的曲线如图所示。下列判断正确的是
A.该反应的还原剂是Cl-
B.消耗1个,转移6个电子
C.该反应中N2作为氧化剂
D.氧化剂与还原剂的个数之比为3:2
11.(2023上·辽宁大连·高一校考期中)关于反应KClO3 + 6HCl(浓) = KCl + 3Cl2↑+ 3H2O,下列说法正确的是
A.被氧化的氯原子与被还原的氯原子的个数之比为6∶1
B.在反应中KCl为还原产物
C.氧化性:KClO3>Cl2
D.用单线桥法表示电子转移情况:
12.(2023上·广东深圳·高一校考期中)我国化学家用氧化铟(In2O3)负载的Ag催化剂实现了CO2加氢制备CH3OH,原理如图所示。关于该反应的说法错误的是
A.H2发生了氧化反应
B.Ag催化剂参与反应
C.该反应方程式为3H2+CO2CH3OH+H2O
D.每转移3个电子生成1个CH3OH
13.(2023上·山东济宁·高一统考期中)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2。若氧化产物比还原产物多24.5g。则下列判断正确的是
A.反应过程中KNO3被氧化
B.为还原产物
C.氧化产物与还原产物的质量比为
D.该反应一共转移10个电子
14.(2023上·福建泉州·高一校考期中)下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有、、,、,、、中的若干种离子,该小组同学取100 mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1 ml⋅L硝酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是
A.水样中一定不存在、、,可能存在
B.水样中一定存在、和
C.由B点到C点变化过程中消耗硝酸的体积为40 mL
D.水样中一定存在,且
15.(2023上·陕西安康·高一统考期中)向稀溶液中滴入几滴酚酞溶液,将电导率传感器插入溶液中,然后匀速加入饱和溶液,电导率(电导率是以数字表示的溶液传导电流的能力)与时间的变化关系如图 。下列说法错误的是
A.b点时,溶液恰好由红色变为无色
B.a点到b点的离子方程式为
C.b点到c点的离子方程式为
D.c点后,溶液中的溶质为和
16.(2023上·江苏连云港·高一校联考期中)与浓盐酸的反应是实验室制备氯气的方法之一:,下列说法不正确的是
A.氧化性:
B.HCl在反应中表现出还原性和酸性
C.被氧化的氯原子与被还原的氯原子的个数之比为5∶1
D.用双线桥法表示电子得失情况:
17.(2023上·山东济宁·高一统考期中)宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是,下列说法正确的是
A.反应中Ag和均是还原剂B.X既是氧化产物又是还原产物
C.每生成0.2 ml X,消耗)2.24 L D.银针验毒时,空气中氧气得到电子
18.(2023上·四川雅安·高一统考期中)常温下,下列实验过程中所产生的变化与所示图像不相符的是
A.向一定质量接近饱和的溶液中不断加入固体
B.向一定溶质质量分数的稀硫酸中加入
C.向一定体积的溶液中滴加稀硫酸
D.向和的混合固体中逐滴滴加稀硫酸并搅拌
19.(2023上·北京海淀·高一校考期中)回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:。
(1)请用“双线桥”表示上述反应电子转移的方向和数目 。
(2)反应中,氧化剂为 ,氧化产物为: 。
(3)浓盐酸在反应中体现出来的性质有 (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
Ⅱ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为,该反应中还原剂是 。(填化学式)
(5)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1个转移 个电子。
20.(2023上·陕西咸阳·高一统考期中)表中是生产生活中常见的物质,表中列出了它们的一种主要成分。
(1)写出一种与⑧互为同素异形体的物质 ;表中①~⑥的主要成分属于电解质的是 (填编号)。
(2)分别写出③、⑤在水中的电离方程式:
③ ,
⑤ 。
(3)写出下列反应的离子方程式:
ⅰ.用澄清的⑤溶液检验气体 。
ⅱ.③和④反应产生气体 。
(4)已知和都属于酸性氧化物,预测与CaO在高温下反应的化学方程式: 。
目录
考点聚焦:复习要点+知识网络,有的放矢
重点速记:知识点和关键点梳理,查漏补缺
难点强化:难点内容标注与讲解,能力提升
学以致用:真题感知+提升专练,全面突破
分散系
溶液
胶体
浊液
分散质粒子种类
分子、离子
大量分子聚集体或大分子
大量粒子聚集体
分散质粒子直径
小于1 nm
介于1~100 nm
大于100 nm
外部特征
均一、透明、稳定
较均一、透明、较稳定
不均一、不透明、不稳定,久置沉淀(或分层)
能否透过滤纸
能
能
不能
鉴别方法
胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别
强酸
HNO3、H2SO4、HClO4、HCl、HBr、HI
弱酸
H2CO3、H2SiO3、CH3COOH、H2C2O4、HClO、HF、H2S、H2SO3
强碱
NaOH、KOH、Ca(OH)2、Ba(OH)2
弱碱
NH3·H2O、Mg(OH)2、Fe(OH)3
选项
电解质
强电解质
碱性氧化物
酸性氧化物
A
H2SO4
NaOH
Na2O2
CO2
B
盐酸
纯碱
CaO
SO2
C
CH3COOH
NH3·H2O
Na2O
SO3
D
NaHSO4
Ba(OH)2
Fe2O3
P2O3
编号
①
②
③
④
⑤
⑥
⑦
⑧
名称
水玻璃
干冰
硫酸氢钠
小苏打
熟石灰
酒精
牙膏摩擦剂
石墨
成分
溶液
C
【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 预习检测卷-练习.zip: 这是一份【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 预习检测卷-练习.zip,文件包含寒假作业人教版2019高中化学高一寒假巩固提升训练预习检测卷原卷版docx、寒假作业人教版2019高中化学高一寒假巩固提升训练预习检测卷解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 第08讲 乙醇与乙酸-练习.zip: 这是一份【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 第08讲 乙醇与乙酸-练习.zip,文件包含寒假作业人教版2019高中化学高一寒假巩固提升训练第08讲乙醇与乙酸原卷版docx、寒假作业人教版2019高中化学高一寒假巩固提升训练第08讲乙醇与乙酸解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 第01讲 硫及其化合物-练习.zip: 这是一份【寒假作业】(人教版2019)高中化学 高一寒假巩固提升训练 第01讲 硫及其化合物-练习.zip,文件包含寒假作业人教版2019高中化学高一寒假巩固提升训练第01讲硫及其化合物原卷版docx、寒假作业人教版2019高中化学高一寒假巩固提升训练第01讲硫及其化合物解析版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。