
2023-2024学年四川省眉山市高二上册1月期末化学模拟试题(附答案)
展开注意事项:
答卷前,考生务必将自己的姓名、考号等填写在答题卡上。
回答选择题时,用铅笔把答题卡上对应题目的答案标号涂黑。非选择题时,将答案写在答题卡上,写在试卷上无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mn-55
第I卷
一、选择题(本部分共14题,每题3分,共42分。在每题列出的四个选项中选出最符合题目要求的一项。)
1.2023年第31届世界大学生运动会在成都举行,此次大运会采用氢气作为火炬燃料,选择氢能汽车作为赛事交通服务用车,充分体现了绿色运动会的理念。下列说法正确的是
A.火炬燃料的燃烧是热能转化为化学能的过程
B.使用氢能作燃料符合“碳中和”理念
C.燃烧属于放热反应,反应物总能量低于生成物的总能量
D.放热反应常温下就可以进行,吸热反应一定需要加热才能发生
2.化学与生产、生活密切相关。下列事实与化学反应速率无关的是
A.食品中添加适量的防腐剂 B.医护人员冷藏存放“新冠”疫苗
C.食盐中添加碘酸钾 D.工业矿石冶炼前先将矿石粉碎
3.广安美食助力乡村旅游发展,其中武胜特色猪肝面享誉省内外,下列用于制作猪肝面的食材呈现碱性的是
A.小苏打溶液 B.花生油 C.淀粉溶液 D.食醋
4.对于反应2A(g)+3B(g)2C(g) ΔH<0,下列说法正确的是
A.增加反应物的浓度,能够增大活化分子百分数
B.使用合适的催化剂,可以降低反应的活化能,提高化学反应速率
C.缩小体积增大压强,能够增大活化分子百分数,从而提高化学反应速率和C的产率
D.升高温度能加快反应速率,提高A的平衡转化率
5.下列说法正确的是
A.非自发的反应一定不能发生
B.反应NH3(g)+ CO2(g)+H2O(l)=NH4HCO3(s)在室温下可自发进行,则该反应的△H<0
C.相同质量的同种物质气态时熵值最小,固态时熵值最大
D.恒温恒压下,△H<0且△S>0的反应不能自发进行
6.下列事实不能用勒夏特列原理解释的是
A.新制氯水光照后颜色变浅
B.打开汽水瓶有气泡从溶液中冒出
C. H2(g)+I2(g)2HI(g)的平衡体系中,加压缩小体积后颜色加深
D.合成氨工厂采用增大压强以提高原料的转化率
7.依据下列热化学方程式得出的结论中,正确的是
A.已知,则氢气的燃烧热为
B.已知H+(aq)+OH—(aq)=H2O(l) ΔH= -57.3 kJ·ml-1,用含20.0 g NaOH的稀溶液与稀盐酸反应测出的中和反应放出热量为28.65 kJ
C.已知N2(g)+3H2(g) 2NH3(g) ΔH= -92 kJ·ml-1,现将2mlN2和6mlH2充入密闭容器中充分反应后,放出的热量为184 kJ
D.已知;;则
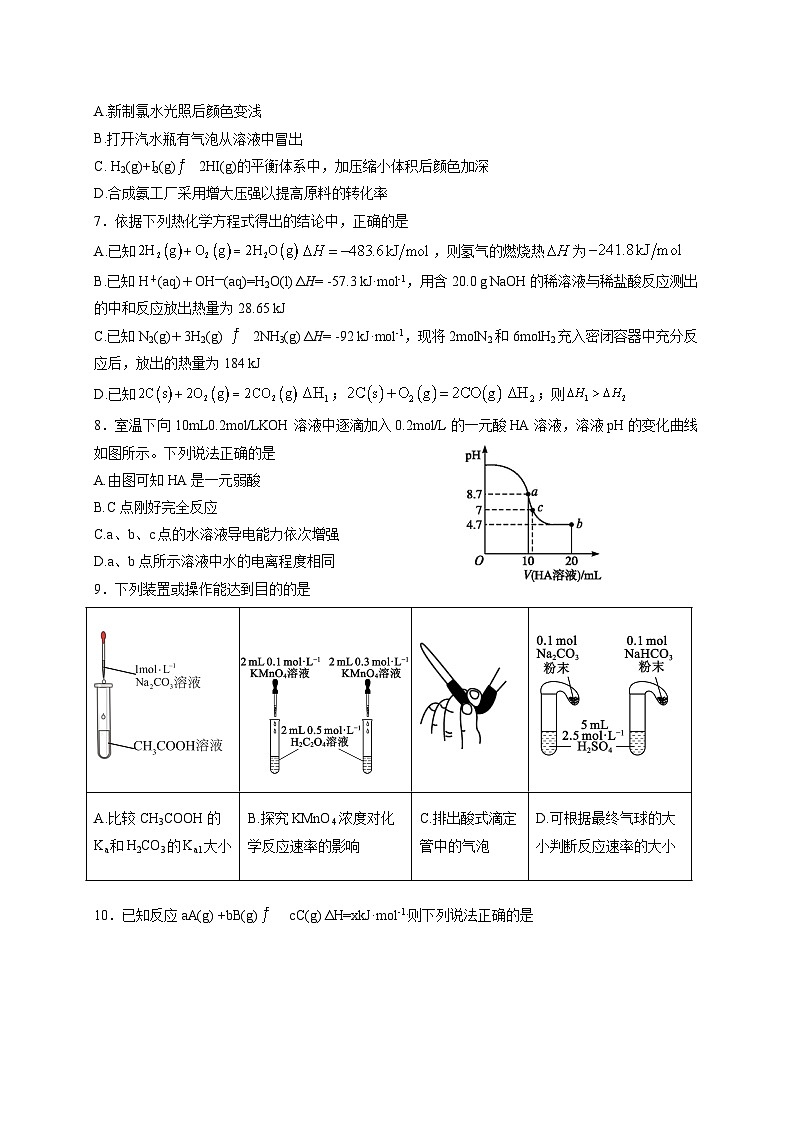
8.室温下向10mL0.2ml/LKOH溶液中逐滴加入0.2ml/L的一元酸HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是
A.由图可知HA是一元弱酸
B.C点刚好完全反应
C.a、b、c点的水溶液导电能力依次增强
D.a、b点所示溶液中水的电离程度相同
9.下列装置或操作能达到目的的是
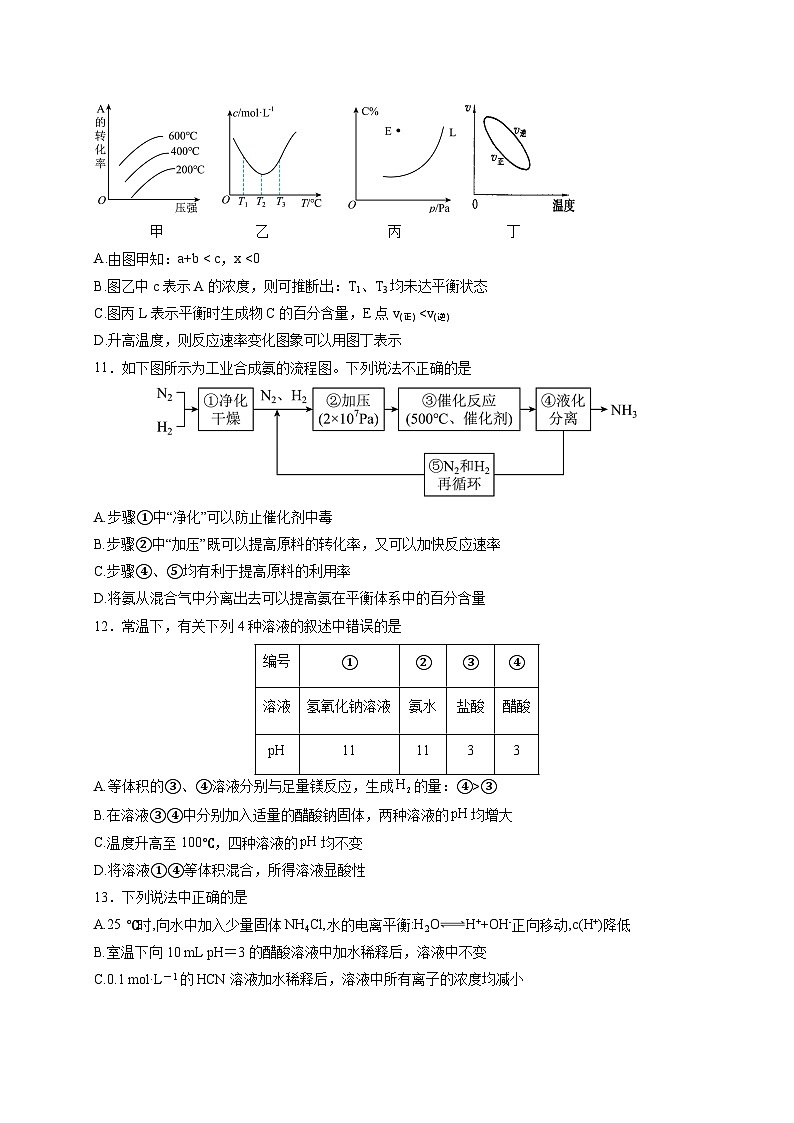
10.已知反应aA(g) +bB(g) cC(g) ΔH=xkJ·ml-1.则下列说法正确的是
甲 乙 丙 丁
A.由图甲知:a+b < c,x <0
B.图乙中c表示A的浓度,则可推断出:T1、T3均未达平衡状态
C.图丙L表示平衡时生成物C的百分含量,E点v(正)
11.如下图所示为工业合成氨的流程图。下列说法不正确的是
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤④、⑤均有利于提高原料的利用率
D.将氨从混合气中分离出去可以提高氨在平衡体系中的百分含量
12.常温下,有关下列4种溶液的叙述中错误的是
A.等体积的③、④溶液分别与足量镁反应,生成的量:④>③
B.在溶液③④中分别加入适量的醋酸钠固体,两种溶液的均增大
C.温度升高至100℃,四种溶液的均不变
D.将溶液①④等体积混合,所得溶液显酸性
13.下列说法中正确的是
A.25 ℃时,向水中加入少量固体NH4Cl,水的电离平衡:H2OH++OH-正向移动,c(H+)降低
B.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中不变
C.0.1 ml·L-1的HCN溶液加水稀释后,溶液中所有离子的浓度均减小
D.已知0.1 ml·L-1的CH3COOH溶液中存在电离平衡:CH3COOHCH3COO-+H+,加少量烧碱固体可使溶液增大
14.一定条件下,分别向体积为2L的密闭容器中充入气体,发生反应:
2A(g)+B(g) C(g),测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法正确的是
实验①:恒温恒容条件下充入4mlA、2mlB
实验②:恒温恒容条件下充入2mlC
实验③:绝热恒容条件下充入2mlC
曲线Ⅰ对应实验③
B.正反应为吸热反应
C.b点平衡常数比c点平衡常数大
D.气体的总物质的量:nc>nd
第II卷
二、非选择题(本部分共4小题,共58分)
15.(14分)碳元素形成的单质及化合物是人类生产生活的主要能源物质。
(1)在密闭容器中进行如下反应:C(s)+H2O(g)CO(g)+H2(g) ,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡、转化率等如何变化。
①恒温条件,缩小反应容器的容积,则平衡___________,(填“逆移”“正移”或“不移”,下同),___________(填“增大”“减小”或“不变”,下同)。
②升高温度,则平衡___________,化学反应速率___________,化学平衡常数 。
③该反应到达平衡后,再充入H2O(g),则平衡________,H2O的平衡转化率将 。
(2)常温常压下,已知的燃烧热为。
写出表示燃烧热的热化学方程式 ;
(3)科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其中吸附在钯催化剂表面上的物种用*标注。
该历程中最大能垒活化能____________KJ/ml,该步骤的化学方程式为 。
16.(14分)I、(1)25℃时,1 ml/L的 NH4Cl、 CH3COONH4、NH4HSO4溶液中,测得它们的 c(NH4+) 分别为a、b、c,则a、b、c由大到小的顺序是 。
(2)物质的量浓度相同的下列溶液: ①氢氧化钾 ②氯化铵 ③氯化钠 ④硫酸氢钠 ⑤碳酸氢钠 ⑥氢氧化钡 ⑦醋酸钠,按pH由小到大的顺序排列的是( )
A.②④⑤③①⑦⑥ B.④②⑤③①⑥⑦
C.④②③⑦⑤①⑥ D.⑥⑦①③⑤④②
II、常温下,部分酸的电离常数如表所示。
(3)写出HCN在水溶液中的电离方程式 。
(4)中和等量的NaOH,消耗等pH的HF和HCN的体积分别为aL、bL,则a b(填“大于”“小于”或“等于”)。
(5)若CH3COOH的起始浓度为2ml•L-1,平衡时c(H+)约为 ml•L-1,使此溶液中CH3COOH的电离程度增大且c(H+)也增大的方法是 。
(6)向NaCN溶液中通入少量CO2,发生反应的离子方程式为 。
17.(16分)丙烯是重要的有机化工原料,丙烷脱氢是工业生产丙烯的重要途径,其化学方程式为。回答下列相关问题:
(1)已知:I.
II.
则丙烷脱氢制丙烯反应的为 ,该反应在 (填“高温”“低温”“任何温度”)条件下可以自发进行。
(2)一定温度下,向的密闭容器中充入发生脱氢反应,经过达到平衡状态,测得平衡时气体压强是开始的1.6倍。
①丙烯的化学反应速率 。
②欲提高反应的速率和丙烷转化率,可采取的措施是 。
A.缩小容积 B.加催化剂 C.升高温度 D.及时分离出
E.体积不变充入丙烷 F体积不变充入Ar
③下列叙述能说明反应到达平衡状态的是( )
A.容器内气体的总压强不变 B.容器内气体密度不变
C.C3H6的浓度不再变化 D. 容器内气体平均摩尔质量不再变化
E.单位时间内消耗amlC3H8同时生成amlH2
④若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始越大,丙烷的平衡转化率越大,其原因是 。
(3)一定温度下,向2L恒容密闭容器中充入,平衡时总压强为的气体体积分数与反应时间的关系如图:
此温度下该反应的平衡常数Kp= (用含字母的代数式表示,Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。平衡后,继续向容器中充入1mlC3H8,则= (填“增大”、“减小”或“不变”)。其中v正=k正·p(C3H8 ),
v逆=k逆·p( C3H6)·p(H2)。
18.(14分)MnO2是重要的化工原料,山软锰矿制备MnO2的一种工艺流程如图:
资料:软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2
步骤一:溶出
(1)①溶出前,软锰矿需研磨。目的是 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
步骤II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是 。
步骤二:纯化。纯化时先加入MnO2,后加入NH3·H2O,调溶液pH≈5,除去杂质离子。
步骤三:电解。Mn2+纯化液经电解得MnO2。
步骤四:产品纯度测定。向8.7g产品中加入含9.0gH2C2O4的溶液发生反应,加热至充分反应,冷却后再用0.1ml·L-1KMnO4溶液滴定剩余H2C2O4至终点,消耗KMnO4溶液的体积为10mL(已知:MnO2及MnO4-均被还原为Mn2+。相对分子质量:MnO2-87.0;H2C2O4-90.0)
(2)①酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。
②滴定时,眼睛应 。
③本实验滴定达到终点的依据可以是 。
④产品纯度为 (用质量分数表示)。
⑤以下哪些操作会导致测定的结果偏高 (填字母编号)。
a.装入KMnO4溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
A.比较CH3COOH的Ka和H2CO3的Ka1大小
B.探究KMnO4浓度对化学反应速率的影响
C.排出酸式滴定管中的气泡
D.可根据最终气球的大小判断反应速率的大小
编号
①
②
③
④
溶液
氢氧化钠溶液
氨水
盐酸
醋酸
pH
11
11
3
3
化学式
HF
HCN
H2CO3
CH3COOH
电离常数
Ka=3.5×10-4
Ka=3.6×10-10
Ka1=4.3×10-7,Ka2=5.6×10-11
Ka=1.8×10-5
四川省眉山市2023-2024学年高二上学期期末考试化学试题(含答案): 这是一份四川省眉山市2023-2024学年高二上学期期末考试化学试题(含答案),共14页。试卷主要包含了01,5 Ar-40 Cu-64,20,21等内容,欢迎下载使用。
2023-2024学年四川省宜宾市高二上册1月期末考试化学模拟试题(附答案): 这是一份2023-2024学年四川省宜宾市高二上册1月期末考试化学模拟试题(附答案),共11页。试卷主要包含了5 Si,3 kJ/ml,0倍等内容,欢迎下载使用。
2023-2024学年四川省合江县高二上册1月期末化学模拟试题(附答案): 这是一份2023-2024学年四川省合江县高二上册1月期末化学模拟试题(附答案),共9页。试卷主要包含了5 Si,6kJ·ml-1,6kJ,5kJ·ml-1,8 ml Z,测得Q的浓度为0等内容,欢迎下载使用。












