




所属成套资源:2024中考一轮化学讲练测(课件PPT)
专题02+质量守恒定律+化学方程式(练习)-2024年中考化学一轮复习讲练测(全国通用)
展开
这是一份专题02+质量守恒定律+化学方程式(练习)-2024年中考化学一轮复习讲练测(全国通用),文件包含专题02质量守恒定律化学方程式练习原卷版docx、专题02质量守恒定律化学方程式练习解析版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
目 录
TOC \ "1-2" \p " " \h \z \u \l "_Tc149830759" 考点过关练 PAGEREF _Tc149830759 \h 2
\l "_Tc149830760" 考点01 质量守恒定律 PAGEREF _Tc149830760 \h 2
\l "_Tc149830761" 考点02 化学方程式 PAGEREF _Tc149830761 \h 4
\l "_Tc149830762" 考点03 根据化学方程式的计算 PAGEREF _Tc149830762 \h 7
\l "_Tc149830763" 真题实战练 PAGEREF _Tc149830763 \h 9
\l "_Tc149830764" 重难创新练 PAGEREF _Tc149830764 \h 17
考点01 质量守恒定律
1. 超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O===2KOH+
X+O2↑,关于此反应的说法不正确的是( )
A. X的化学式为H2O2 B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化 D.反应前后物质状态发生变化
【答案】B
【解析】
A、根据质量守恒定律,由2KO2+2H2O===2KOH+X+O2↑可知,反应前后钾原子的个数都是2个,反应前氧原子的个数为6个,反应后应该是6个,其中2个包含在X中,反应前氢原子是4个,反应后氢原子是4个,其中2个包含在X中,所以X的化学式为H2O2,所以A正确;
B、反应前后元素种类不发生变化,所以B错误;
C、反应前氧元素在化合物中,化合价不为零,反应后生成了单质的氧气,化合价变为零,所以氧元素的化合价发生了变化,C正确;
D、反应前没有气体,反应后生成了氧气,氧气为气体,所以反应前后物质状态发生变化,D正确。
2. 科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为 CH2O),该反应过程的微观示意图如下。下列说法正确的是( )
A.物质甲为甲醛,其分子由碳原子和水分子构成
B.物质乙中氧元素的化合价为-2 价
C.该反应前后原子种类和数目均发生改变
D.该反应消耗物质甲和生成物质丁的质量比为 5﹕3
【答案】D
【解析】
A、甲醛分子由碳原子、氢原子和氧原子构成,A选项说法错误;
B、物质乙中氧元素的化合价为0 价,B选项说法错误;
C、根据质量守恒定律可知,反应前后原子的种类和数目均未发生改变,C选项说法错误;
D、该反应消耗物质甲和生成物质丁的质量比(12+1×2+16):(1×2+16)=5:3,D正确。
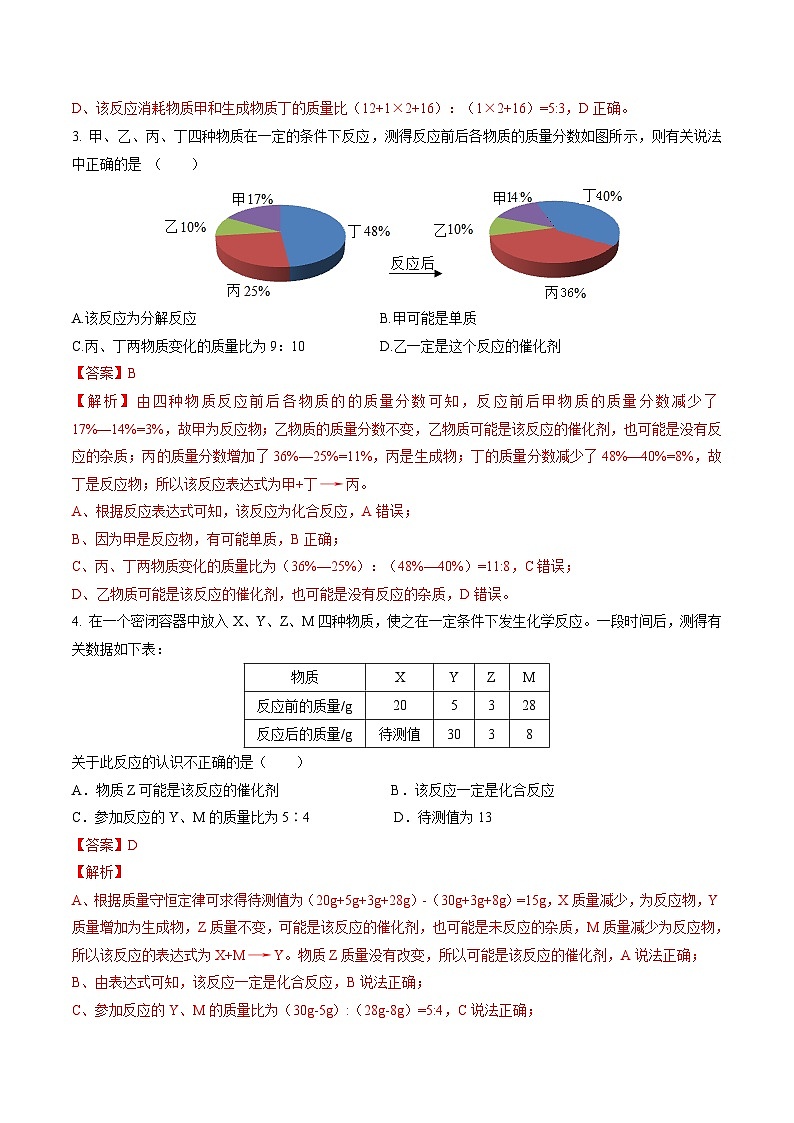
3. 甲、乙、丙、丁四种物质在一定的条件下反应,测得反应前后各物质的质量分数如图所示,则有关说法中正确的是 ( )
A.该反应为分解反应B.甲可能是单质
C.丙、丁两物质变化的质量比为9:10D.乙一定是这个反应的催化剂
【答案】B
【解析】由四种物质反应前后各物质的的质量分数可知,反应前后甲物质的质量分数减少了17%—14%=3%,故甲为反应物;乙物质的质量分数不变,乙物质可能是该反应的催化剂,也可能是没有反应的杂质;丙的质量分数增加了36%—25%=11%,丙是生成物;丁的质量分数减少了48%—40%=8%,故丁是反应物;所以该反应表达式为甲+丁→丙。
A、根据反应表达式可知,该反应为化合反应,A错误;
B、因为甲是反应物,有可能单质,B正确;
C、丙、丁两物质变化的质量比为(36%—25%):(48%—40%)=11:8,C错误;
D、乙物质可能是该反应的催化剂,也可能是没有反应的杂质,D错误。
4. 在一个密闭容器中放入X、Y、Z、M四种物质,使之在一定条件下发生化学反应。一段时间后,测得有关数据如下表:
关于此反应的认识不正确的是( )
A.物质Z可能是该反应的催化剂 B.该反应一定是化合反应
C.参加反应的Y、M的质量比为5∶4 D.待测值为13
【答案】D
【解析】
A、根据质量守恒定律可求得待测值为(20g+5g+3g+28g)-(30g+3g+8g)=15g,X质量减少,为反应物,Y质量增加为生成物,Z质量不变,可能是该反应的催化剂,也可能是未反应的杂质,M质量减少为反应物,所以该反应的表达式为X+M→Y。物质Z质量没有改变,所以可能是该反应的催化剂,A说法正确;
B、由表达式可知,该反应一定是化合反应,B说法正确;
C、参加反应的Y、M的质量比为(30g-5g):(28g-8g)=5:4,C说法正确;
D、待测值为(20g+5g+3g+28g)-(30g+3g+8g)=15g,所以D说法错误。
5. 在“宏观一徽观”之间建立联系是化学学科特有的思维方式。下图为二氧化碳用于生产甲醇(CH3OH)的微观示意图,有关说法正确的是( )
A.该反应中,四种物质均为化合物
B.反应前后氢元素的化合价不变
C.参加反应的甲、乙分子个数之比为1:3
D.反应前后氢原子个数之比为1:3
【答案】C
【解析】由反应的微观示意图可知,反应的化学方程式为CO2+3H2eq \\ac(\s\up7(一定条件),\(===,====))CH3OH+H2O。
A、乙为氢气,属于单质,该反应中,甲、丙、丁三种物质均为化合物,故A不正确;
B、反应前氢气中氢元素的化合价为0,反应后水中氢元素的化合价为+1价,则反应前后氢元素的化合价发生变化,故B不正确;
C、反应的化学方程式为CO2+3H2eq \\ac(\s\up7(催化剂),\(===,====))CH3OH+H2O,则参加反应的甲、乙分子个数之比为1:3,故C正确;
D、由质量守恒定律可知,反应前后原子数目不变,则反应前后氢原子个数之比为1:1,故D不正确。故选C。
考点02 化学方程式
6. 下列化学方程式书写正确的是( )
A.Mg+O2eq \\ac(\s\up7(点燃),\(===,====))MgOB.4Fe+3O2eq \\ac(\s\up7(点燃),\(===,====))2Fe2O3
C.2KClO3=2KCl+3O2↑D.S+O2eq \\ac(\s\up7(点燃),\(===,====))SO2
【答案】D
【解析】
A、镁与氧反应生成氧化镁,但是该方程式等号左右氧原子数量不一致,化学方程式未配平,书写错误,不符合题意;
B、铁与氧在点燃的条件下生成的是四氧化三铁(Fe3O4),该方程式生成物错误,书写错误,不符合题意;
C、KClO3需要在催化剂的参与下生成氯化钾和氧气,该反应式缺少催化剂,书写错误,不符合题意;
D、磷与氧在点燃的条件下生成五氧化二磷,书写正确,符合题意。
故选D。
7. 关于化学方程式的意义的说法不正确的是( )
A.表示各物质之间的质量比B.表明了反应的条件
C.表明了反应的速率D.表明化学反应的反应物、生成物
【答案】C
【解析】
A、由化学方程式,可以计算出各反应物和生成物的质量比,可以表明各反应物和各生成物之间的质量比,故A选项说法正确,不符合题意。
B、化学方程式可以表明反应物、生成物和反应条件,“═”左边的是反应物,右边的是生成物,上方的是反应条件,故B选项说法正确,不符合题意。
C、化学方程式不能表明化学反应的快慢,故C选项说法错误,符合题意。
D、化学方程式可以表明反应物、生成物和反应条件,“═”左边的是反应物,右边的是生成物,上方的是反应条件,故D选项说法正确,不符合题意。故选C。
8. 化学方程式2Mg+O2eq \\ac(\s\up7(点燃),\(====,=====))2MgO可读作( )
A.镁加氧气等于氧化镁 B.2个镁加1个氧气等于2个氯化镁
C.镁和氧气在点燃条件下生成氧化镁D.镁加氧气点燃等于氧化镁
【答案】C
【解析】根据反应方程式可以看出,镁与氧气在点燃条件下生成氧化镁,所以正确选择为C;
故选:C。
9. 下列有关叙述对应的化学方程式都正确的是( )
A.镁在空气中燃烧:Mg+O2eq \\ac(\s\up7(点燃),\(===,====))MgO2
B.过氧化氢分解:H2O2═H2↑+O2↑
C.铁在氧气中燃烧:Fe+O2═Fe2O3
D.铝具有很好的抗腐蚀性:4Al+3O2═2Al2O3
【答案】D
【解析】
A. 镁在空气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2eq \\ac(\s\up7(点燃),\(===,====))2MgO,此选项错误;
B. 过氧化氢发生分解反应生成水、氧气,反应的化学方程式为:2H2O2═2H2O+O2↑,此选项错误;
C. 铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2eq \\ac(\s\up7(点燃),\(===,====))Fe3O4,此选项错误;
D. 铝具有很好的抗腐蚀性,常温下与空气中的氧气反应生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,反应的化学方程式为:4Al+3O2═2Al2O3,此选项正确。故选D。
10. 下列说法正确的是( )
A.符号↑:表示在生成物中有气体产生 B.配平时可以改动化学式右下角表示的小数字
C.符号△:表示点燃D.化学方程式中的等号表示反应物与生成物的分子数相等
【答案】A
【解析】
A、符号↑:表示在生成物中有气体产生,说法正确;
B、配平时,需要在化学式前面添加适当的系数,决不能改动化学式,说法错误;
C、“△”表示加热,说法错误;
D、“═”表示生成,反应前后分子的个数之间有可能相等,也有可能不相等,说法错误。故选A。
11. 配平下列反应的化学方程式:
(1) NH3+ Cl2= N2+ HCl
(2) C2H2+ O2= CO2+ H2O
(3) Fe2O3+ CO= Fe+ CO2
(4) C2H6O+ O2= CO2+ H2O
【答案】
(1) 2 3 1 6 (2) 2 5 4 2
(3) 1 3 2 3 (4) 1 3 2 3
【解析】
(1)运用定1法,将氨气的化学计量数点为1,则氮气到的化学计量数为1/2,氯化氢的化学计量数为3,氯气的化学计量数为3/2,将各物质化学计量数去分母转化为整数,则四种物质的化学计量数依次为2、3、1、6,故填2、3、1、6。
(2)运用定1法,将乙炔的化学计量数点为1,则二氧化碳到的化学计量数为2,水的化学计量数为1,氧气的化学计量数为5/2,将各物质化学计量数去分母转化为整数,则四种物质的化学计量数依次为2、5、4、2,故填2、5、4、2。
(3)运用定1法,将氧化铁的化学计量数点为1,则一氧化碳的化学计量数为3,铁到的化学计量数为2,二氧化碳的化学计量数为3,即四种物质的化学计量数依次为1、3、2、3,故填1、3、2、3。
(4)运用定1法,将C2H6O的化学计量数点为1,则二氧化碳到的化学计量数为2,水的化学计量数为3,氧气的化学计量数为3,即四种物质的化学计量数依次为1、3、2、3,故填1、3、2、3。
考点03 根据化学方程式的计算
12.我国核工业技术世界领先,现已出口到西方发达国家。极硬的陶瓷材料碳化硼(B4C)可用作核反应堆的中子吸收剂,还可用于制造坦克装甲、防弹背心等。在电弧炉中用C与B2O3反应制得B4C,反应的化学方程式为2B2O3+7C eq \\ac(\s\up7(电弧),\(===,====)) B4C+6CO↑。按此反应,当消耗70千克B2O3时,可制得B4C多少千克?
【答案】解:设可制得B4C的质量为x
2B2O3+7C eq \\ac(\s\up7(电弧),\(===,====)) B4C+6CO↑
140 56
70kg x
eq \f(140,56)=eq \f(70kg,x)
x=28kg
答:可制得B4C28千克。
【解析】化学反应方程式计算中物质相对分子质量之比等于实际质量之比。
13.在实验室制取氧气时,取MnO2和KClO3的固体混合物30.5g,加热至不再产生气体为止,收集到一定质量的氧气。某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出。加水的质量与剩余固体的质量见下表:(提示:MnO2是不溶于水的固体粉末)
试求:
(1)原混合物中MnO2的质量为 g。
(2)制得氧气的质量为多少克?
【答案】(1)6;(2)可制得氧气9.6克。
【解析】(1)由1和2可知加入20g水最多溶解KCl的质量为:14.5g﹣8.1=6.4gKCl,而第三、第四次加水后溶解KCl的质量为8.1g﹣6g=2.1g<6.4g,则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2,所以原混合物中MnO2的质量为6g;
(2)原混合物中KClO3质量为:30.5g﹣6g=24.5g;
(3)设可制得氧气的质量为x
2KClO3eq \\ac(\s\up6(MnO2),\s\up1(───),\s\d1(───),\s\d6(△)) 2KCl+3O2↑
245 96
24.5g x
eq \f(245, 96)= eq \f(24.5g,x)
解得:x=9.6g
故答案为:(1)6;(2)可制得氧气9.6克。
14.某同学取一定质量的氯酸钾和二氧化锰加热,记录产生氧气的质量与反应时间的关系如图所示,请计算混合物中氯酸钾的质量。
【答案】12.25g
【解析】由图象情况可知氯酸钾完全反应生成的氧气质量是4.8g
设原混合物中氯酸钾的质量为x
2KClO3eq \\ac(\s\up6(MnO2),\s\up1(───),\s\d1(───),\s\d6(△))2KCl+3O2↑
245 96
x 4.8g
eq \f(245, 96)= eq \f(x,4.8g)
x=12.25g
答:原混合物中氯酸钾的质量为12.25g。
15.根据Fe3O4+4COeq \\ac(\s\up7(高温),\(===,====))3Fe+4CO2反应原理,工业上可用来冶炼铁。现用100t含四氧化三铁为46.4%的某铁矿石冶炼金属铁。请完成下列问题,写出必要的计算过程。
(1)该铁矿石中含四氧化三铁质量是多少?
(2)理论上可炼出含铁96%的生铁的质量是多少?
【答案】(1)解:根据题意100t铁矿石中含四氧化三铁质量:100t×46.4%=46.4t
答:该铁矿石中含四氧化三铁质量是46.4t。
(2)解:设46.4t四氧化三铁完全反应生成纯铁的质量为 x。
Fe3O4+4COeq \\ac(\s\up7(高温),\(===,====))3Fe+4CO2
232 168
46.4t x
eq \f(232, 168)= eq \f(464.t, x)
x=33.6t。
理论上可炼出含铁96%的生铁的质量:33.6t÷96%=35t。
答:理论上可炼出含铁96%的生铁的质量:35t。
1.(2022·广西中考)下列关于化学反应的说法,错误的是( )
A.化学反应前后,分子种类发生改变,原子种类不变
B.化学反应前后,分子数目发生改变,原子数目不变
C.化学反应前后,物质种类发生改变,元素种类不变
D.化学反应的过程就是参加反应的各物质的原子重新组合生成其他物质的过程
【答案】B
【解析】
A、化学反应前后由于有新物质生成,故构成物质的分子种类一定改变,在化学变化中原子是最小微粒,故原子的种类、质量、数目均保持不变,说法正确,不符合题意;
B、化学反应前后,分子数目不一定改变,例如C+H2Oeq \\ac(\s\up7(高温),\(===,====))CO+H2,反应前后都是2个分子,数目不变,说法错误,符合题意;
C、化学反应前后由于有新物质生成,故物质种类一定发生改变,但新物质还是由原物质的元素构成,故元素种类不变,说法正确,不符合题意;
D、化学反应前后,是分子裂变成原子,原子重新聚合形成新分子的过程,故化学反应的过程就是参加反应的各物质的原子重新组合生成其他物质的过程,说法正确,不符合题意。
故选B。
2.(2022·山东菏泽中考)设计实验方案,分析实验现象,得出实验结论是化学学科的重要思维方式。下列实验方案的设计能达到实验目的的是( )
A.B.C.D.
A.探究红磷和白磷燃烧需要氧气
B.测定空气里氧气的含量
C.验证质量守恒定律
D.探究蜡烛中是否含有氢元素
【答案】D
【解析】
A、该实验中铜片上的白磷燃烧,铜片上的红磷不燃烧,说明可燃物燃烧的条件之一是:温度达到可燃物的着火点(白磷的着火点低于红磷的着火点,热水的温度达到白磷的着火点,达不到红磷的着火点),该实验中铜片上的红磷和白磷均与氧气接触,无法探究探究红磷和白磷燃烧需要氧气,故A不能达到实验目的;
B、该实验中使用硫来测定空气中氧气的含量,硫在空气中燃烧生成二氧化硫气体,虽然除去了空气中的氧气,但是生成了二氧化硫气体,没有形成压强差,不能用来测定空气里氧气的含量,故B不能达到实验目的;
C、质量守恒定律是指参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,所以质量守恒定律只研究化学变化中的质量守恒,而该实验中硝酸钾溶液与水、银离子、硝酸根离子均不反应,没有发生化学变化,所以不能用来验证质量守恒定律,故C不能达到实验目的;
D、该实验过程中,干冷的烧杯内壁出现水珠,说明蜡烛燃烧生成了水,反应物氧气中只含有氧元素,进一步说明蜡烛中含有氢元素,故D能达到实验目的;
故选D。
3.(2023·江苏省扬州市中考)Y是生活中常见的物质,完全燃烧的化学方程式为Y+3O2eq \\ac(\s\up7(点燃),\(===,====))2CO2+3H2O。Y的化学式为( )
A.CH4OB.C2H4C.C3H8D.C2H6O
【答案】D
【解析】化学方程式左边:氧原子个数6个;右边:碳原子个数2个,氧原子个数7个,氢原子个数6个。所以Y中应含有碳原子个数2个,氧原子个数1个,氢原子个数6个。所以Y的化学式为C2H6O。
故选D。
4.(2023·湖南省邵阳市中考)在汽油中加入适量乙醇作为汽车燃料,可节省石油资源,并在一定程度上减少汽车尾气污染。乙醇在空气中充分燃烧的化学方程式为C2H5OH+3O2eq \\ac(\s\up7(点燃),\(===,====))2CO2+3X,试推测X的化学式是( )
A.B.C.COD.
【答案】B
【解析】由反应的化学方程式可知,反应前有2个碳原子、6个氢原子、7个氧原子,反应后有2个碳原子、4个氧原子,由质量守恒定律可知,反应前后原子的种类和数目不变,3个X分子中含有6个氢原子、3个氧原子,1个X分子中含有2个氢原子、1个氧原子,则X的化学式为:H2O;
故选:B。
5.(2023·山东省滨州市中考)密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列说法正确的是( )
A.物质甲是生成物B.反应后乙物质的质量分数是
C.该化学反应中甲、乙两物质的质量比是D.物质丁一定是该反应的催化剂
【答案】C
【解析】
A、由图可知,反应后,甲的质量减小,甲是反应物,不符合题意;
B、反应后乙物质的质量分数是:1-42%-40%-10%=8%,不符合题意;
C、该化学反应中甲、乙两物质的质量比是:(70%-42%):(14%-8%)=14:3,符合题意;
D、化学反应前后,丁的质量不变,丁可能是催化剂,也可能是不参与反应的杂质,不符合题意。
故选C。
6.(2023·湖南省怀化市中考)一定条件下,下列物质在密闭容器内反应一段时间,测得反应前后各物质的质量关系如下表:
根据上表信息判断,下列说法中不正确的是( )
A.a=10
B.该反应属于置换反应
C.Z为化合物
D.反应中Y、W两种物质发生改变的质量比为22:9
【答案】B
【解析】
A、根据质量守恒定律,化学反应前后,物质的总质量不变,则5g+2.2g+16.2g+0.9g=ag+4.4g+8.1g+1.8g,a=10,不符合题意;
B、反应后,X的质量增加,X是生成物,Y的质量增加,Y是生成物,Z的质量减小,Z是反应物,W的质量增加,W是生成物,该反应符合“一变多”的特点,属于分解反应,符合题意;
C、该反应中,Z是反应物,X、Y、W是生成物,故Z是化合物,不符合题意;
D、反应中Y、W两种物质发生改变的质量比为:(4.4g-2.2g):(1.8g-0.9g)=22:9,不符合题意。
故选B。
7.(2023·湖南省衡阳市中考)在一个密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如图所示。下列说法正确的是( )
A.B.乙一定是催化剂
C.甲可能是单质D.丙和丁的相对分子质量之比一定是9∶8
【答案】A
【分析】由于该反应在密闭容器内进行,根据质量守恒定律,则有20+3+5+3=3+3+x+11,解得x=14,反应前后甲的质量减少20g-3g=17g,故甲是反应物;反应前后乙的质量不变,故乙可能作该反应的催化剂,也可能没有参加反应;反应前后丙的质量增加了14g-5g=9g,故丙是生成物;反应前后丁的质量增加了11g-3g=8g,故丁是生成物;所以该反应为甲分解生成丙和丁。
【解析】
A、由分析可知,x=14,故A说法正确;
B、根据反应前后乙的质量不变,故乙可能作该反应的催化剂,也可能没有参加反应,故B说法错误;
C、由分析可知,该反应为甲分解生成丙和丁,符合一变多的特点,属于分解反应,甲是分解反应中的反应物,所以甲不可能是单质,故C说法错误;
D、由分析可知,生成的丙和丁的质量之比为9g:8g=9:8,若生成的丙和丁的化学计量数之比为1:1,则丙和丁的相对分子质量之比一定是9:8,由于丙和丁的化学计量数不能确定,所以相对分子质量之比也不能确定,故D说法错误;
故选A。
8.(2023·山东枣庄·中考真题)近期,我国科学工作者在淀粉人工合成方面取得突破性进展,最关键步骤是二氧化碳和氢气在无机催化剂(ZnO- ZrO2)的作用下转化为甲醇(CH3OH)和水,反应的微观示意图如下。下列说法不正确的是( )
A.该反应不符合质量守恒定律B.生成的甲醇和水的分子个数比为1:1
C.反应前后催化剂ZnO-ZrO2的化学性质不变 D.该反应能实现由无机物向有机物的转化
【答案】A
【解析】
A. 因为化学反应都遵守质量守恒定律,所以该反应符合质量守恒定律,此选项错误;
B. 根据反应的微观示意图,该反应的化学方程式为:CO2+3H2eq \\ac(\s\up7(ZnO- ZrO2),\(=======,========))CH3OH+H2O,则生成的甲醇和水的分子个数比为1:1,此选项正确;
C. 反应前后催化剂ZnO-ZrO2的质量和化学性质不变,此选项正确;
D. CO2和H2是无机物,CH3OH是有机物,该反应能实现由无机物向有机物的转化,此选项正确。
故选A。
9. (2022·广西梧州中考)下列化学反应方程式与描述相符,且书写完全正确的是( )
A.用稀盐酸除铁锈:FeO+ 2HCl=FeCl2+H2O
B.红磷在氧气中燃烧: P+O2eq \\ac(\s\up7(点燃),\(===,====))P2O5
C.石灰石与二氧化硅高温反应: CaCO3+ SiO2eq \\ac(\s\up7(高温),\(===,====))CaSiO3+ CO2↑
D.工业上用电解法冶炼铝:2Al2O3=4Al+3O2
【答案】C
【解析】
A、用稀盐酸除铁锈是氧化铁与盐酸反应生成氯化铁和水,该反应的化学方程式为Fe2O3+ 6HCl=2FeCl3+3H2O,故A项错误;
B、红磷在空气中燃烧生成五氧化二磷,该反应的化学方程式为4P+5O2eq \\ac(\s\up7(点燃),\(===,====))2P2O5,故B项错误;
C、石灰石与二氧化硅高温反应生成硅酸钙和二氧化碳,该反应的化学方程式为CaCO3+ SiO2eq \\ac(\s\up7(高温),\(===,====))CaSiO3+ CO2↑ ,故C项正确;
D、氧化铝在通电条件下生成铝和氧气,该反应的化学方程式为2Al2O3 eq \\ac(\s\up7(通电),\(===,====))4Al+3O2↑,故D项错误;
故选C。
10.(2023·黑龙江龙东中考真题)煤油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式表示为:X +6O2eq \\ac(\s\up7(点燃),\(===,====))4CO2+SO2+2H2O,则噻吩的化学式为( )
A.C4H4SB.C4H6S
C.CH4D.C4H8S
【答案】A
【解析】反应后生成物中,共有4个碳原子、1个硫原子、12个氧原子、4个氢原子,根据质量守恒定律,反应前物质中原子的种类和数目不变,X+6O2中已有12个氧原子,则1个X分子中含有4个碳原子、1个硫原子、4个氢原子,所以X化学式是C4H4S。故选A。
11.(2023·湖南省益阳市中考)下列对应的化学方程式书写正确的是( )
A.硫在氧气中燃烧:S+O2eq \\ac(\s\up7(点燃),\(===,====))SO3
B.用稀盐酸除去铁锈:Fe2O3+4HCl=2FeCl2+3H2O
C.比较Cu和Ag的活泼性:2Ag + Cu(NO3)2=Cu+ 2AgNO3
D.向呼出的气体样品中滴入澄清石灰水,振荡:CO2+Ca(OH)2=CaCO3↓+H2O
【答案】D
【解析】
A、硫在氧气中燃烧生成二氧化硫,化学方程式为:S+O2eq \\ac(\s\up7(点燃),\(===,====))SO2,书写错误;
B、铁锈的主要成分是氧化铁,氧化铁和稀盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+ 6HCl=2FeCl3+3H2O,书写错误;
C、铜金属性强于银,所以是铜单质和硝酸银溶液反应生成银单质和硝酸铜溶液,化学方程式为:Cu+2AgNO3=2Ag+ Cu(NO3)2,书写错误;
D、二氧化碳和氢氧化钙溶液反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,书写正确。故选D。
12.(2023·山东省潍坊市中考化学真题)某化学反应在密闭容器中进行,各物质的分子数目,质量随时间变化情况如图1,图2所示。下列说法错误的是( )
A.Z一定属于化合物B.参加反应的X与Y的质量比为3:14
C.反应前后分子总数不变D.Y与Z的相对分子质量之比为28:17
【答案】C
【解析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。由图1可知,X和Y是反应物,Z是生成物,由分子个数的变化情况可知,该反应可表示为:3X+Y=2Z。由图2可知,参加反应的Y的质量为72g-44g=28g,生成Z的质量为34g,由质量守恒定律可知:参加反应的X的质量为34g-28g=6g。
A、根据分析可知,由该反应的方程式3X+Y=2Z可知,该反应属于化合反应,因此生成物Z一定是化合物,说法正确;
B、由以上分析可知,参加反应的X与Y的质量比为6g:28g=3:14,说法正确;
C、由该反应的方程式3X+Y=2Z可知,反应前后分子总数改变,说法错误;
D、设Y、Z的相对分子质量分别为m、n,由化学方程式可知,eq \f(m,2n)=eq \f(28g,34g),则eq \f(m, n)=eq \f(28,17g),说法正确。故选:C。
13.(2023·陕西省中考)学习小组同学利用下图实验,回收实验室废弃的铜粉与铁粉混合物中的铜粉。
(1)反应生成氢气的质量是_____g。
(2)计算上述实验回收铜粉的质量。(忽略回收过程中铜粉的损失)
(3)上述实验所用稀硫酸的溶质质量分数_____(填“可能”或“不可能”)是15%。
【答案】
(1)0.4
(2)解:设混合物中铁粉的质量为x,硫酸质量为y
Fe+H2SO4=FeSO4+H2↑
56 98 2
x y 0.4g
eq \f(56,2)=eq \f(x,0.4g) eq \f(98,2)=eq \f(y,0.4g)
解得:x=11.2g y=19.6g
该混合物中铜粉的质量为30g-11.2g=18.8g
答:上述实验回收铜粉的质量为18.8g。
(3)不可能
【解析】(1)由质量守恒定律可知,反应生成氢气的质量=30g+100g-129.6g=0.4g。
(2)见答案。
(3)硫酸的质量为19.6g,所以所用的稀硫酸的溶质质量分数=eq \f(19.6g,100g)×100%=19.6%,所以不可能是15%。
14.(2023·湖南省永州市中考)某化学兴趣小组通过实验测定石灰石中CaCO3的含量(假定石灰石中只含有CaCO3以及不与稀盐酸反应的杂质)。将50g石灰石加入到过量的稀盐酸中,产生的CO2气体通入到足量的NaOH溶液中,测量NaOH溶液增加的质量变化如下图。
请回答下列问题:
(1)从上图中可以看出,50g石灰石与过量稀盐酸完全反应后生成CO2气体的质量为______g(假定CO2全部被NaOH溶液吸收)。
(2)计算石灰石中CaCO3的质量分数(写出详细的计算过程)。
(3)有同学认为反应的时间t2=2t1,请分析,该结论______(填“正确”或“不正确”)。
【答案】(1)17.6
(2)解:设石灰石中CaCO3的质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
50g×x 17.6g
eq \f(100,44)=eq \f(50g×x,17.6g)
x=80%
答:石灰石中CaCO3的质量分数为80%。
(3)不正确
【解析】(1)从图中可看出,氢氧化钠溶液增加的质量为17.6g,即为生成的二氧化碳的质量;
(2)过程见答案;
(3)碳酸钙和盐酸的反应速率受盐酸浓度的影响,随着反应的进行,盐酸的浓度减少,则反应速率减慢,所以t2>2t1,结论不正确。
15.(2023·湖北恩施州中考化学真题)为测定某瓶稀盐酸的溶质质量分数,取4.0g石灰石样品于烧杯中,将该稀盐酸40.0g分4次加入烧杯中,充分反应后经过滤、洗涤、干燥、称重,得实验数据如下:
已知:石灰石样品中的杂质既不与盐酸反应,也不溶于水。请计算:
(1)4.0g石灰石中碳酸钙的质量是 g。
(2)求该瓶稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
【答案】(1)3.4
(2)解:通过数据比较可知:10.0g稀盐酸完全反应可以消耗碳酸钙的质量为1.0g,
设10.0g稀盐酸中溶质质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1.0g x
eq \f(100,73)=eq \f(1.0g,x)
x=0.73g
则该瓶稀盐酸的溶质质量分数为:eq \f(0.73g,10.0g)×100%=7.3%,
答:该瓶稀盐酸的溶质质量分数为7.3%。
【解析】(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,杂质不与稀盐酸反应,由表格数据分析可知,第一次加入的10.0g稀盐酸能与4.0g-3.0g=1.0g碳酸钙完全反应;第二次加入的10.0g稀盐酸能与3.0g-2.0g=1.0g碳酸钙完全反应;第三次加入的10.0g稀盐酸能与2.0g-1.0g=1.0g碳酸钙完全反应;第四次加入的10.0g稀盐酸只能与1.0g-0.6g=0.4g碳酸钙反应,说明此时碳酸钙已经完全反应,最终剩余的0.6g为石灰石样品中的杂质,故4.0g石灰石中碳酸钙的质量是4.0g-0.6g=3.4g;
(2)见答案。
1. 某化合物6g在氧气中完全燃烧后,生成17.6g二氧化碳和10.8g水。下列关于该化合物的说法不正确的是( )
A.该化合物中一定含有C、H元素,一定不会O元素
B.该反应中氧气和二氧化碳的质量比为14:1 1
C.该反应中氧气和水的分子个数比为7:6
D.该化合物中C、H原子的个数比为1:4
【答案】D
【解析】 某化合物6g在氧气中完全燃烧后,生成17.6g二氧化碳和10.8g水。,二氧化碳中碳元素质量即为化合物中碳元素质量,为17.6g×eq \f(12,44)×100%=1.6g QUOTE 17.6g×1244=4.8g ,水中氢元素质量即为化合物中氢元素质量,为10.8g×eq \f(2,18)×100%=1.6g QUOTE 10.8g×218=1.2g ,4.8+1.2=6,说明化合物中不含氧元素;A.化合物中只含碳和氢元素,不符合题意;
B. 该反应中氧气和二氧化碳的质量比为(17.6g+10.8g-6g):17.6g=14:1 1 ,不符合题意;
C. 该反应中氧气和水的分子个数比为eq \f(17.6g+10.8g-6g,32):eq \f(10.8, 16)=7:6 QUOTE 17.6g+10.8g−6g32:10.818=7:6 ,不符合题意;
D. 该化合物中C、H原子的个数比为eq \f(4.8,12):eq \f(1.2, 1)=1:3 QUOTE 4.812:1.21=1:3 ,符合题意;
故答案为:D
2. 实验室有一包含杂质的碳酸氢钠样品100g(杂质不含钠元素,受热不变化),其中钠元素质量分数为23%,180℃时,将样品加热一段时间后称得固体质量为87.6g,则分解的碳酸氢钠占原碳酸氢钠的质量分数为( )(2NaHCO3=Na2CO3 + H2O + CO2↑)
A.33.6% B.40%
C.47.3% D.60%
【答案】B
【解析】设样品中碳酸氢钠的质量分数是x,则100g×x×eq \f(23,84)=100g×23%,解得x=84%
样品中碳酸氢钠的质量为:100g×84%=84g
设分解的碳酸氢钠的质量是y
2NaHCO3eq \\ac(\s\up6(△),\(==,===))Na2CO3 + H2O + CO2↑ △m
168 106 62
y 100g-87.6g=12.4g
eq \f(168,62)=eq \f(y, 12.4g)
解得y=33.6g
分解的碳酸氢钠占原碳酸氢钠的质量分数为: eq \f(33.6g,84g)×100%=40%,
故答案为:B。
【分析】一、先利用样品中钠元素的质量分数为23%,则可以计算样品中钠元素的质量和碳酸氢钠的质量。
二、加热样品加减少的质量即为碳酸氢钠分解生成的水和二氧化碳的质量,利用碳酸氢钠分解的方程式根据差量法则可以计算已分解的碳酸氢钠的质量,则可以计算已经分解的碳酸氢钠占原碳酸氢钠的质量分数。
3. 已知2CO2+2Na2O2=2Na2CO3+O2。在密闭容器中,将6. 6g CO2与一定量的Na2O2固体充分反应后,气体变为3.8 g。下列说法正确的是( )
A.3.8 g气体全部是O2
B.反应后的固体是混合物
C.生成Na2CO3的质量为15. 9 g
D.3.8g气体通过足量NaOH溶液后,气体减少2.2 g
【答案】D
【解析】由方程式可知,气体减少是因为二氧化碳变成氧气,设反应的二氧化碳质量为x,生成氧气质量为y,生成碳本钠质量为n
2CO2+2Na2O2=2Na2CO3+O2 气体减少质量
88 212 32 88-32=56
x m y 6.6g-3.8g=2.8g
88:56=x:2.8g 212:56=m:2.8g 32:56=y:2.8g
x=4.4g m=10.6g y=1.6g
气体中含有二氧化碳和氧气,不符合题意;
B.由上述分析可知,二氧化碳没有完全反应,所以Na2O2固体全部反应,反应后的固体为纯净物,不符合题意;
C. 由前面计算可知生成Na2CO3的质量为10.6 g ,不符合题意;
D. 3.8g气体中含有二氧化碳2.2g,通过足量NaOH溶液后,二氧化碳发生反应,气体减少2.2g,符合题意;
故答案为:D
4. 氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙.
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O= Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置:
请回答:
①装置A中发生反应的化学方程式为 ;为了实验安全,点燃C装置酒精灯前应先 ;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的 (选填:①或②)装置;
③图1装置D中浓硫酸的作用是 ;
(2)【进行实验)过程略
【验证产物】略
【实验拓展】定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数.
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在 时进行收集(填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是 ;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为 ;(结果精确到0.1%)
(4)【反思与交流】
登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是 。
【答案】
(1)Zn+H2SO4═ZnSO4+H2↑;在E导管口收集氢气进行验纯或先通一会儿氢气;②;防止空气中的水蒸汽进入C中
(2)若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙(其他合理答案同样给分)
(3)a;因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;66.3%
(4)等质量的钙和CaH2与水完全反应,CaH2产生的氢气多
【解析】解:(1)①装置A中,是锌粒与稀硫酸反应生成硫酸锌和氢气.对应的化学方程式为 Zn+H2SO4═ZnSO4+H2↑;由于氢气具有可燃性,为防止使用过程因为装置内有空气(氧气)而导致氢气爆炸,所以在点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;②上图1装置B中装有无水氯化钙,其作用是干燥H2,检验水蒸气应该使用无水硫酸铜,所以若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的 ②装置;③图1装置D中浓硫酸的作用是 防止空气中的水蒸汽进入C中;
【实验拓展】(2)由于“钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水“,所以 鉴定钙或者碳化钙,可以借助点燃固体检验对应物质是否含水,所以有如下的实验:
;(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数.①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,由于生成的气体占有体积,所以从开始就应该收集,而不是强调达到一定纯度才可以收集,所以选:a.②按图3实验装置进行测定时,由于滴入的液体是有体积的,滴入后导致右侧的体积变大,同时无论是钙还是氢化钙和水反应都有热量放出,导致气体体积膨胀,都会影响结果,所以,即使气密性良好,操作正确,测得的气体体积还是偏大.③反应前读取量气管中液面所示刻度为10.0mL,反应后读取量气管中液面所示刻度为98.9mL,则生成的氢气的体积为99.9mL﹣10.0mL=88.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.则生成的氢气的质量为88.9mL×0.09mg/mL≈8mg.
设氢化钙的质量为x,则钙的质量为100mg﹣x.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
100mg﹣x eq \f(100mg﹣x,20)
CaH2+2H2O= Ca(OH)2+2H2↑;
42 4
x eq \f(4,42)x
eq \f(100mg﹣x,20) + eq \f(4,42)x=8mg
x≈66.3mg
样品中氢化钙的质量分数为eq \f(66.3mg,100mg)×100%=66.3%;
【反思与交流】(4)设钙和CaH2的质量均为ag.钙对应的氢气的质量为x,氢化钙对应的氢气为y.
Ca+2H2O=Ca(OH)2+H2↑;
40 2
ag x
eq \f(40,2)=eq \f(ag,x) x=eq \f(ag,20)
CaH2+2H2O= Ca(OH)2+2H2↑;
42 4
ag y
eq \f(42,4)=eq \f(ag,y) x=eq \f(2ag,21)
可见x<y
即:等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
故答案为:(1)①Zn+H2SO4═ZnSO4+H2↑;在E导管口收集氢气进行验纯或先通一会儿氢气;②②;③防止空气中的水蒸汽进入C中;(2)若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙(其他合理答案同样给分);(3)①a;②因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;③66.3%;(4)等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
【分析】根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
5. 草酸钙晶体(CaC2O4·H2O,相对分子质量为146)在植物体内具有多种生理功能。某化学小组利用热分析仪对14.6g草酸钙品体进行热分解,获得相关数据,绘制成如下图所示的固体质量一温度的关系曲线。
(1)草酸钙晶体由 种元素组成。
(2)温度为t1℃时,晶体全部失去结晶水,14.6g草酸钙晶体中结晶水的质量为 g。
(3)加热至t2℃时,CaC2O4开始分解,生成CaCO3与一种有毒气体,该气体的名称是 。(4)加热至t4℃时,CaCO3开始分解,计算图中x的值。(写出计算过程)
(5)温度在t0~t1之间时,剩余固体的成分为 。
【答案】
(1)四
(2)1.8g
(3)一氧化碳
(4)解:设生成的氧化钙的质量为x。
CaCO3eq \\ac(\s\up7(高温),\(===,====))CaO+CO2↑
100 56
10.0g x
eq \f(100,56)=eq \f(10.0g,x)
x =5.6g
(5)CaC2O4·H2O、CaC2O4
【解析】(1)根据草酸钙晶体的化学式CaC2O4·H2O可知,草酸钙是由钙、碳、氧、氢四种元素组成;
(2)由图像可看出,t1℃时,晶体全部失去结晶水,所得固体质量为12.8g,所以14.6g草酸钙晶体中结晶水的质量为14.6g-12.8g=1.8g;
(3)根据质量守恒定律可得,CaC2O4eq \\ac(\s\up7(高温),\(===,====))CaCO3+CO↑ ,生成了一氧化碳;
(4)碳酸钙全部分解生成氧化钙,x为生成的氧化钙的质量;从图像上可看出,碳酸钙的质量为10.0g,列化学方程式,利用碳酸钙的质量计算氧化钙的质量,过程见答案;
(5)温度在t0~t1之间时,有一部分草酸钙晶体失去结晶水,所以剩余固体的成分为CaC2O4·H2O、CaC2O4。
物质
X
Y
Z
M
反应前的质量/g
20
5
3
28
反应后的质量/g
待测值
30
3
8
编号
1
2
3
4
加水的质量(g)
20
20
20
20
剩余固体的质量(g)
14.5
8.1
6
6
物质
X
Y
Z
W
反应前质量/g
5
2.2
16.2
0.9
反应后质量/g
a
4.4
8.1
1.8
第一次
第二次
第三次
第四次
加入稀盐酸的质量/g
10.0
10.0
10.0
10.0
剩余固体的质量/g
3.0
2.0
1.0
0.6
实验步骤
预期现象和结论
取少量固体样品,在干燥条件下与氧气反应,将
其产物通入装有无水硫酸铜的干燥管;
实验步骤
预期现象和结论
取少量固体样品,在干燥条件下与氧气反应,将
其产物通入装有无水硫酸铜的干燥管;
若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙
相关试卷
这是一份专题07+常见的酸和碱(练习)-2024年中考化学一轮复习讲练测(全国通用),文件包含专题07常见的酸和碱练习-2024年中考化学一轮复习讲练测全国通用原卷版docx、专题07常见的酸和碱练习-2024年中考化学一轮复习讲练测全国通用解析版docx等2份试卷配套教学资源,其中试卷共79页, 欢迎下载使用。
这是一份专题05+水和溶液(练习)-2024年中考化学一轮复习讲练测(全国通用),文件包含专题05水和溶液练习-2024年中考化学一轮复习讲练测全国通用原卷版docx、专题05水和溶液练习-2024年中考化学一轮复习讲练测全国通用解析版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
这是一份专题03+空气++氧气(练习)-2024年中考化学一轮复习讲练测(全国通用),文件包含专题03空气氧气练习原卷版docx、专题03空气氧气练习解析版docx等2份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。








