

海南省农垦中学2023-2024学年高二上学期期末考试化学试题(A卷)
展开
这是一份海南省农垦中学2023-2024学年高二上学期期末考试化学试题(A卷),共6页。试卷主要包含了下列说法正确的是,3 kJ·ml-1,在298 K、1等内容,欢迎下载使用。
可能用到的相对原子质量:N 14 H 1
选择题(共14题,每题3分,共42分。下列每题只有一个选项符合题意)
1.下列反应的热效应形式与其他三项不相同的是( )
A.铝粉与氧化铁反应
B.氯化铵晶体与Ba(OH)2·8H2O反应
C.锌片与稀硫酸反应
D.钠与冷水反应
2.下列各组离子,在指定的环境中能够大量共存的是( )
3.下列说法正确的是( )
A.5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH0
C.电解精炼铜过程中,电路中每通过1 ml电子,阳极溶解铜32 g
D.0.1 ml·L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSOeq \\al(-,3))
4.下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 ml H—Cl键放出的能量
B.石墨转变成金刚石吸收的能量
C.1 ml O2形成2 ml O原子吸收的能量
D.水蒸气变成液态水放出的能量
5.已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 ml·L-1;eq \f(1,2)H2SO4(浓)+NaOH(aq)===eq \f(1,2)Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子数
B.ΔH1>ΔH2
C.ΔH2=-57.3 kJ·ml-1
D.|ΔH1|>|ΔH2|
6.下列反应既是氧化还原反应,又是吸热反应的是 ( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
7.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有COeq \\al(2-,3)和OH-
B.NaHCO3溶液中:c(HCOeq \\al(-,3))+c(H2CO3)+2c(COeq \\al(2-,3))=c(Na+)
C.相同温度下,10 mL 0.1 ml·L-1的醋酸与100 mL 0.01 ml·L-1的醋酸中H+的物质的量不相等
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH的物质的量相同
8.在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 ml·L-1 NaOH溶液中充分反应,测得反应放出a kJ的热量。已知在该条件下,1 ml CO2通入1 L 2 ml·L-1 NaOH溶液中充分反应放出b kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2b-a)kJ·ml-1
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2a-b)kJ·ml-1
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4a-b)kJ·ml-1
D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8a-2b)kJ·ml-1
9.“中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应则生成1ml H2O,这时的反应热叫做中和热。以下关于中和热的叙述正确的是 ( )
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.在稀溶液中HCl和NaOH反应和HNO3和KOH的中和热都相等
C.在稀溶液中1ml酸和1ml碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1ml水时,产生的热量即为中和热
10.下列事实对应的离子方程式或电极反应式书写正确的是( )
A.用石墨作电极电解CuSO4溶液:2Cu2++2H2Oeq \(=====,\s\up7(通电))2Cu+O2↑+4H+
B.碳酸钠溶液显碱性:COeq \\al(2-,3)+2H2OH2CO3+2OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-===Fe3+
D.在强碱溶液中与NaClO反应生成Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeOeq \\al(2-,4)+3Cl-+H2O+4H+
11.下列说法正确的是( )
A.ΔH0的反应在温度低时不能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·ml-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
12.已知在一容器中发生反应:Fe+Cu2+eq \(=====,\s\up7( ))Fe2++Cu,有关说法正确的是( )
A.可能为电解池反应,Fe做阴极,CuSO4溶液做电解液
B.可能为原电池反应,负极Fe被还原为Fe2+
C.可能为电解池反应,阳极反应:Fe-2e-eq \(=====,\s\up7( ))Fe2+
D.可能为原电池反应,Fe做负极,Zn做正极,CuSO4溶液为电解液
13.常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
下列判断正确的是( )
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5 ml·L-1
C.c1=0.2
D.丁组混合液中:c(Na+)>c(A-)>c(H+)>c(OH-)
14.以下自发反应可用能量判据来解释的是( )
A.硝酸铵自发地溶于水
B.2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ·ml—1
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H=+74.9kJ·ml—1
D.2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ·ml—1
非选择题(共58分)
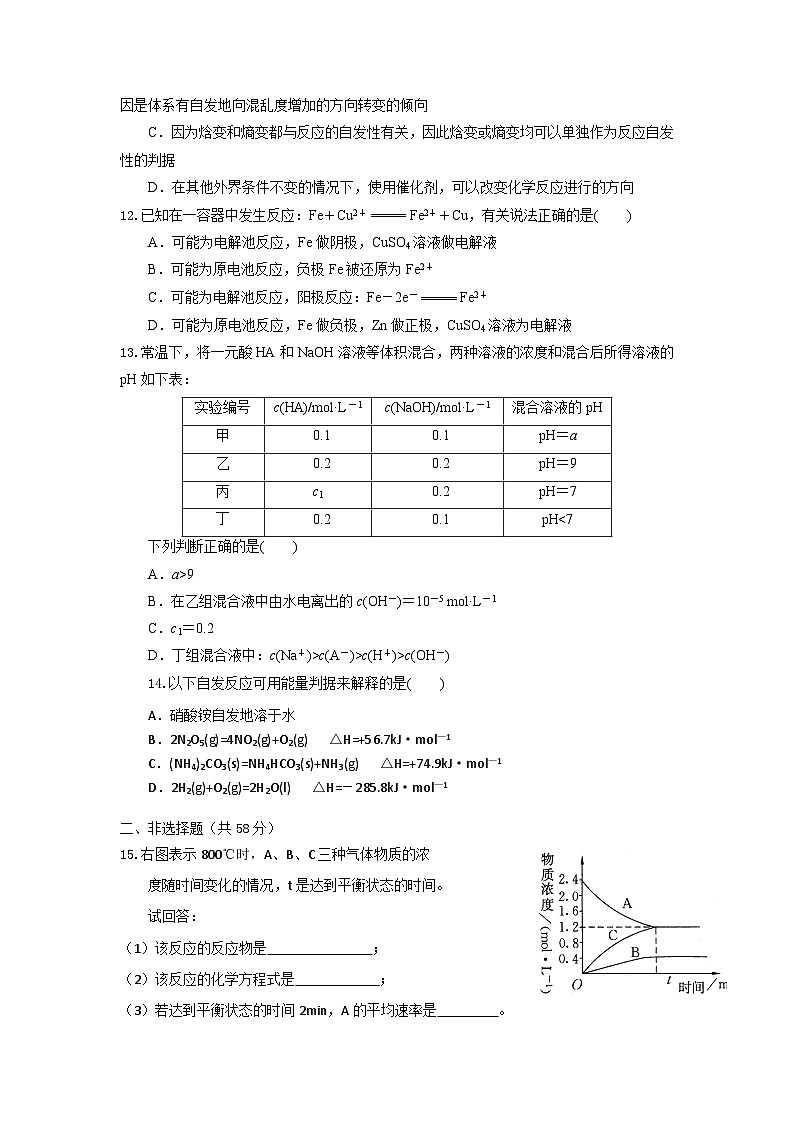
15.右图表示800℃时,A、B、C三种气体物质的浓
度随时间变化的情况,t是达到平衡状态的时间。
试回答:
(1)该反应的反应物是;
(2)该反应的化学方程式是 ;
(3)若达到平衡状态的时间2min,A的平均速率是 。
16.(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
这个电池负极发生的反应是: C4H10+13O2--26e- =4CO2+5H2O,正极发生的反应是: ;汽油燃料电池最大的障碍是氧化反应不完全产生 (填化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
某温度下0.1ml/L Na2CO3溶液中,C(Na+)/C(CO32—)==20/9>2,其原因是(用离子方程式说明):- ,常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5 的Al2(SO4)3溶液中由水电离出的H+ 浓度为c2,则 = ;
恒温、恒压下,在一个可变容积的容器中发生如下反应: A(g) + B (g) C (g) ;
①若开始时放入1 ml A 和 1 ml B ,到达平衡后,生成 a ml C ,这时 A 的物质的量为__________ml ;
②若开始时放入 X ml A 、2ml B 和 1 ml C ,到达平衡后,A 和 C 的物质的量分别是 Y ml 和 3a ml ,则 X=__________,Y=______________。
17.已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是.
①
NH4++H2O NH3·H2O+H+……②
H++OH-===H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是.
Mg(OH)2(固) Mg2++2OH-……①
NH4++OH- NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是___________(填写编号);
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_________________________________;
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_________________。
18.草酸晶体的组成可表示为H2C2O4·xH2O,现做如下实验,请回答相关问题。
①称取6.3 g纯草酸晶体,将其配制成100.0 mL水溶液为待测溶液
②取25.0 mL待测溶液放入锥形瓶中,再加入适量的稀硫酸
③用浓度为0.4 ml/L的KMnO4标准溶液进行滴定,滴定时发生的反应为:
2KMnO4+5H2C2O4+3H2SO4===K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,将KMnO4标准溶液装在________(填“酸式”或“碱式”)滴定管中;
(2)若所用的KMnO4溶液因久置而导致浓度变小,则测得的x值会________(填“偏大”“偏小”或“无影响”)/;
(3)判断达到滴定终点的现象是_______________________________________________,
此时用去12.50 mL KMnO4溶液,则x=________。
19.现将0.04 ml·L-1的某酸(A)溶液和0.02 ml·L-1 NaOH溶液等体积混合得混合溶液Q。
(1)若A为CH3COOH,Q呈酸性,溶液中所有离子按浓度由大到小排列的顺序是________;若A为HCl,100℃时(KW=10-12),溶液中由水电离出的H+浓度为________ml·L-1;若A为H2S,Q接近中性,则HS-的电离能力________水解能力(填“>”、“
相关试卷
这是一份96,海南省农垦中学2023-2024学年高一上学期期末考试化学试题(非重点班),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份海南省嘉积高级中学2023-2024学年高三上学期期末考试化学试题A卷(含答案),共11页。试卷主要包含了非选择题等内容,欢迎下载使用。
这是一份海南省嘉积高级中学2023-2024学年高二上学期期末考试化学试题B卷(含答案),共10页。试卷主要包含了非选择题等内容,欢迎下载使用。









