

四川省泸县第一中学2022-2023学年高二下学期开学考试化学试卷(含答案)
展开
这是一份四川省泸县第一中学2022-2023学年高二下学期开学考试化学试卷(含答案),共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.生活是化学的源泉。下列叙述错误的是( )
A.浓度为75%的酒精、含氯消毒剂、双氧水有效灭活新型冠状病毒原理相同
B.汽油不易溶解于水是因为水分子的极性和汽油分子的极性不同
C.许多食品包装盒里用小袋包装的铁粉来防止食品变潮
D.节日里燃放的焰火与电子的跃迁有关
2.下列离子方程式属于盐的水解,且书写正确的是( )
A.溶液:
B.碳酸氢钠和氯化铵溶液:
C.溶液:
D.溶于中:
3.下列说法正确且能用勒夏特列原理解释的是( )
A.由、和组成的平衡体系加压后颜色变深
B.向平衡体系中加入少量固体,平衡逆向移动,溶液颜色变浅
C.饱和食盐水既可除去氯气中的氯化氢气体,又可以减小氯气的溶解度
D.向溶液中滴加浓硫酸能使溶液颜色由橙色变为黄色
4.一定温度下,某弱酸的电离平衡为:,向该溶液加水稀释,下列表达式的数值变小的是( )
A.B.
C.D.
5.某温度下,反应在密闭容器中达到平衡。下列说法正确的是( )
A.增大压强,正反应速率增大,逆反应速率减小,平衡正向移动。
B.加入催化剂,平衡时的浓度增大
C.恒容下,充入一定量的,平衡向正反应方向移动,平衡常数增大
D.恒容下,充入一定量的,的平衡转化率减小
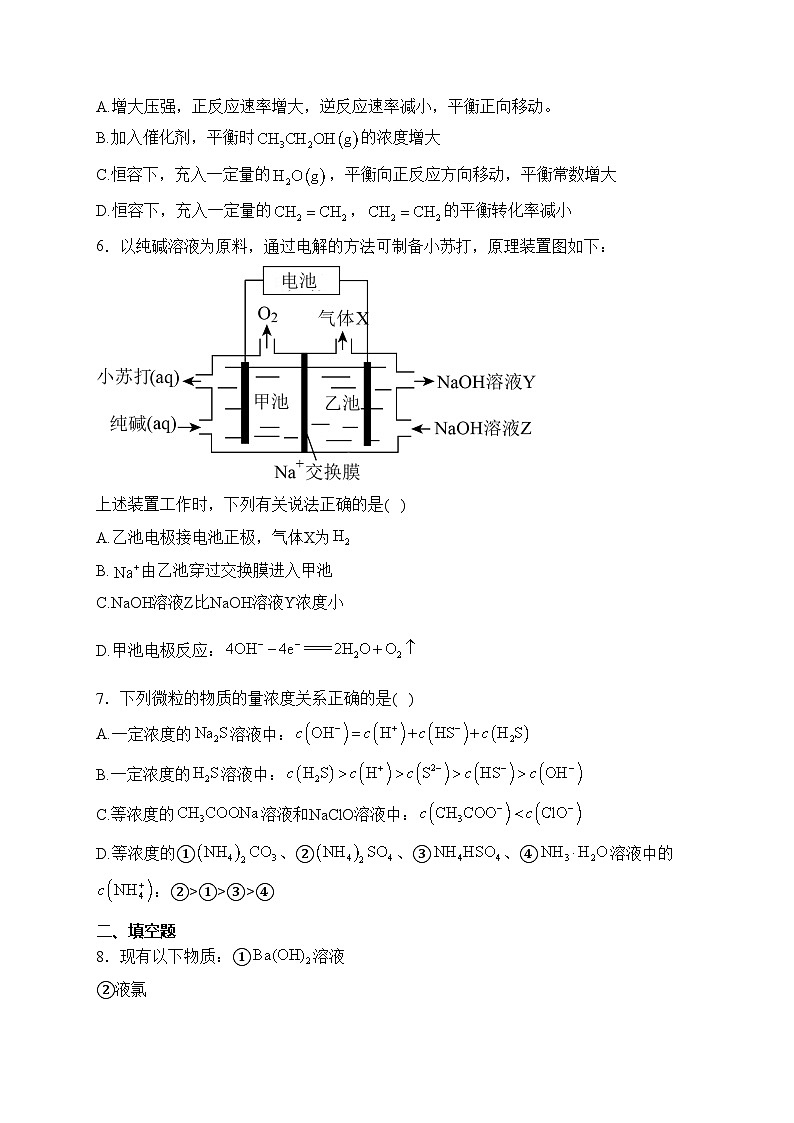
6.以纯碱溶液为原料,通过电解的方法可制备小苏打,原理装置图如下:
上述装置工作时,下列有关说法正确的是( )
A.乙池电极接电池正极,气体X为
B.由乙池穿过交换膜进入甲池
C.NaOH溶液Z比NaOH溶液Y浓度小
D.甲池电极反应:
7.下列微粒的物质的量浓度关系正确的是( )
A.一定浓度的溶液中:
B.一定浓度的溶液中:
C.等浓度的溶液和NaClO溶液中:
D.等浓度的①、②、③、④溶液中的:②>①>③>④
二、填空题
8.现有以下物质:①溶液
②液氯
③固体
④
⑤胶体
⑥铜
⑦干冰(固态的二氧化碳)
⑧冰醋酸(纯净的醋酸)
⑨
(1)以上物质中属于电解质的是_______(均填序号)。
(2)写出①和⑧的水溶液反应的离子方程式_______。
(3)向①中滴加④的水溶液之后,溶液导电能力随滴入溶液体积变化曲线如图所示。
①AB段反应的离子方程式:_______。
②C点溶液呈_______性(填“酸”、“碱”或“中”)。
③、的关系为:=_______。
(4)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请结合化学方程式表述原因_______。
(5)稀溶液有一种腐卵气味,加入溶液后,腐卵气味加剧,用离子方程式表示气味加剧过程所发生的化学反应_______。
(6)已知硼酸与足量氢氧化钠溶液反应的离子方程式为,则硼酸的电离方程式为_______。
9.2019年诺贝尔化学奖授予对锂离子电池研究的贡献。磷酸亚铁锂()电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
(1)“碱溶”时Al箔溶解过程中,氧化剂是_______。
(2)“酸浸”时生成NO的离子方程式是_______。(其他杂质不与反应)
(3)实验测得滤液②中,加入等体积的溶液后,的沉降率为90%,则加入饱溶液中=_______。[]
(4)磷酸亚铁锂电池总反应为:,电池中的固体电解质可传导。充电时,该电池的负极接电源的_______(填“正极”或“负极”);放电时,正极反应式为_______。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的溶液,再加入饱和溶液,用二苯胺磺酸钠作指示剂,用0.020重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:
①实验中加入饱和溶液的目的是_______。
②磷酸亚铁锂电池中铁的含量为_______%。
10.请回答下列问题:
(1)实验测得16g甲醇[(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出表示甲醇燃烧热的热化学方程式:_______。
(2)目前我国主要使用肼()作为卫星发射所用燃料。可作为火箭发动机的燃料,与氧化剂反应生成和。已知:
①
②
写出液体燃料与液态反应的热化学方程式:_______。
(3)在高温、高压和催化剂的条件下,将与转化为(g)。下表为几种共价键的键能数据:
则反应的=_______。
(4)已知热化学方程式:
①
②
③
则C(s)和(g)反应生成(g)的热化学方程式为:_______。
(5)在恒容密闭容器中,充入一定量的NO、CO发生反应:。200KPa时,在一个容积为2L的恒温密闭容器中充入1.5mlNO和2.0mlCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为=_______;反应达到平衡状态时,测得二氧化碳为0.8ml,则平衡时的压强为起始压强的_______倍(保留两位小数)。
(6)L(、)、X可分别代表压强或温度。如图表示L一定时,催化重整反应,(g)的平衡转化率随X的变化关系。
判断、的大小关系_______(填“>”、“”或“①>③>④,D正确;
故选D。
8.答案:(1)③④⑧⑨
(2)
(3);碱性;1:2
(4)硫酸铜溶液中存在,加热促进水解平衡正移,溶液变浑浊
(5)
(6)
解析:(1)电解质是水溶液或熔融状态下能导电的化合物,包括酸、碱、盐、金属氧化物、水等,属于电解质的是固体、、冰醋酸(纯净的醋酸)、,故属于电解质的选③④⑧⑨;
(2)醋酸是弱电解质,写化学式,①和⑧的水溶液反应的离子方程式为;
(3)溶液中滴加溶液,反应分两个阶段,第一阶段溶液中滴加反应生成硫酸钡沉淀、水和氢氧化钠,第二阶段氢氧化钠和硫酸氢钠反应生成硫酸钠和水;
①AB段反应的离子方程式;
②BD阶段的反应为氢氧化钠和硫酸氢钠反应生成硫酸钠和水,C点对应的溶液,氢氧化钠部分被中和,溶液呈碱性;
③假设有1ml氢氧化钡,硫酸根离子完全反应生成硫酸钡沉淀消耗1ml硫酸氢钠,氢氧根离子完全反应溶液呈中性,消耗2ml硫酸氢钠,所以:4=1:2。
(4)根据水解产生是吸热反应,加热促进水解,产生大量氢氧化铜使得溶液浑浊;
(5)根据溶液和溶液反应生成氢氧化铝沉淀和硫化氢气体,反应离子方程式为;
(6)硼酸电离出四羟基和硼酸根和氢离子,离子方程式为:。
9.答案:(1)
(2)
(3)1.88
(4)负极;
(5)将溶液中过量转化为稳定的,防止其干扰的测定;22.4
解析:(1)“碱溶”时Al箔溶解过程中发生的反应方程式为:,反应实质为,根据氧化还原原理,化合价降低是中的H,因此氧化剂为:;
(2)酸浸时,磷酸亚铁锂电池正极片上的与反应,生成和NO,反应的离子反应方程式为:;
(3)滤液②中,加入等体积的溶液后,的沉降率为90%,则的转化浓度为,由关系式:2~可知,的转化浓度为。滤液②中加入等体积的溶液后,,由碳酸锂溶度积,可得,则原饱和溶液中;
(4)根据电池总反应:,放点过程中,中的C的化合价升高生成C单质,失去电子,作负极,可知,极为原电池的负极,充电时为阴极,发生还原反应,则应与电源的负极相连。放电时,原电池的正极发生还原反应,则反应方程式为:;
(5)①根据题给信息,溶液稍过量,为了排除溶液中过量干扰的测定,故用饱和溶液将其转化为稳定的。
②由题给已知条件,可得关系式:,则有:
解得:;则磷酸亚铁锂电池中铁的含量为。
10.答案:(1)
(2)
(3)-90.8
(4)
(5)0.075ml/(L·min);0.89
(6)氧化产物,所以氧化性:,故填>;
②氯气本身没有漂白性,因溶于水后产生HClO,HClO具有漂白性,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有HClO分子,故填HClO;
③证明氯水中含有氯离子,可选用硝酸酸化的硝酸银溶液,操作为:取少量氯水于洁净的试管中,向其中加入硝酸酸化的硝酸银溶液,有白色沉淀生成,故填取少量氯水于洁净的试管中,向其中加入硝酸酸化的硝酸银溶液,有白色沉淀生成。
共价键
N≡N
H—H
N—H
键能(kJ/ml)
946
436
390.8
相关试卷
这是一份四川省泸县第一中学2023-2024学年高二下学期开学考试化学试卷(含答案),共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份四川省泸县第一中学2022-2023学年高一下学期开学考试化学试卷(含答案),共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份四川省泸县第一中学2022-2023学年高二下学期期末考试化学试卷(含答案),共15页。试卷主要包含了单选题,实验题,填空题等内容,欢迎下载使用。










