

90,广东省惠州市2023-2024学年高三上学期第三次调研化学试题
展开
这是一份90,广东省惠州市2023-2024学年高三上学期第三次调研化学试题,共8页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
可能用到的相对原子质量:H-1C-12N-14O-16Na-23V-51Mn-55Al-27
一、单项选择题:本题共16小题,共44分。第1-10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
1.中国文物具有鲜明的时代特征。下列源自广东的文物的主要成分属于硅酸盐的是
2.科技改变生活,近年我国在诸多领域大放异彩。下列说法正确的是
A.今年杭州亚运的主火炬燃料实现“零碳甲醇”,是指该甲醇中不含碳元素
B.我国“祝融号”火星探测车使用的太阳能电池的主要材料是二氧化硅
C.“嫦娥石”(Ca8Y)Fe(PO4)7是我国在月壤中发现的新型静态矿物,该矿物中的Fe元素位于周期表中的p区
D.北斗三号卫星导航系统中的“铷(Rb)原子钟”被誉为卫星的“心脏”,其中3785Rb和3787Rb互为同位素
3.建设美丽家园,创造幸福生活离不开化学,衣食住行皆化学。下列说法不正确的是
A.棉质衣服的主要成分是纤维素
B.粮食酿酒是由淀粉水解为葡萄糖,再由葡萄糖水解为乙醇
C.铝合金窗中铝合金的硬度比单质铝的大
D.铺路用的沥青可以通过石油的分馏获得
4.1774年,瑞典化学家舍勒发现了制备氯气的方法。在此启发下,兴趣小组利用以下装置进行如下实验,其中能够达到目的的是
5.化学用语可以表达化学过程,下列化学用语表达正确的是
A.Cl2通入石灰乳中:Cl2+2OH-=Cl-+ClO-+H2O
B.利用覆铜板制作印刷电路板:Fe3++Cu=Fe2++Cu2+
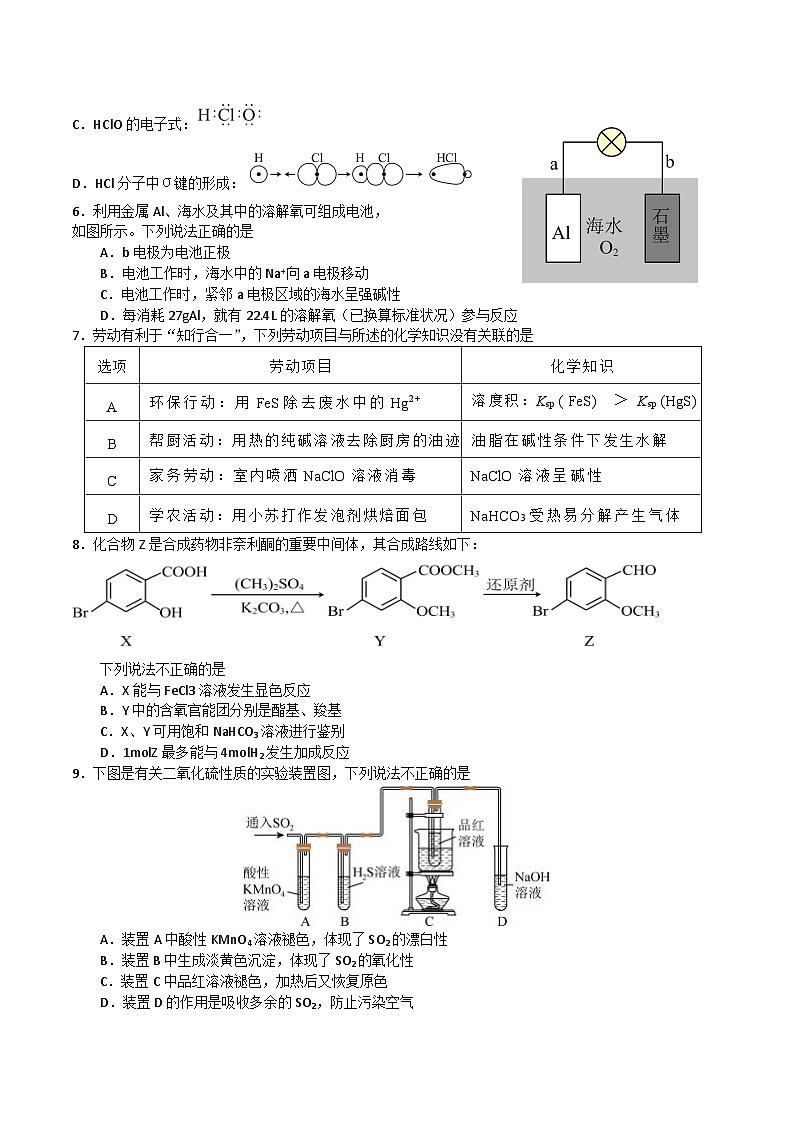
C.HClO的电子式:
D.HCl分子中σ键的形成:
6.利用金属Al、海水及其中的溶解氧可组成电池,
如图所示。下列说法正确的是
A.b电极为电池正极
B.电池工作时,海水中的Na+向a电极移动
C.电池工作时,紧邻a电极区域的海水呈强碱性
D.每消耗27gAl,就有22.4L的溶解氧(已换算标准状况)参与反应
7.劳动有利于“知行合一”,下列劳动项目与所述的化学知识没有关联的是
8.化合物Z是合成药物非奈利酮的重要中间体,其合成路线如下:
下列说法不正确的是
A.X能与FeCl3溶液发生显色反应
B.Y中的含氧官能团分别是酯基、羧基
C.X、Y可用饱和NaHCO3溶液进行鉴别
D.1mlZ最多能与4mlH2发生加成反应
9.下图是有关二氧化硫性质的实验装置图,下列说法不正确的是
A.装置A中酸性KMnO4溶液褪色,体现了SO2的漂白性
B.装置B中生成淡黄色沉淀,体现了SO2的氧化性
C.装置C中品红溶液褪色,加热后又恢复原色
D.装置D的作用是吸收多余的SO2,防止污染空气
10.下列陈述Ⅰ、Ⅱ没有因果关系的是
11.部分含氮物质的分类与相应氮元素化合价关系如图所示。下列说法不正确的是
A.谚语“雷雨发庄稼”中存在转化关系:b→c→d→e
B.常温下,a和e的水溶液等物质的量反应后溶液的pH<7
C.实验室用e的浓溶液与Cu反应制备d,可用排水法收集
D.一定条件下,b可以转化为a或c,该过程都属于氮的固定
12.常温常压下,电化学还原制氨气的总反应方程式:,设NA为阿伏加德罗常数的值,下列说法正确的是
A.9gH2O中含有的质子数目为5NA
B.1mlN2中含有的π键的数目为2NA
C.每生成4mlNH3就有6NA电子发生转移
D.消耗11.2LN2时,产生的O2分子数为0.75NA
13.将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g)⇌2Z(g)ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
14.实验探究是化学学习的方法之一、下列实验设计、现象和实验结论均正确的是
15.一种因具有成本低廉及反应性质多样等优点被用作有机合成的缩合试剂,其由4种短周期非金属元素组成,结构如图所示:,其中W、X、Y为同一周期,X与Z为同一主族。下列说法正确的是
A.简单氢化物的沸点:Y>WB.电负性:X>W>Y>Z
C.XW2中元素X为sp3杂化D.YX2是含极性键的极性分子
16.一定条件下,1-苯基丙炔(Ph-C=C-CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应活化能:反应I<反应Ⅱ
B.反应焓变:反应I<反应Ⅱ
C.增加HCl浓度不会改变平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
二、非选择题:本大题有4小题,共56分,考生根据要求作答。
17.(14分)盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a. 配置100mL0.2ml·L-1NaOH溶液;
b. 称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11。
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=n(NaOH)m(NH4Cl)
①步骤a需要称量NaOH固体为 g(保留一位小数)
②步骤b需要用到下图所示仪器中的 (填名称)。
③步骤b消耗NaOH的体积为ymL,则σ= ml·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与c(NH4+)c(NH3)、[c(NH4+)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因: 。
(3)小组同学设计实验探究[c(NH4+)+c(NH3)]一定时,c(NH4+)c(NH3)对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1ml·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线 (填曲线标号)表示溶液1。
②实验结果显示,当[c(NH4+)+c(NH3)]相同时,c(NH4+)c(NH3)越大,混合溶液的抗碱能力越强,则曲线b表示溶液 (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH= (精确至小数点后1位)。
18.(14分)为回收利用废钒催化剂(含有V2O5、VOSO4、SiO2、Fe3O4以及钾和铝的硅酸盐),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
已知:i.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
ii.VOSO4可溶、(VO2)2SO4易溶、V2O5和NH4VO3难溶;
VO2++2OH-=VO3−+H2O
(1)“酸浸氧化”时,VO2+转化成VO2+反应的离子方程式为 ,同时V2O5转化为VO2+。滤渣①主要成分是 。
(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子
有 。
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3
溶解,写出V2O5·2H2O与KOH反应的
化学方程式 。
(4)“调pH”中滤渣④的主要成分是
。
(5)全钒液流储能电池可实现化学能和电能
的相互转化,其原理如图所示。
①充电过程中,左槽电极反应式为
。
②放电过程中,右槽溶液颜色变化的情
况是 。
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为 。若该晶胞的密度为ρg/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为 nm。
19.(14分)减少NOx、CO2的排放,实现资源化利用是化学工作者研究的重要课题。
(1)尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。
①NH3催化还原NO为 (填“放热”“吸热”)反应。
②基态Fe3+的价层电子排布式为 。
③上述脱硝的总反应化学方程式为: 。
(2)电厂烟气脱氮的反应为:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g)ΔH<0,现向某2L密闭容器中分别投入一定量的NH3和2.0×10—4mlNO发生以上反应。其他条件相同时,在甲、乙两种催化剂的作用下,反应1min时NO的转化率与温度的关系如图3。
①在催化剂甲的作用下,温度高于210℃小于300℃时,NO转化率降低的可能原因是 。
②100—300℃区间,0~1min内,使用甲催化剂时NO的最高平均速率为
(3)工业以NH3和CO2为原料合成尿素。液相中,合
成尿素的热化学方程式为:
2NH3(l)+CO2(l)⇌H2O(l)+NH2CONH2(l)
ΔH<0,在液相中,CO2的平衡转化率与温度、初
始氨碳比(用L表示,L=n(NH3)n(CO2))、初始水碳比(用
W表示,W=n(H2O)n(CO2))关系如图4。
①曲线A、B中, (填“A”或“B”)的W较小。
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195℃时,2NH3(l)+CO2(l)⇌H2O(l)+NH2CONH2(l)的Kx的值为 。
20.(14分)三氟苯胺类化合物广泛应用于新型医药、染料和农药的合成领域,以间三氟甲基苯胺为中间体合成一种抗肿瘤药物H的合成路线如下图所示:
(1)A是芳香族化合物,分子式为C7H8,①则其结构简式为 ,②化合物C中官
能团的名称为 ,③化合物H的分子式为 。
(2)F→G的反应类型是 。
(3)该流程中设计C→D的目的是 。
(4)G→H的反应方程式为 。
(5)化合物B的同分异构体中,符合下列条件的有 种;
①-NH2与苯环直接相连
②能与银氨溶液在加热条件下反应产生银镜
其中核磁共振氢谱图显示有4组峰,且峰面积比为1:2:2:2的结构简式为 。
(6)参照上述合成路线和信息,设计以苯和乙酸酐为原料,制备乙酰苯胺
合成路线(其它试剂任选)。
A .错银青铜牛灯
B .鎏金兽形铜盒砚
C.三彩孩童骑牛陶俑
D .金錾花八宝鱼
选项
劳动项目
化学知识
A
环保行动:用FeS除去废水中的Hg2+
溶度积:Ksp ( FeS) > Ksp (HgS)
B
帮厨活动:用热的纯碱溶液去除厨房的油迹
油脂在碱性条件下发生水解
C
家务劳动:室内喷洒NaClO溶液消毒
NaClO溶液呈碱性
D
学农活动:用小苏打作发泡剂烘焙面包
NaHCO3受热易分解产生气体
选项
陈述Ⅰ
陈述Ⅱ
A
醋酸的酸性比碳酸强
用食醋清洗水壶内的水垢
B
H2O2 受热易分解
H2O2 常用于杀菌消毒
C
Al3+水解生成胶体
明矾可用于净水
D
BaSO4 难溶于水、酸和脂类物质
BaSO4 可用于钡餐
改变条件
新平衡与原平衡比较
A
充入一定量 Y
Y 的转化率增大
B
增大压强
X 的浓度变小
C
升高温度
X 的转化率变小
D
使用适当催化剂
X 的体积分数变小
选项
实验设计
现象
实验结论
A
向鸡蛋清溶液中滴入几滴硫酸铜溶液
产生白色沉淀,加 水后沉淀不溶解
蛋白质发生了变性
B
室温下用 pH 计测定同浓度的 NaClO 溶液和 CH3COONa 溶液的 pH
NaClO 溶液的 pH 较大
酸性:
HClO>CH3COOH
C
向溶液中先滴加新制氯水,再加 KSCN 溶液
溶液变红
该溶液一定含有 Fe2+
D
取少量于试管中,滴加
酸性 KMnO4 溶液
紫红色褪去
该有机物中含有醛基
溶液组号
组成
体积/mL
1
0.2 ml ·L- 1 NaCl 溶液
15
2
0.1 ml ·L- 1 NH4Cl
3
0.1 ml ·L- 1 氨水
12
3
0.1 ml ·L- 1 NH4Cl
7.5
0.1 ml ·L- 1 氨水
7.5
4
0.1 ml ·L- 1 NH4Cl
12
0.1 ml ·L- 1 氨水
3
金属离子
Fe3+
Fe2+
Al3+
开始沉淀 pH
1.9
7.0
3.0
完全沉淀 pH
3.2
9.0
4.7
相关试卷
这是一份广东省惠州市2023-2024学年高三上学期第三次调研考试化学试题,文件包含广东省惠州市高2024届高三上学期第三次调研考试化学试题docx、广东省惠州市高2024届高三上学期第三次调研考试化学答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份广东省惠州市2024届高三第三次调研考试试题化学试题和答案,共10页。
这是一份广东省惠州市2022-2023学年高三上学期第二次调研考试化学试题,共11页。试卷主要包含了可能用到的相对原子质量,下列“类比”结果正确的是等内容,欢迎下载使用。









