



所属成套资源:高二化学鲁科版(2019)选择性必修1 全册课件
第2章 章末复习 课件 高二化学鲁科版(2019)选择性必修1
展开
这是一份第2章 章末复习 课件 高二化学鲁科版(2019)选择性必修1,共37页。
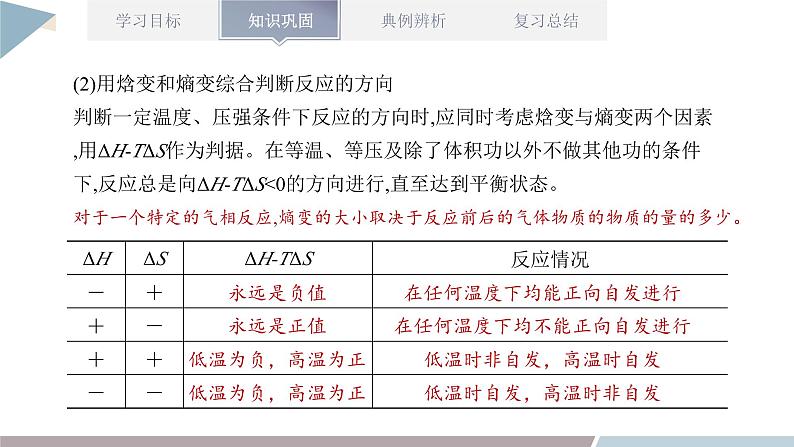
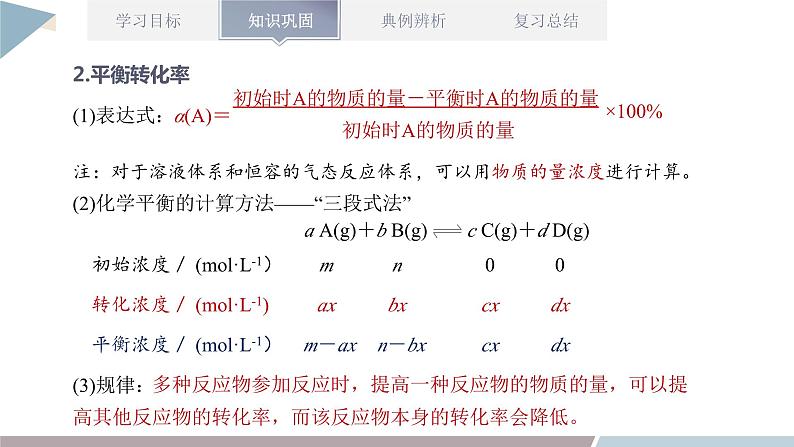
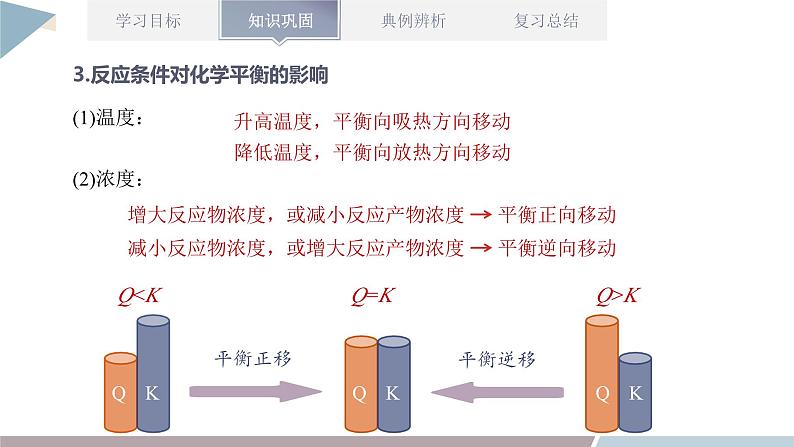
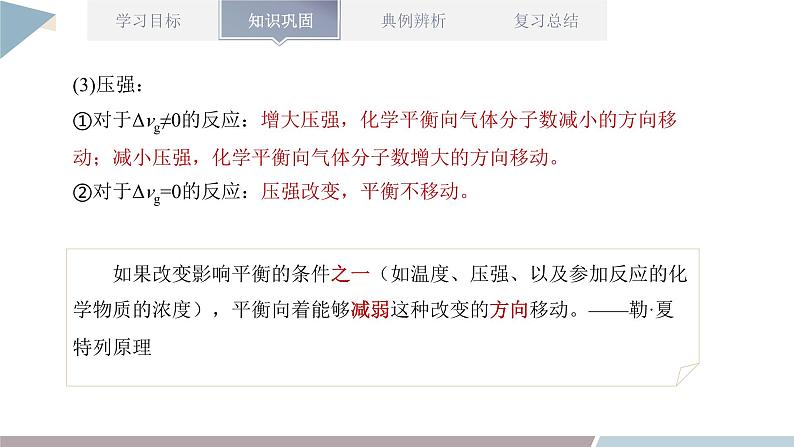
章末复习第2章 化学反应的方向、限度与速率1.能书写平衡常数表达式,进行平衡常数、转化率的简单计算;能利用平衡常数和浓度商的关系判断化学反应是否达到平衡状态以及平衡移动的方向。2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化,能讨论化学反应条件的选择和优化。3.能进行化学反应速率的简单计算。4.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释实际问题,进行化学反应条件的选择和优化。1.判断化学反应进行方向的两种方法知识点一:化学反应的方向(1)利用化学反应原理判断的几种方法①相对强酸(碱)可制备相对弱酸(碱)。②强氧化性与强还原性的物质反应可生成弱氧化性与弱还原性的物质。③稳定性弱的物质可生成稳定性强的物质。④满足复分解反应条件的溶液中的反应。(2)用焓变和熵变综合判断反应的方向判断一定温度、压强条件下反应的方向时,应同时考虑焓变与熵变两个因素,用ΔH-TΔS作为判据。在等温、等压及除了体积功以外不做其他功的条件下,反应总是向ΔH-TΔSv(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔHv(逆);则L线的右下方(F点),v(正)① (1)归一法:依据化学反应速率之比等于化学式前的系数之比,将同一反应中用不同物质表示的反应速率转化成用同一种物质表示的反应速率,然后直接依据数值进行比较。(2)比值法:用不同条件下各物质的量表示的反应速率除以对应各物质的系数,然后再对求出的数值(注意单位保持一致)进行大小排序,数值大的反应速率快。化学反应速率的比较方法【考点五】化学反应速率、化学平衡图像分析【例】(双选)不同温度下反应3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔHv(逆)B.v(正):A点>E点C.反应适宜温度:480~520 ℃D.某一温度下加入SiCl4可提高SiCl4的转化率AC解答化学平衡图像题的四步骤 【练一练】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,改变反应条件,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正、逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )A.30~40 min间该反应使用了催化剂B.化学方程式中的x=1,正反应为吸热反应C.30 min时降低温度,40 min时升高温度D.8 min前A的平均反应速率为0.08 mol·L-1·min-1D





