




所属成套资源:高二化学鲁科版(2019)选择性必修1 全册课件
鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第3节 化学反应的速率课文配套ppt课件
展开
这是一份鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第3节 化学反应的速率课文配套ppt课件,共20页。PPT课件主要包含了控制变量,有效碰撞,合适的碰撞角度,提供反应物分子的能量,提高化学反应速率,练一练等内容,欢迎下载使用。
1.了解浓度、温度、压强、催化剂对化学反应速率的影响,认识其一般规律;2.知道活化能的概念及其对化学反应速率的影响。
影响化学反应速率的因素有哪些?
外界因素是如何影响化学反应速率的,它们与化学反应速率之间存在着定量关系吗?
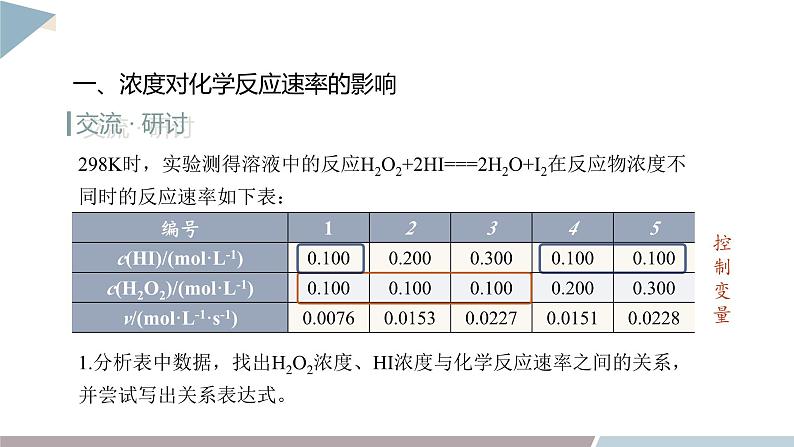
一、浓度对化学反应速率的影响
298K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在反应物浓度不同时的反应速率如下表:
1.分析表中数据,找出H2O2浓度、HI浓度与化学反应速率之间的关系,并尝试写出关系表达式。
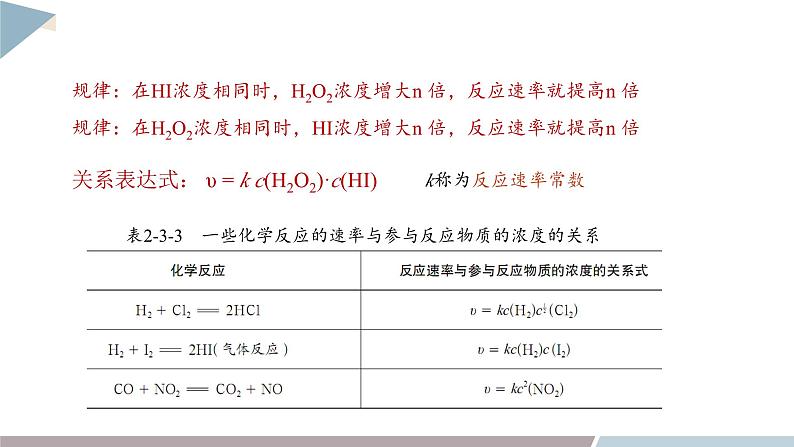
关系表达式: υ = k c(H2O2)·c(HI)
规律:在HI浓度相同时,H2O2浓度增大n 倍,反应速率就提高n 倍
规律:在H2O2浓度相同时,HI浓度增大n 倍,反应速率就提高n 倍
关系表达式: υ = k cm(A)·cn(B)
k,m,n均为实验测定的结果
k称为反应速率常数,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
对于气体参与的反应,在温度、体积一定的条件下
二、温度对化学反应速率的影响
范托夫曾总结出一条近似规律:对于在溶液中发生的反应,温度每升高10K,反应速率提高到原来的2~4倍。
温度会影响反应速率常数,从而影响化学反应速率。
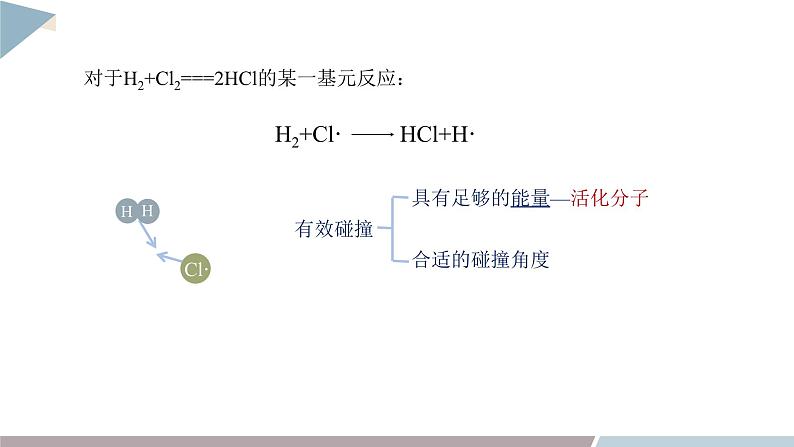
对于H2+Cl2===2HCl的某一基元反应:
具有足够的能量—活化分子
活化能(Ea)=过渡态的能量-反应物的平均能量
增大反应物之间的碰撞频率
增大反应物分子形成过渡态的比例
一定温度下,活化能越大,反应速率越小,活化能越小,反应速率越大。
三、催化剂对化学反应速率的影响
下表列出了一些反应在使用催化剂前后的活化能数据以及反应速率常数之比。请根据表中数据讨论:催化剂对化学反应速率有怎样的影响?
反应的活化能大幅度降低,反应速率常数变大,化学反应速率加快。
催化剂为何能加快化学反应速率?
1.催化原理催化剂通过参与反应改变反应历程、改变反应的活化能来改变化学反应速率。
注意:催化剂不能改变化学反应的平衡常数,不能改变平衡转化率。
(1)选择性:只对某一反应或某类反应起催化作用。
环氧乙烷是一种广谱灭菌剂,广泛应用于医疗用品灭菌。
加入Ag催化剂,降低生成环氧乙烷反应的活化能,使得该反应更容易进行,生成环氧乙烷的反应速率明显加快,有效减少副反应的发生,从而提高生产效率。
(2)高效性:可以较大幅度降低反应的活化能,从而加快化学反应速率。
[思考]催化剂加入化学反应中是否永久有效?
温度不是催化剂作用的合适温度,杂质与催化剂作用,都会使催化剂失去活性。
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)催化剂都不参加化学反应。( )(2)升高温度时,不论正反应是吸热还是放热,正、逆反应的速率都增大。( )(3)可逆反应中减小产物的浓度可增大正反应的速率。( )(4)增大反应体系的压强,反应速率不一定增大。( )(5)增大反应物的浓度,能够增大活化分子的百分含量,所以反应速率增大。( )(6)对于反应2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),使用催化剂可大大提高生产效率。( )
2.对于反应C(s)+H2O(g) CO(g)+H2(g),其他条件不变时,下列措施不能改变化学反应速率的是( )A.增大C(s)的量B.增大H2O(g)的浓度C.增大CO(g)或H2(g)的浓度D.减小H2O(g)的浓度
3.Fe与稀硫酸反应制氢气,下列措施能使生成氢气的速率一定加快的是( )A.增加铁的量B.增大硫酸的浓度C.加热D.增大压强
4.已知C(s)+CO2(g) 2CO(g) ΔH>0,反应速率为v1,N2(g)+3H2(g) 2NH3(g) ΔH”或“
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教课内容ppt课件,共20页。PPT课件主要包含了思考与讨论,不同化学反应的速率,同一化学反应的速率,外界条件外因,内因决定性因素,外因重要影响因素等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率完美版课件ppt,共29页。PPT课件主要包含了温故知新,常见外因,物质本身的性质,活化分子,活化能,①增大压强,→气体反应物浓度增大,②压强改变→,气体反应物浓度不变,→反应速率不变等内容,欢迎下载使用。
这是一份2020-2021学年第一节 化学反应速率教学ppt课件,共24页。PPT课件主要包含了学习评价,手持技术等内容,欢迎下载使用。










