






高中化学鲁科版 (2019)选择性必修1第2节 弱电解质的电离 盐类的水解授课课件ppt
展开1.能理解弱电解质电离平衡常数的含义,会书写电离平衡常数表达式;2.能分析外界因素对弱电解质电离平衡的影响;3.了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱。
醋酸和一水合氨同为弱电解质,当达到电离平衡时,它们电离的程度相同吗?弱电解质的电离程度是否会受温度、浓度等条件的影响?如何定量地表示弱电解质电离能力的强弱?
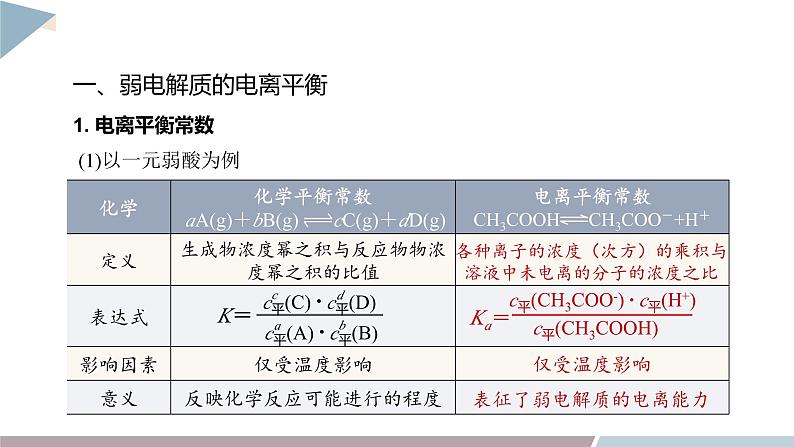
一、弱电解质的电离平衡
表征了弱电解质的电离能力
各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比
已知氢氰酸(HCN)、醋酸、氢氟酸这三种一元酸在室温下的电离常数,请同学们判断这三种一元酸的酸性强弱。
这三种酸的酸性由弱到强的顺序是氢氰酸、醋酸、氢氟酸。
规律:弱酸的电离常数越大,弱酸电离出H+的能力就越强,酸性就越强
多元酸的电离是分步进行的,每一步电离都有自己的电离常数,通常用 Ka1、Ka2……来表示。例如:
注:对于各级电离常数相差很大的多元弱酸,其水溶液中的 H+ 主要是由第一步电离产生的。
弱碱在水中的电离常数通常用 Kb 表示
室温下,Kb(NH3·H2O)=1.7×10-5ml·L-1
2. 影响电离平衡的因素
观察表 3-2-2 给出的数据,可以得出什么结论?
随着温度的升高,一水合氨的电离常数在不断增大
(1)温度:通常电离过程为吸热过程,温度升高,平衡常数增大,电离平衡正向移动。
在 1 ml·L-1 CH3COOH溶液加水稀释的过程中,表格中各量会如何变化呢?
(2)浓度:稀释溶液会促使弱电解质的电离平衡向电离的方向移动。
[试一试]通过比较Q、K的大小,判断1 ml·L-1 CH3COOH溶液加水稀释10倍后电离平衡移动的方向。
答:1 ml·L-1 CH3COOH溶液加水稀释过程中电离平衡向电离的方向移动。
现有 0.1 ml·L-1 CH3COOH溶液,判断当下列条件改变时溶液中发生的变化。
①加入与弱电解质电离出的离子相同的离子,电离平衡逆向移动。
②加入与弱电解质电离出的离子反应的离子,电离平衡正向移动。
pH增大即c平(H+)减小,因此采取的措施应是c平(H+)减小引起的平衡右移。故加水稀释、加入Na2CO3固体、加入NaOH、加入Zn等活泼金属,都能促进醋酸电离,且使溶液pH增大。
Ⅰ.要促进CH3COOH的电离并使溶液pH增大,可采取哪些措施?
Ⅱ.溶解冰醋酸并不断稀释的过程中,用图示表示溶液中c平(H+)随加水量的变化关系。
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。(1)当CH3COOH在水溶液中达到电离平衡时:c平(CH3COOH)=c平(H+)=c平(CH3COO-)。( )(2)向氨水中滴加酚酞溶液变红色,说明NH3·H2O是弱电解质。 ( )(3)相同温度下,Ka(HF)>Ka(CH3COOH),说明酸性:HF>CH3COOH。( )(4)0.1 ml·L-1某一元酸HA溶液的pH=3,HA溶液中存在:HA === H++A-。( )(5)相同条件下,电离平衡常数(K)越小,表示弱电解质电离能力越弱。( )(6)电离平衡右移,电离平衡常数一定增大。( )
电离平衡常数与化学平衡常数一样,只与温度有关,与其他条件无关。
2.在0.1 ml·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )A.温度升高,平衡向逆反应方向移动B.加入少量NaOH固体,平衡向正反应方向移动C.加入少量0.1 ml·L-1 HCl溶液,溶液中c平(H+)减小D.加入少量醋酸钠固体,CH3COOH的电离程度增大
3.下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5 ml·L-1)和一氯乙酸(乙,Ka=1.4×10-3 ml·L-1)在水中的电离度与浓度关系的是(已知:
4.下列实验事实不能证明醋酸是弱酸的是( )A.常温下,相同浓度的醋酸溶液和盐酸,导电能力前者弱B.常温下,测得0.1 ml·L-1醋酸溶液的pH=4C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
5.已知在25 ℃时,氨水中NH3·H2O的电离常数Kb=1.8×10-5 ml·L-1,回答下列问题:(1)氨水中NH3·H2O的电离常数表达式Kb= 。 (2)当向该氨水中加入一定量的NaOH溶液时,Kb值是否会发生变化? (填“会”或“不会”)。 (3)若该氨水的起始浓度为0.01 ml·L-1,则达到电离平衡时溶液中OH-的物质的量浓度为 。
4.2×10-4ml·L-1
6.已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
下列说法正确的是( )A.相同条件下,同浓度的H2SO3溶液和H2CO3溶液的酸性,后者更强D.向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度
电离常数除了可以比较弱电解质的电离能力外,还能定量判断电离平衡的移动方向。
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解课前预习ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002588_t3/?tag_id=26" target="_blank">第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解课前预习ppt课件</a>,共16页。PPT课件主要包含了NaHCO3溶液,微粒的来源和种类,AlOH3,水解完全,同时产生沉淀和气体,能稳定存在,部分水解,盐类水解的应用,实验用品,解释下列事实等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解课文内容ppt课件: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002588_t3/?tag_id=26" target="_blank">第3章 物质在水溶液中的行为第2节 弱电解质的电离 盐类的水解课文内容ppt课件</a>,共24页。PPT课件主要包含了盐本身的性质,越弱越水解,通入HCl,加入固体NH4Cl,正向移动,逆向移动,△H>0,遵循勒夏特列原理,越稀越水解,越热越水解等内容,欢迎下载使用。
化学选择性必修1第2节 弱电解质的电离 盐类的水解图文ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002588_t3/?tag_id=26" target="_blank">第2节 弱电解质的电离 盐类的水解图文ppt课件</a>,共22页。PPT课件主要包含了NaCl,CH3COONa,NH4Cl,实验结果,NH3·H2O,微粒的来源和种类,微粒间的相互作用,微粒间作用的结果,盐类的水解,强酸强碱盐等内容,欢迎下载使用。













