资料中包含下列文件,点击文件名可预览资料内容





还剩12页未读,
继续阅读
(人教A版选择性必修第一册)高二化学同步精品课件课后练习+解析讲义 第26讲 电解池的原理(PPT课件)
展开
这是一份(人教A版选择性必修第一册)高二化学同步精品课件课后练习+解析讲义 第26讲 电解池的原理(PPT课件),文件包含人教A版选择性必修第一册高二化学同步精品课件讲义第26讲电解池的原理PPT课件pptx、人教A版选择性必修第一册高二化学同步讲义第26讲电解池的原理学生版+教师版docx等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
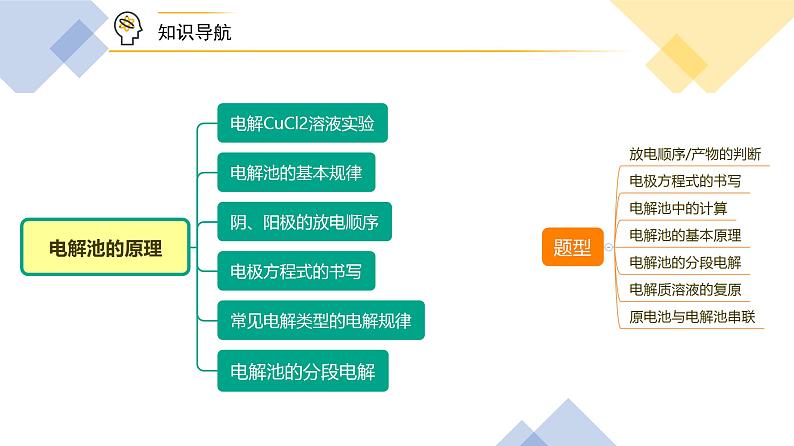
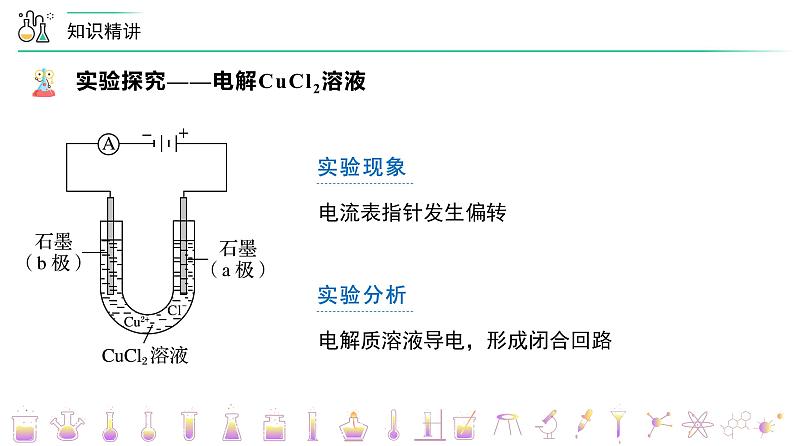
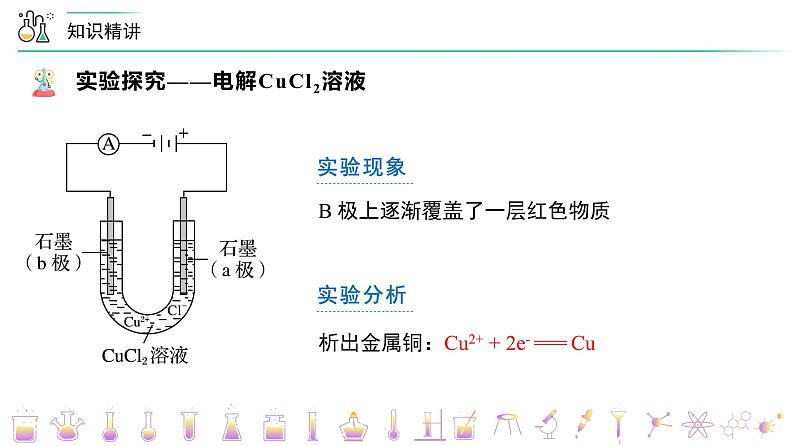
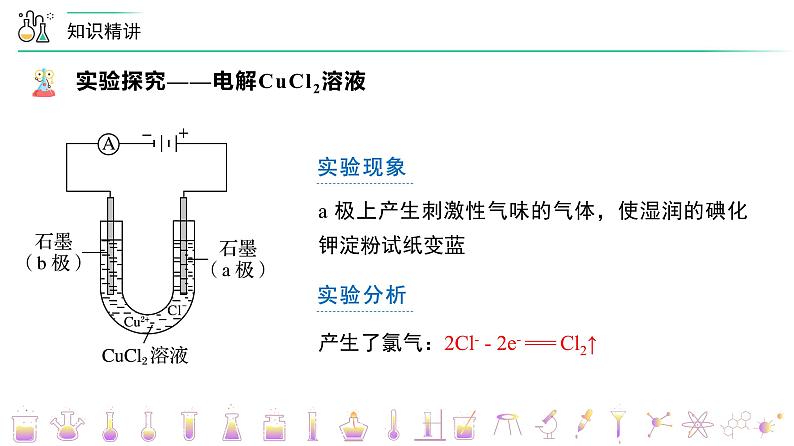
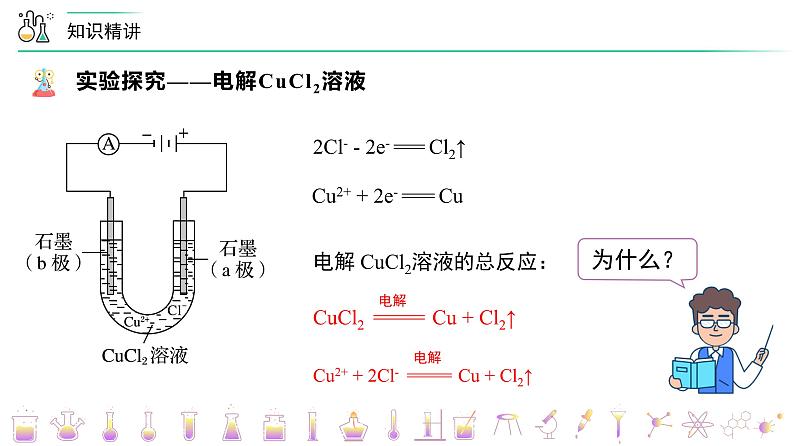
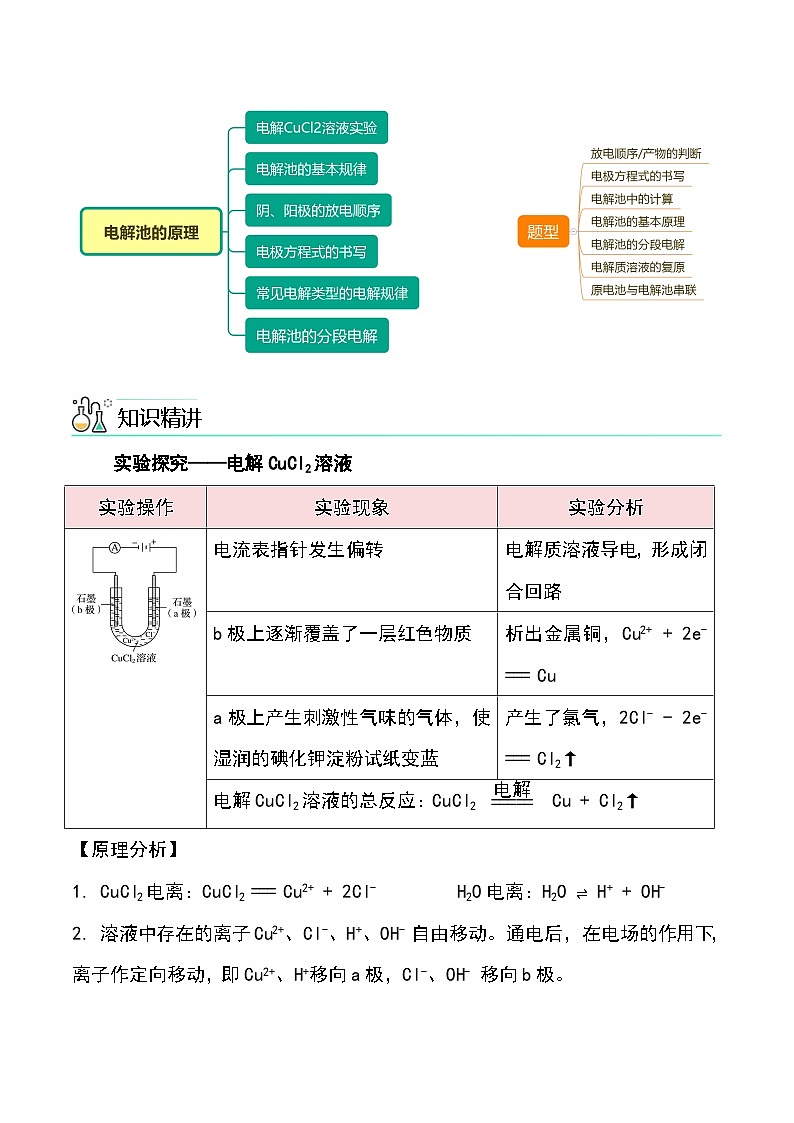
第26讲 电解池的原理【基础版本课件】版权所有,任何侵权、倒卖、牟利行为,必定诉诸法庭追究法律责任!1实验现象电流表指针发生偏转实验分析电解质溶液导电,形成闭合回路实验现象B 极上逐渐覆盖了一层红色物质实验分析析出金属铜:Cu2+ + 2e- === Cu实验现象a 极上产生刺激性气味的气体,使湿润的碘化钾淀粉试纸变蓝实验分析产生了氯气:2Cl- - 2e- === Cl2↑电解 CuCl2溶液的总反应:CuCl2 ===== Cu + Cl2↑Cu2+ + 2Cl- ===== Cu + Cl2↑电解2Cl- - 2e- === Cl2↑Cu2+ + 2e- === Cu电解一、电解、电解池、放电1.电解 使电流通过电解质溶液(或熔融电解质)而引起氧化还原反应的过程叫做电解。2.电解池 把电能转化为化学能的装置,叫做电解池,也叫电解槽。3 .放电 当离子到达电极时,失去/获得电子,发生氧化/还原反应的过程,称为放电。二、电解池的基本规律①直流电源;②两个电极;③闭合回路;④电解质溶液或熔融电解质正极氧化负极还原阳极阴极负阴阳正 四、电极方程式的书写1. 写出溶液中存在的离子并比较放电顺序2. 根据氧化还原或题目信息,判断产物并写出电极反应五、常见电解类型的电解规律变小变大不变加适量水Cu2+ + 2e- === Cu2Cl- - 2e- === Cl2↑变大加CuCl2(s)阴极:_________________________阳极:_________________________总反应:_______________________4H+ + 4e- === 2H2↑4OH- - 4e- === 2H2O + O2↑ 电解水型五、常见电解类型的电解规律2H+ + 2e- === H2↑ 2Cl- - 2e- === Cl2↑ 2Cu2+ + 4e- === 2Cu4OH- - 4e- === 2H2O + O2↑ 变小变大通入HCl(g)加CuO【例1】电解CuCl2与NaCl的混合溶液(惰性电极),阴极上和阳极上最先析出的物质为A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2B题型一:放电顺序与放电产物的判断【例3】用情性电极电解下列溶液(1)电解KNO3溶液阳极反应___________(2)电解CuCl2溶液阴极反应___________(3)电解氢氧化钠溶液的总反应___________(4)电解CuSO4与NaCl混合溶液开始时阳极反应___________,阴极反应___________题型二:电极方程式的书写【例6】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:(1)Y电极为直流电源的___________极。(2)B中阳极的电极反应式为___________。题型四:电解池的基本原理(3)C中pH变化:___________(填“增大”、“减小”或“不变”)。(4)A中反应的方程式为___________。若A中KCl溶液的体积是200mL,电解后,溶液的pH为___________(设电解前后溶液体积不变)。
第26讲 电解池的原理【基础版本课件】版权所有,任何侵权、倒卖、牟利行为,必定诉诸法庭追究法律责任!1实验现象电流表指针发生偏转实验分析电解质溶液导电,形成闭合回路实验现象B 极上逐渐覆盖了一层红色物质实验分析析出金属铜:Cu2+ + 2e- === Cu实验现象a 极上产生刺激性气味的气体,使湿润的碘化钾淀粉试纸变蓝实验分析产生了氯气:2Cl- - 2e- === Cl2↑电解 CuCl2溶液的总反应:CuCl2 ===== Cu + Cl2↑Cu2+ + 2Cl- ===== Cu + Cl2↑电解2Cl- - 2e- === Cl2↑Cu2+ + 2e- === Cu电解一、电解、电解池、放电1.电解 使电流通过电解质溶液(或熔融电解质)而引起氧化还原反应的过程叫做电解。2.电解池 把电能转化为化学能的装置,叫做电解池,也叫电解槽。3 .放电 当离子到达电极时,失去/获得电子,发生氧化/还原反应的过程,称为放电。二、电解池的基本规律①直流电源;②两个电极;③闭合回路;④电解质溶液或熔融电解质正极氧化负极还原阳极阴极负阴阳正 四、电极方程式的书写1. 写出溶液中存在的离子并比较放电顺序2. 根据氧化还原或题目信息,判断产物并写出电极反应五、常见电解类型的电解规律变小变大不变加适量水Cu2+ + 2e- === Cu2Cl- - 2e- === Cl2↑变大加CuCl2(s)阴极:_________________________阳极:_________________________总反应:_______________________4H+ + 4e- === 2H2↑4OH- - 4e- === 2H2O + O2↑ 电解水型五、常见电解类型的电解规律2H+ + 2e- === H2↑ 2Cl- - 2e- === Cl2↑ 2Cu2+ + 4e- === 2Cu4OH- - 4e- === 2H2O + O2↑ 变小变大通入HCl(g)加CuO【例1】电解CuCl2与NaCl的混合溶液(惰性电极),阴极上和阳极上最先析出的物质为A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2B题型一:放电顺序与放电产物的判断【例3】用情性电极电解下列溶液(1)电解KNO3溶液阳极反应___________(2)电解CuCl2溶液阴极反应___________(3)电解氢氧化钠溶液的总反应___________(4)电解CuSO4与NaCl混合溶液开始时阳极反应___________,阴极反应___________题型二:电极方程式的书写【例6】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:(1)Y电极为直流电源的___________极。(2)B中阳极的电极反应式为___________。题型四:电解池的基本原理(3)C中pH变化:___________(填“增大”、“减小”或“不变”)。(4)A中反应的方程式为___________。若A中KCl溶液的体积是200mL,电解后,溶液的pH为___________(设电解前后溶液体积不变)。
相关资料
更多









