

河南省部分名校2023-2024学年高二上学期1月期末考试化学试题(含答案)
展开
这是一份河南省部分名校2023-2024学年高二上学期1月期末考试化学试题(含答案),共12页。试卷主要包含了海水中的闸门易发生腐蚀等内容,欢迎下载使用。
河南省部分名校2023-2024学年高二上学期1月期末考试
化学
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.电负性是由美国化学家鲍林提出的。下列不能根据元素电负性判断的是( )
A.元素原子的得电子能力 B.元素形成化合物中的化合价正、负
C.不同元素之间形成的化学键类型 D.氢化物水溶液的酸性
2.下列过程属于化学变化,且对能量变化的判断正确的是( )
A.
B.
C.制备胶体的能量变化如图中变化
D.电动车的电池在放电时释放能量
3.向下图所示内筒中加入溶液和溶液进行中和反应反应热的测定。下列有关说法正确的是( )
A.加入溶液时应分三次加入
B.若用同体积同浓度的醋酸代替,会使测得的中和反应的反应热数值偏低
C.实验中使用了稍过量的氢氧化钠溶液,会使实验产生不必要的误差
D.玻璃搅拌器可用铜制搅拌器代替
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.溶液中:
B.中性溶液中:
C.的溶液中:
D.由水电离出来的的溶液中:
5.实验室能用与浓盐酸反应制备,工业上采用电解饱和氯化钠溶液(氯碱工业)的方法制备。下列说法正确的是( )
A.基态氯原子核外电子占据的最高能级的电子云轮廓图为哑䍅形
B.氯碱工业中阳极常用铁作电极材料,阳极反应式为
C.基态的价层电子排布式为
D.电负性:
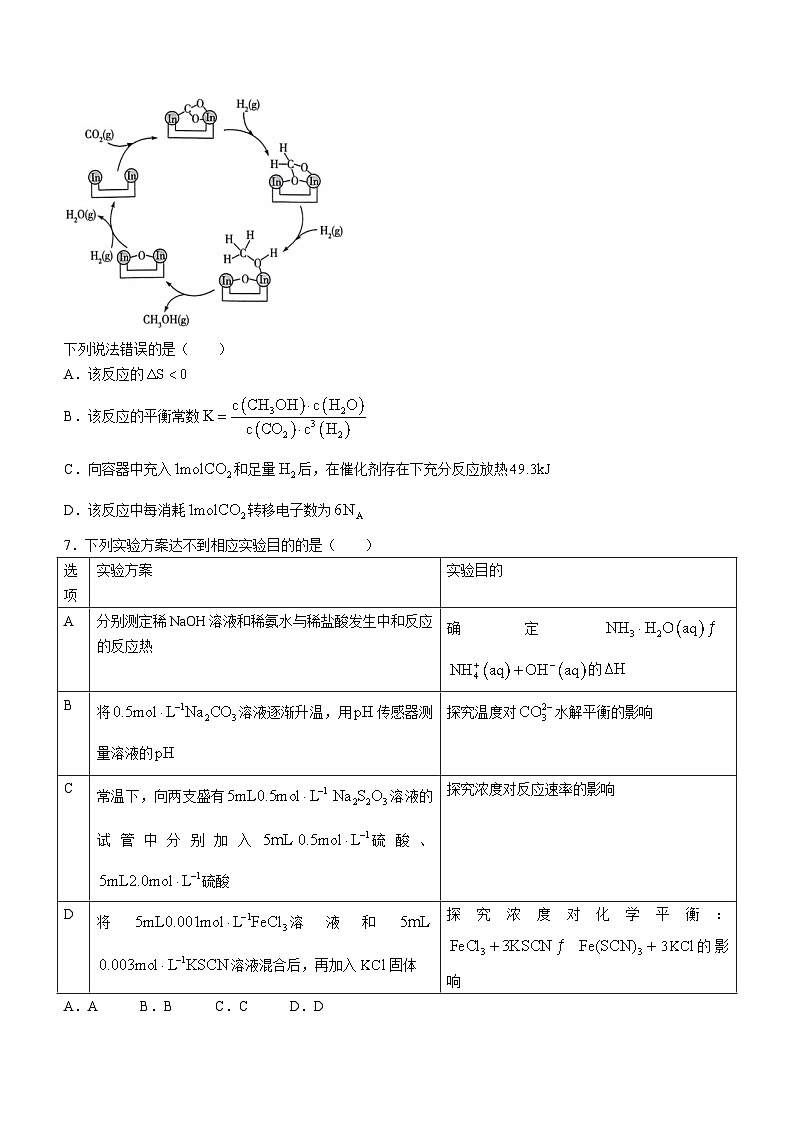
6.资源化利用是解决资源和能源短缺、减少碳排放的一种途径。以为催化剂,可使在温和条件下转化为甲醇,反应历程如图所示。与在活化后的催化剂表面发生可逆反应,每生成放热。
下列说法错误的是( )
A.该反应的
B.该反应的平衡常数
C.向容器中充入和足量后,在催化剂存在下充分反应放热
D.该反应中每消耗转移电子数为
7.下列实验方案达不到相应实验目的的是( )
A.A B.B C.C D.D
8.下图中曲线a、b、c表示的是C、Si、P的逐级电离能,下列物理量由大到小的顺序正确的是( )
A.原子序数: B.简单气态氢化物的稳定性:
C.最高价氧化物对应水化物的酸性: D.电负性:
9.海水中的闸门易发生腐蚀(如图1),可以通过电化学方法对闸门进行保护(如图2)。下列说法错误的是( )
A.图1中a处在海水常在的水位附近
B.图1中发生析氢腐蚀
C.图2中,若b、c直接用导线连接,d为锌块,则为牺牲阳极法
D.图2中,若b、c外接电源,则d为惰性电极
10.香港城市大学范战西课题组开发了一种可充电锌-硝酸根/乙醇电池,合成醋酸铵,装置如图所示(充电、放电时双极膜反向)。下列说法错误的是( )
A.放电时,电极的电势高于电极
B.放电时,由双极膜向a极迁移
C.充电时,极反应式可能为
D.放电时,电流从电极经导线流向电极
11.一种锂离子电池中电解质的阴离子结构如图所示。是原子序数依次增大的同周期元素,其中是形成化合物种类最多的元素,是地壳中含量最多的元素。四种元素原子的最外层电子数之和为20。下列说法正确的是( )
A.基态原子未成对电子数:
B.基态W原子最外层有3个能量相同的电子
C.基态Z原子的价电子轨道表示式:
D.最简单氢化物的沸点:
12.现有四种弱酸,它们在常温下的电离平衡常数如下表所示:
下列说法错误的是( )
A.结合质子的能力由大到小的顺序为
B.向溶液中通入时不会反应生成
C.向溶液中通入少量时生成碳酸氢钠和
D.常温下,向溶液中加入一定量的,所得溶液的,则混合液中
13.甲烷与水蒸气反应可转化为和,每有生成,反应吸收的热量。向体积为的恒容密闭容器中充入,同时充入水蒸气,使与的物质的量之比分别为,在不同温度下充分反应达到平衡,的平衡转化率与物料比、温度的关系如图所示。下列说法正确的是( )
A.
B.时,当充入的和的物质的量之比为1∶4时,的平衡转化率为
C.平衡常数:
D.当容器中混合气体的密度不变时,反应达到平衡状态
14.已知常温下,。常温下,向含的溶液中滴加氨水,混合溶液中与的关系如图所示。下列说法错误的是( )
A.代表的负对数与的关系
B.常温下,
C.溶液中,
D.常温下,的平衡常数为
二、非选择题:本题共4小题,共58分。
15.(12分)氯气及其某些氧化物均能用于饮用水的消毒杀菌。
(1)1868年,狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧气氧化氯化氢气体制取氯气的方法,同时生成水蒸气。
已知:①
②
写出上述方法制备氯气的热化学方程式:______________。
(2)用的强氧化性来去除烟气中的等污染气体,涉及的部分反应如下:
保持其他条件不变,对比添加、不添加两种情况,测得氧化率随变化关系如图所示。
①写出与反应的总化学方程式:______________。
②添加后,氧化率明显提高,其原因可能是______________。
(3)在恒容密闭容器中充入发生反应:,平衡时其中三个组分的物质的量与温度的关系如图所示。
①下列措施既能提高的平衡转化率,又能增大化学反应速率的是_______(填字母)。
A.升高温度 B.增大压强
C.加入催化剂 D.移出
②条件下,平衡时的物质的量浓度是_______。
③时,该反应的平衡常数_______。
16.(16分)电解制锰的阳极渣主要成分是,还含有少量及铁的氧化物,以阳极渣和黄铁矿为原料可制备,其流程如图所示:
已知常温下,。
(1)基态的价电子轨道表示式为_______。的焰色试验为绿色,这是_______的结果。
(2)加快“酸浸”速率的措施有______________(填两条)。稀酸为_______(填名称)。“酸浸”时中的铁元素转化为,则该反应中氧化剂与还原剂的物质的量之比为_______。
(3)滤渣Ⅱ的主要成分为、_______(填化学式)。
(4)加入时发生反应的离子方程式为______________。如果“净化”所得溶液中的浓度为,则溶液中_______。
(5)溶液中的元素守恒式为_______。加入溶液进行“沉锰”,写出该反应的离子方程式:______________。
17.(12分)(氯化亚矾)是一种重要的化工原料,是常用的氯化剂,也是制造电池的重要原料。
(1)是一种液态化合物,沸点为,在水中会剧烈水解。在水解得到的溶液中加入溶液可得到白色沉淀,水解产生的气体能使品红溶液褪色。
①分子中三种元素的简单阴离子还原性从大到小的顺序为_______(用离子符号表示)。不能表示S的基态原子的价电子轨道表示式,因为违背了_______。
②的水解方程式为______________。
③加热时得不到,但在加入并加热时可得到无水,其原因是______________。
(2)可用于制造心脏起搏器的微型电池。将等物质的量的溶解在中形成电解质溶液,以石墨和锂为电极材料,电池总反应为,硫和二氧化硫溶解在过量的氯化亚砜电解液中。该电池放电时,移向_______极(填“正”或“负”),正极反应式为______________。该电池为可充电电池,充电时阴极反应式为______________。
18.(18分)碳中和的目标是减少含碳气体的排放。与都能引起温室效应,将二者联合处理不仅可以减缓温室气体排放,还可以转化为等高附加值产品。
(1)和在一定条件下能发生如下两个反应:
Ⅰ.
Ⅱ.
若和按物质的量之比投料在某恒容密闭容器中发生上述反应,一定时间内和的转化率随温度的变化如图所示,其中在时的平衡转化率为在时的平衡转化率几乎为。
①反应Ⅰ在_______下能自发进行(填“高温”或“低温”)。
②温度高于时,随温度升高,平衡产物中的体积分数_______(填“增大”“减小”或“不变”)。
③时反应Ⅱ的平衡常数_______(保留3位有效数字,下同),平衡时的体积分数为_______。
(2)与在催化剂作用下反应可生成,其反应机理如图所示。
①写出该反应的化学方程式:______________。
②转化过程中经历了ⅰ→ⅱ的变化,该变化过程_______(填“吸热”或“放热”)。基态碳原子核外有_______种不同空间运动状态的电子,氧元素位于元素周期表的_______区。基态的第一电离能由大到小的顺序为_______(用元素符号表示)。
(3)甲醇与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,溶液为电解质溶液,写出该燃料电池的总反应:_______,该电池放电时,负极反应式为______________。
河南省部分名校2023-2024学年高二上学期1月期末考试
化学(专版)答案
1~14题,每小题3分,共42分。
1.D 2.D 3.B 4.A 5.A 6.C 7.D 8.C 9.B 10.B 11.C 12.A 13.B 14.C
15.(1)(2分)
(2)①
②添加后,反应③可生成较多的,此时有利于反应②将氧化为,所以氧化率明显提高(合理即可,2分)
(3)①B ② ③5
16.(1) 原子核外电子跃迁释放能量(合理即可,1分)
(2)将阳极渣和黄铁矿粉碎、适当升高温度、适当增大酸的浓度等(答两条,合理即可,2分)硫酸
(3)(1分)
(4)或
(5)
17.(1)① 泡利(不相容)原理、洪特规则
②
③遇水既产生气体抑制铝离子的水解,又能除去水,使氯化铝在缺水环境中无法水解(合理即可,2分)
(2)正
18.(1)①高温 ②增大 ③1.56
(2)①
②放热 4
(3)或 选项
实验方案
实验目的
A
分别测定稀NaOH溶液和稀氨水与稀盐酸发生中和反应的反应热
确定的
B
将溶液逐渐升温,用传感器测量溶液的
探究温度对水解平衡的影响
C
常温下,向两支盛有溶液的试管中分别加入硫酸、硫酸
探究浓度对反应速率的影响
D
将溶液和溶液混合后,再加入固体
探究浓度对化学平衡:的影响
弱酸
电离平衡常数
相关试卷
这是一份河南省部分名校2023-2024学年高二上学期1月期末化学试题,共4页。
这是一份河南省部分名校2023-2024学年高三上学期12月联考化学试题含答案,共24页。试卷主要包含了为阿伏加德罗常数的值等内容,欢迎下载使用。
这是一份福建省部分名校2023-2024学年高二上学期入学联考化学试题(含答案),共18页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。









