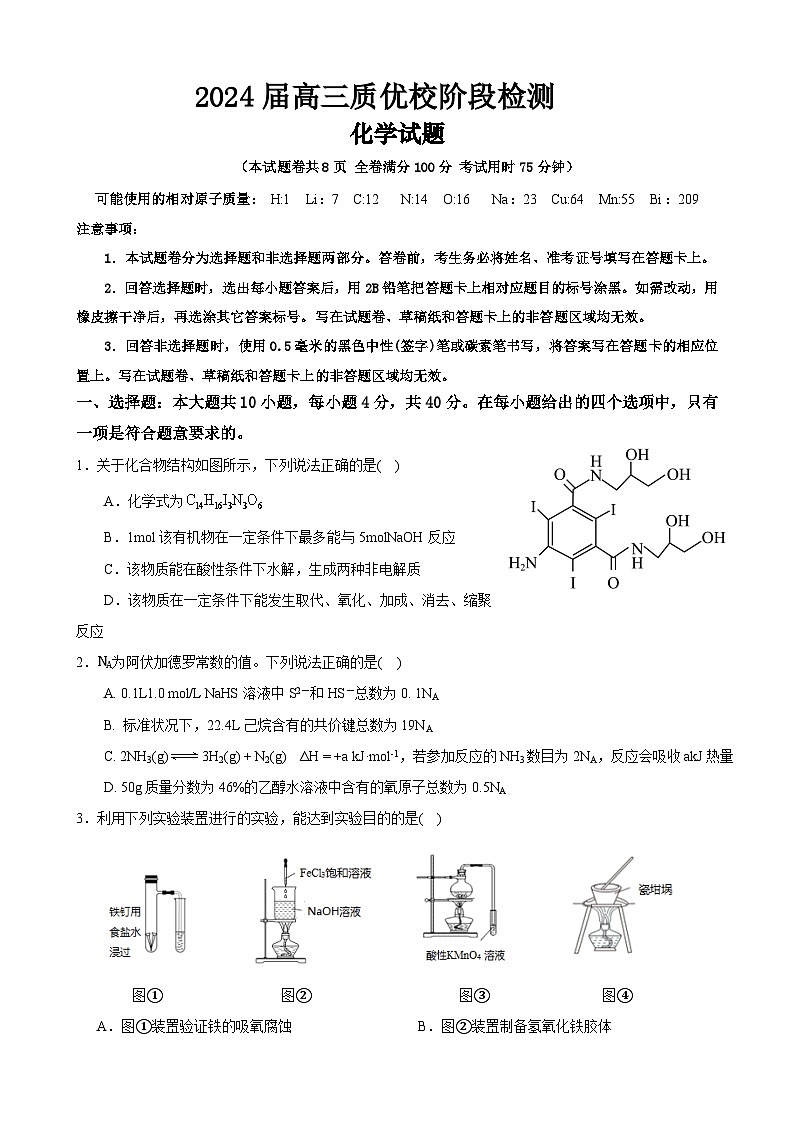

福建省优质校2023-2024学年高三上学期12月阶段性检测化学试题(Word版附答案)
展开(本试题卷共8页 全卷满分100分 考试用时75分钟)
可能使用的相对原子质量: H:1 Li:7 C:12 N:14 O:16 Na:23 Cu:64 Mn:55 Bi:209
注意事项:
1.本试题卷分为选择题和非选择题两部分。答卷前,考生务必将姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上相对应题目的标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.回答非选择题时,使用0.5毫米的黑色中性(签字)笔或碳素笔书写,将答案写在答题卡的相应位置上。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
一、选择题:本大题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项是符合题意要求的。
1.关于化合物结构如图所示,下列说法正确的是( )
A.化学式为
B.1ml该有机物在一定条件下最多能与5mlNaOH反应
C.该物质能在酸性条件下水解,生成两种非电解质
D.该物质在一定条件下能发生取代、氧化、加成、消去、缩聚反应
2.NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1L1.0 ml/L NaHS溶液中S2-和HS-总数为0. 1NA
B. 标准状况下,22.4L己烷含有的共价键总数为19NA
C. 2NH3(g)3H2(g) + N2(g) ΔH = +a kJ·ml-1,若参加反应的NH3数目为2NA,反应会吸收akJ热量
D. 50g质量分数为46%的乙醇水溶液中含有的氧原子总数为0.5NA
3.利用下列实验装置进行的实验,能达到实验目的的是( )
图① 图② 图③ 图④
A.图①装置验证铁的吸氧腐蚀 B.图②装置制备氢氧化铁胶体
C.图③装置验证溴乙烷发生了消去反应D.图④装置煅烧石灰石制备少量生石灰
4.如图所示的化合物是一种重要的化工原料,X、Y、Z、W、E是原子序数依次增大的短周期主族元素,基态Y原子的核外有3个未成对电子。下列说法错误的是( )
A.电负性:E>X B.第一电离能:Z>Y>E
C.离子半径:E>Z>W D.X与Z形成的分子是极性分子
5.下列离子在一定条件下能共存,且加入相应试剂后发生反应的离子方程式正确的是( )
6.实验室以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2的实验流程如下:
下列说法正确的是( )
A.过二硫酸钠(Na2S2O8)中硫元素的化合价为+7价
B.沉锌时的离子方程式为3Zn2++6HCO3− === ZnCO3·2Zn(OH)2↓+5CO2↑+H2O
C.调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D.氧化除锰后的溶液中存在:Na+、Zn2+、Fe2+、SO42-
7.北京大学的科技工作者在金(111)表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的AFM表征细节(图1)及其结构模型(图2)如下。下列说法正确的是( )
A.气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
B.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C.受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
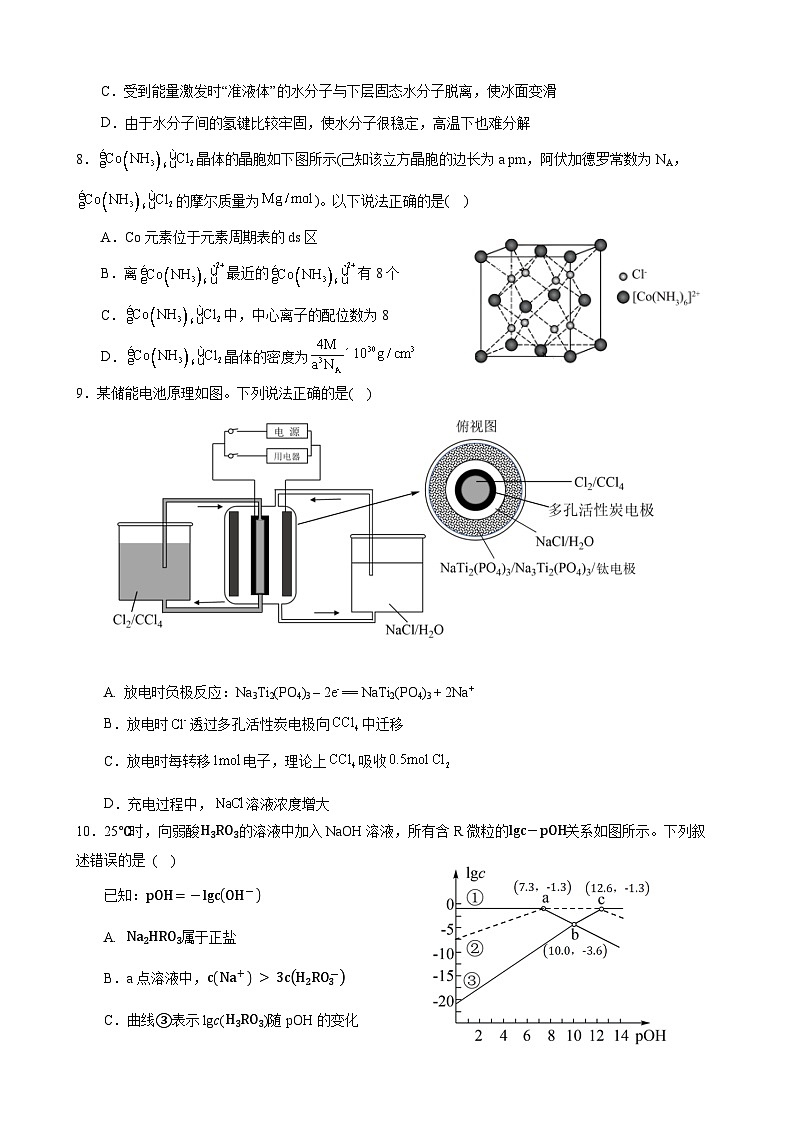
D.由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
8.晶体的晶胞如下图所示(己知该立方晶胞的边长为a pm,阿伏加德罗常数为NA, 的摩尔质量为)。以下说法正确的是( )
A.C元素位于元素周期表的ds区
B.离最近的有8个
C.中,中心离子的配位数为8
D.晶体的密度为
9.某储能电池原理如图。下列说法正确的是( )
A. 放电时负极反应:Na3Ti2(PO4)3 – 2e- == NaTi2(PO4)3 + 2Na+
B.放电时透过多孔活性炭电极向中迁移
C.放电时每转移电子,理论上吸收
D.充电过程中,溶液浓度增大
10.25℃时,向弱酸H3RO3的溶液中加入NaOH溶液,所有含R微粒的lgc-pOH关系如图所示。下列叙述错误的是 ( )
已知:pOH=-lgcOH-
A. Na2HRO3属于正盐
B.a点溶液中,cNa+ > 3cH2RO3-
C.曲线③表示lgc(H3RO3)随pOH的变化
D.反应 H3RO3+HRO32-⇌2H2RO3- 的平衡常数 K = 105.3
二、非选择题:本大题4小题,共60分。
11.(14分)[C(NH3)6]Cl3(三氯化六氨合钴)属于经典配合物,实验室以C为原料制备[C(NH3)6]Cl3的方法和过程如下:
I. 制备CCl2
已知:钴单质与氯气在加热条件下反应可制得纯净CCl2,钴单质在300℃以上易被氧气氧化;CCl2熔点为86℃,易潮解。
制备装置如图:
试剂X通常是 (填名称)。
试剂Z的作用为 。
CCl2中C2+的核外电子排布式为 。
为了获得更纯净的CCl2,开始点燃N处酒精喷灯的标志是 。
II.制备[C(NH3)6]Cl3——配合、氧化
已知:① C2+不易被氧化;[C(NH3)6]2+具有较强还原性,[C(NH3)6]3+性质稳定。
② [C(NH3)6]Cl3在水中的溶解度曲线如图所示:
③ 加入少量浓盐酸有利于[C(NH3)6]Cl3析出。
(5) 按图组装好装置→_______(填序号,下同)→打开磁力搅拌器→控制温度在10℃以下→_______
→_______→加热至60℃左右,恒温20min→在冰水中冷却所得混合物,即有晶体析出(粗产品)。
① 缓慢加入H2O2溶液
② 滴加稍过量的浓氨水
③ 向三颈烧瓶中加入活性炭、CCl2、NH4Cl和适量水
(6) 氧化阶段发生反应的离子方程式为 。
(7) 粗产品可用重结晶法提纯:向粗产品中加入80℃左右的热水,充分搅拌后, ,冷却后向滤液中加入少量 ,边加边搅拌,充分静置后过滤,用无水乙醇洗涤晶体2~3次,低温干燥,得纯产品[C(NH3)6]Cl3。
12.(16分)铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含FeS2、CuO、SiO2等杂质)制备NaBiO3的工艺流程如下:
已知:i.Bi3+易水解;NaBiO3难溶于冷水。
ii.“氧化浸取”时,铋元素转化为Bi3+,硫元素转化为硫单质。
iii.Cu(OH)2(s)+4NH3(g)Cu[(NH3)4]2+(aq)+2OH-(aq) K=4.4×10-7
回答下列问题:
(1)为提高“氧化浸取”速率,采取的措施有:升高温度、___________(写出一条)。辉铋矿浸取率随温度的变化曲线如图,高于40℃时浸取率快速下降,其可能的原因是
“除铜”时发生反应:Cu2+(aq)+4NH3(g)Cu[(NH3)4]2+(aq) K=2×1013, 则___________。
(3) “转化”时,生成NaBiO3的离子方程式为 。
(4)已知酸性环境下,NaBiO3可以将Mn2+氧化成MnO4-(BiO3-被还原成Bi3+)。可通过一个原电池装置来证明, ① 请在下图中的方框内标出溶液中溶质的化学式,
② 并写出负极的电极反应式:___________。
甲同学取NaBiO3产品w g, 加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用aml·L-1 H2C2O4标准溶液滴定生成的MnO4-,当溶液紫红色恰好褪去时,消耗b mL标准溶液。甲同学测得产品的纯度为_______(用含w、a、b的代数式表示)。乙同学认为甲同学的测量数据不一定准确,若排除实验仪器和操作的影响因素,还需进行的操作是________
已知:5NaBiO3+2Mn2++14H+=5Bi3++2MnO+5Na++7H2O
(15分)含有吡喃萘醌骨架的化合物常具有抗菌、抗病毒等生物活性,一种合成该类化合物的路线如下(部分反应条件已简化):
回答下列问题:
(1) 写出A→B的反应方程式: 。
(2) 从F转化为G的过程中所涉及的反应类型是 、 ;
(3) 物质G含氧官能团的名称为 ;
(4) 依据上述流程提供的信息,下列反应产物J的结构简式为 ;
物质Ⅰ中碳原子的杂化方式为 ,I分子中含有 个手性碳原子。
(6) (呋喃)是一种重要的化工原料,其能够发生银镜反应的同分异构体中。除H2C=C=CH-CHO外,还有 种;
(7) 甲苯与溴在FeBr3催化下发生反应,会同时生成对溴甲苯和邻溴甲苯,依据由C到D的反应信息,设计以甲苯为原料选择性合成邻溴甲苯的路线 (无机试剂任选)。
14.(15分)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应I:
反应II:
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时的选择性随温度的变化如图。其中:
已知反应: ,。 则反应II的焓变 ,反应II的自发条件为 。
A. 高温 B. 高压 C. 低温 D. 低压
(2) 温度高于300℃,CO2平衡转化率随温度升高而上升的原因是 。
(3) 220℃时,在催化剂作用下CO2与H2反应一段时间后,测得的选择性对应图中A点数据。下列说法正确的是___________。
A.其他反应条件不变,增大压强一定可提高平衡时的选择性
B.其他反应条件不变,改变催化剂,的选择性不会改变
C.其他反应条件不变,升高温度,CO2的转化率一定随着温度的升高而降低
D.其他反应条件不变,提高投料时的氢碳比,能提高CO2平衡转化率
(4) 若起始投料比为,发生主要反应I和反应II不考虑其他副反应,则288℃时的反应I的平衡常数为 。
(5) 国内外目前生产苯乙烯的方法主要是乙苯脱氢法,反应原理如下:
(g) (g)+H2(g) ∆H1;实际生产过程中,通常向乙苯中掺入水蒸气,保持体系总压为常压(101kPa)的条件下进行反应。乙苯的平衡转化率与温度、投料比m[m=] 的关系如图1所示。
① 掺入水蒸气的目的是 ;
② 投料比(m1、m2、m3)由大到小的顺序为 ;
③ 若投料比m=1:9,反应温度为600℃,并保持体系总压为常压的条件下进行反应,下列事实不能作为该反应达到平衡的依据的是 (填选项字母)。
V正(乙苯)=v逆(苯乙烯)
容器内气体密度不再变化
容器内气体的平均相对分子质量不再变化
苯乙烯的体积分数不再变化
e.容器内苯乙烯与H2的物质的量之比不再变化
2024届高三质优校阶段检测
(化学参考答案)
一、选择题答题表(本题共10小题,每题4分,共40分)
填空题(本题共4小题,共60分)
备注:化学方程式和离子方程式书写化学式正确但未配平、反应条件写错、沉淀气标使用错扣1分
(14分)
饱和食盐水或饱和氯化钠溶液 (2分) 未写饱和不得分
吸收多余Cl2,防止污染空气;(1分)防止空气中的水蒸气进入收集器中,导致CCl2潮解(1分) 共(2分)
1s22s22p6 3s23p63d7或 【Ar】3d7 (2分)
硬质玻璃管中充满黄绿色气体(或收集器中出现黄绿色气体) (2分)
③②① (2分)
2[C(NH3)6]2++H2O2+2NH=2[C(NH3)6]3++2NH3•H2O或2[C(NH3)6]2++H2O2+2NH=2[C(NH3)6]3++2H2O+2NH3 (2分)
(7) 趁热过滤 浓盐酸 (各1分)
12 (16分)
(1) 将辉铋矿粉碎研磨(或适当提高盐酸浓度或搅拌等) (2分)
高于40℃时,盐酸挥发或双氧水分解(2分) 答到一点给2分?
(2) (2分)
(3) (2分)
(4) = 1 \* GB3 ① (2分)
= 2 \* GB3 ② Mn2++4H2O-5e―=MnO4―+8H+ (2分)
或 (2分) 平行实验或重复实验2~3次(2分)
13.(15分)
(1) (2分)
(2)消去反应 加成反应 (各1分)
(3)醚键 (1分)
(4) (2分)
(5) sp2、sp3 答对一个得1分(2分) 2 (1分)
(6) 4 (2分)
(7) (3分)
14.(15分)
(1) (2分) C (1分)
(2) 反应I的,反应II的,温度升高使CO2转化为的平衡转化率上升,使CO2转化为的平衡转化率下降,且上升幅度超过下降幅度 (2分)、
或者反应I的,反应II的,温度升高使CO2转化为的平衡转化率上升,吸热反应占了主导引起的 或意思答到就可得分
(3) AD (2分)
(4) (2分) 写计算式不得分
(5) 保持体系的压强为常压,掺入水蒸气相当于减压,平衡正向移动,增大乙苯的转化率 e (各2分)
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3−、K+
NaHSO4
3Fe2++NO3−+4H+=3Fe3++NO↑+2H2O
B
Ba2+、HSO3−、Cl−
H2SO4
Ba2++SO42−=BaSO4↓
C
H+、S2O32−、Cl−
少量NaOH
H++OH−=H2O
D
S2−、CO32−、Na+
少量FeCl3
S2−+2Fe3+=2Fe2++S↓
题号
1
2
3
4
5
6
7
8
9
10
答案
D
C
A
B
A
B
C
D
A
B
福建省名校联盟全国优质校2024届高三下学期2月大联考化学试题(Word版附解析): 这是一份福建省名校联盟全国优质校2024届高三下学期2月大联考化学试题(Word版附解析),共11页。试卷主要包含了考试结束后,将答题卡交回,一种芳香族化合物结构如图等内容,欢迎下载使用。
福建省百校2023-2024学年高三下学期正月联考化学试题(Word版附解析): 这是一份福建省百校2023-2024学年高三下学期正月联考化学试题(Word版附解析),共15页。试卷主要包含了叔丁醇的过程如下等内容,欢迎下载使用。
浙江省四校联盟2023-2024学年高三上学期12月联考化学试题(Word版附答案): 这是一份浙江省四校联盟2023-2024学年高三上学期12月联考化学试题(Word版附答案),共13页。试卷主要包含了考试结束后,只需上交答题卷,下列说法正确的是,下列反应的离子方程式正确的是等内容,欢迎下载使用。












