

海南省海口市部分中学2023-2024学年高一上学期期末考试化学试题(重点班)(含答案)
展开
这是一份海南省海口市部分中学2023-2024学年高一上学期期末考试化学试题(重点班)(含答案),共7页。试卷主要包含了工业上制备金刚砂,对于反应,1ml B.0等内容,欢迎下载使用。
可能用到的相对原子质量:K 39 H 1 C 12 O 16
选择题(共14题,每题3分,共42分。下列每题只有一个选项符合题意)
1.在一定温度下,向饱和NaOH溶液中加入一定量的Na2O2粉末,待充分反应后恢复至原温度,下列判断正确的是( )
A.溶液中的Na+数目减少,溶质的浓度不变
B.溶液中有晶体析出,且Na+数目不变
C. 溶液中有气体逸出,且Na+数目增加
D. 溶液中Na+数目增加,溶质的浓度减小
2.工业上制备金刚砂(化学式为SiC)的反应为:SiO2+ 3C SiC+2CO↑ 则氧化剂和还原剂的物质的量之比为( )
A.1:3 B.3:1 C. 5:3 D. 1:2
3.对于反应:TiCl4+4Na == 4NaCl+Ti,下列说法正确的是 ( )
A.该反应说明钠是强还原剂,可用于冶炼金属 B.Ti是氧化产物
C.该反应条件是TiCl4在熔融状态或水溶液中 D.TiCl4是还原剂
4.下列检验离子的方法及现象描述正确的是( )
A.检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解
B.检验Cl-:确定溶液中无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解
C.检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色
D.检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红
5在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5ml,Mg2+为0.5ml,则SO42-的物质的量为 ( ) ( )
A.0.1ml B.0.5ml C.0.15ml D.0.25ml.
6.下列有关阿佛加德罗常数(NA)的说法错误的是 ( )
A.32gO2所含的原子数目为NA B.0.5mlH2O含有的原子数目为1.5NA
C.1mlH2O含有的H2O分子数目为NA D.05NA个氯气分子的物质的量是0.5ml
7..等质量的钠进行下列实验,其中生成氢气最多的是 ( )
A.将钠投入到足量水中 B.将钠用铝箔包好并刺一些小孔,再放人足量的水中
C.将钠放入足量稀硫酸中 D.将钠放入足量稀盐酸中
8..下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是 ( )
A.Na+、Ba2+、Cl、SO42-B. Ca2+、HCO3、C1、K+
C.MnO4、K+、I、H+D. H+ 、Cl 、Na+ 、CO32
9.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700C时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
10.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.标准状况下,2.24 L水中含有0.1 NA个水分子
C.在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.17g 氨气所含电子数目为10NA
11.下列各组中的离子,能在溶液中大量共存的是 ( )
A、 H+ Na+ CO32- Cl- B、 Ba2+ Na+ Cl- SO42-
C、 K+ H+ SO42- OH- D、 Ag+ Al3+ NO3- H+
12.已知常温下在溶液中可发生如下两个离子反应:Ce4+ + Fe2+ = Fe3++ Ce3+ ,Sn2+ + 2Fe3+ =2 Fe2++ Sn4+ 。由此可以确定Fe2+、Ce3+、Sn2+ 三种离子的还原性由强到弱的顺序是( )
A.Sn2+ 、Fe2+、Ce3+ B.Sn2+ 、Ce3+ 、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+ 、Ce3+
13.只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂是( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
14.同体积、同物质的量浓度的Na2SO4、MgSO4、Al2(SO4)3溶液中SO42-的个数比为( )
A.1:1:3 B. 3:2:1 C.1:2:3 D.2:1:2
非选择题(共58分)
15.相同物质的量的O2和O3的质量比为____________;分子个数比为______________,所含氧原子的个数比为________________。
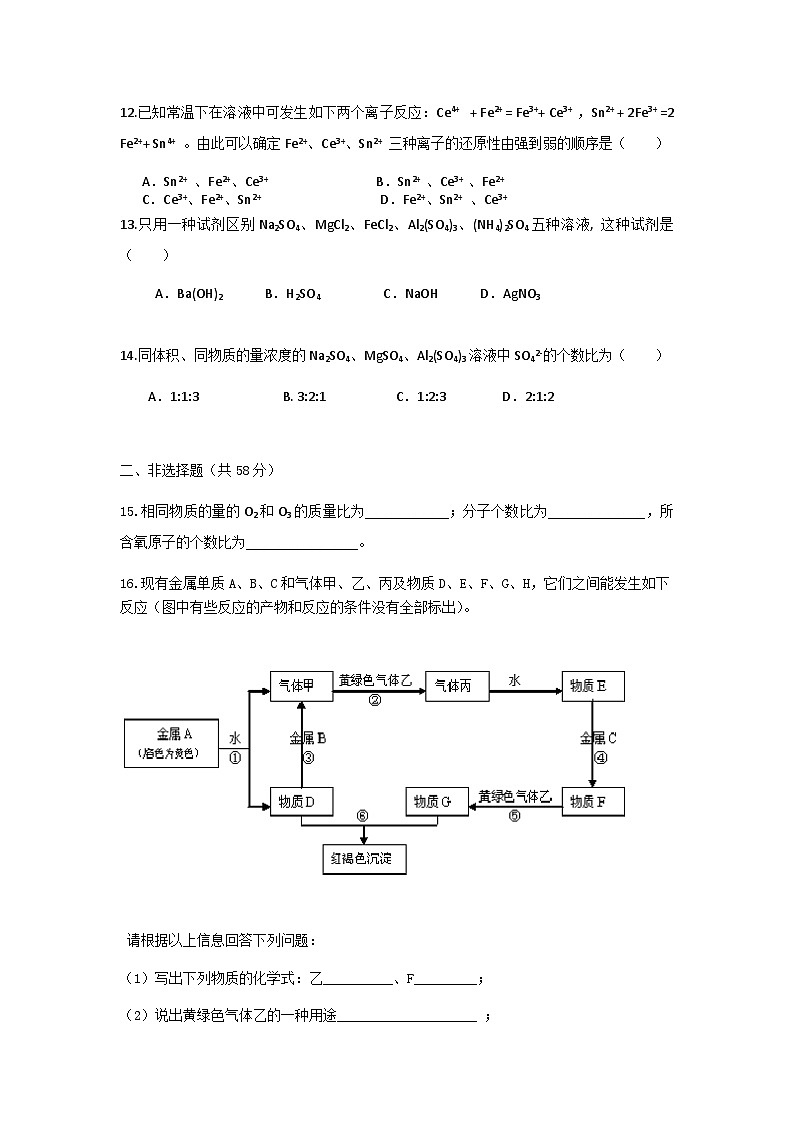
16.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙__________、F_________;
(2)说出黄绿色气体乙的一种用途____________________ ;
(3)实验室检验G中所含的金属离子时,常选用的试剂是_______ ___;
(4)反应③的化学方程式为________________________________________;
(5)反应⑥的离子方程式为________________________________________ 。
17.还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是 ;
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而 Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 ;
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式
。
18.某同学做同周期元素性质递变实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请从表中实验现象(Ⅱ)中分别选出(Ⅰ)对应的现象,将其序号(A、B、C……)填入(Ⅲ)中,并写出相应的化学方程式:
(1)通过以上实验分析同周期元素的符号是_____________________________;
(2)从实验结果可以得出的结论是_____________________________________ ;
(3)从结构理论上简单说明具有上述结论的原因__________________________。
19.在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
请回答该实验中的问题。
(1)写出该反应的化学方程式 ;
(2)实验前必须对整套装置进行的操作是 ;
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是 ;
(4)干燥管中盛装的物质可以是 ,
作用是 ;
(5)试管中收集到的气体是 ,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行 ,这一操作的目的是 。
20.将Na2CO3和NaHCO3混合物19g,充分加热后,收集到CO2有1.12L(标准状况),冷却后将剩余固体溶于300ml水中,求:
(1)原混合物中Na2CO3的质量。
(2) 配制的溶液的物质的量浓度
参考答案
一、选择题(共14题,每题3分,共42分。下列每题只有一个选项符合题意)
二、非选择题(共58分)
15.2:3;1:1;2:3
⑴Cl2;FeCl2;
(2)制漂白粉、漂白液、盐酸、盐酸盐等;
⑶KSCN(或NaOH等)
⑷2Al+2NaOH+2H2O =2NaAlO2+3H2↑。
⑸Fe3++3OH-=Fe(OH)3↓
17.⑴ C6H12O6
⑵还原性
(3)还原作用
(4) 保护FeSO4不被空气中的氧气氧化。
(5) 2Fe3+ + Cu = 2Fe2+ + Cu2+。
18. Ⅰ Ⅱ 化学方程式
B Mg + 2H2O ==== Mg(OH)2 + H2↑
A 2Na + 2H2O === 2NaOH + H2↑
D Mg + 2HCl ==== MgCl2 + H2↑
C 2Al + 6HCl ==== 2AlCl3 + 3H2↑
(1)Na、Mg、Al
(2)在同一周期内,元素的金属性随着原子序数的递增逐渐减弱
(3)同一周期的元素,从左到右随原子序数的递增,最外层电子数逐渐增加,原子半径逐渐减少,原子核对最外层电子的吸引力逐渐增强,因而失电子的能力逐渐减弱,表现在化学性质上,即元素的金属性逐渐减弱。
19.(1)3Fe+4H2O(g) eq \(\s\up8(△),═,\s\d4()) Fe3O4+4H2
(2)检验装置的气密性
(3)为(硬质玻璃管内Fe与水蒸气的反应)实验提供(持续不断的)水蒸气
(4)碱石灰(或其它固体干燥剂);干燥反应产生的H2
(5)H2;验纯;防止点燃时,氢气因含有氧气而爆炸
20.(1)10.6g(2)0.5ml/L
实验方案(Ⅰ)
实验现象(Ⅱ)
答案(Ⅲ)
Ⅰ
Ⅱ
化学方程式
1、用砂纸擦过的镁带与沸水反应,再向反应液中滴加酚酞试液
A、浮于水面,熔成小球,在水面上不定向移动,随之消失,溶液变成红色
2、钠与滴有酚酞试液的冷水反应
B、产生大量气体,可在空气中燃烧,溶液变成浅红色
3、镁带与2ml.L-1的盐酸反应
C、反应不十分剧烈,产生的气体可在空气中燃烧
4、铝与2ml.L-1的盐酸反应
D、剧烈反应,产生的气体可在空气中燃烧
相关试卷
这是一份96,海南省农垦中学2023-2024学年高一上学期期末考试化学试题(非重点班),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份海南省海口市第一中学2023-2024学年高三上学期期末考试化学试题(重点班),共5页。试卷主要包含了高温下硫酸亚铁发生如下反应,下列离子方程式正确的是,下列离子方程式的书写正确的是,下列反应的离子方程式正确的是,用0等内容,欢迎下载使用。
这是一份海南省海口市第一中学2023-2024学年高三上学期期末考试化学试题(非重点班),共6页。试卷主要包含了对某酸性溶液分别进行如下实验等内容,欢迎下载使用。









