

所属成套资源:高一化学同步讲与练-题型分类归纳(人教2019必修第二册)
高中人教版 (2019)实验活动6 化学能转化成电能精品课堂检测
展开
这是一份高中人教版 (2019)实验活动6 化学能转化成电能精品课堂检测,文件包含实验活动6化学能转化成电能原卷版docx、实验活动6化学能转化成电能解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
知识梳理
【实验目的】
1.理解氧化还原反应在化学能转化成电能过程中的作用,体会化学的价值。
2.认识原电池的构成要素及其作用。
【实验用品】烧杯、导线、电流表。锌片、铜片、石墨棒、稀硫酸。
【实验步骤】
电极材料的实验
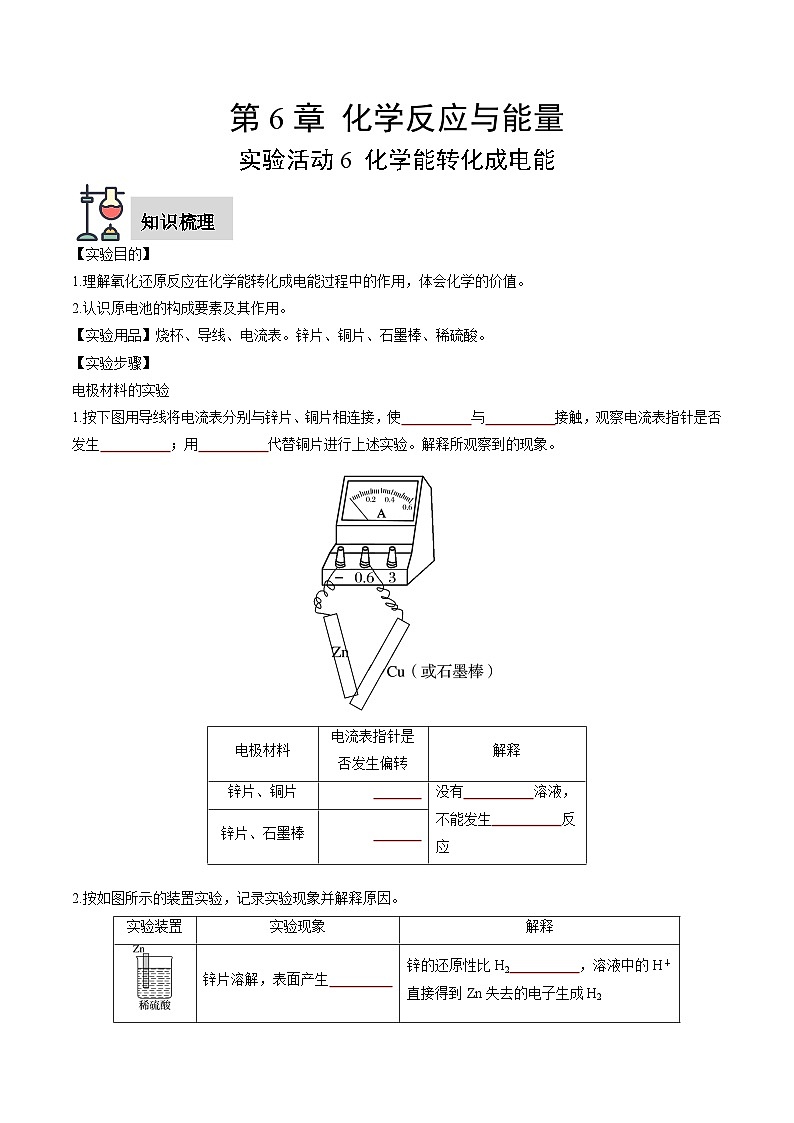
1.按下图用导线将电流表分别与锌片、铜片相连接,使锌片与铜片接触,观察电流表指针是否发生偏转;用石墨棒代替铜片进行上述实验。解释所观察到的现象。
2.按如图所示的装置实验,记录实验现象并解释原因。
3.按如图所示的装置实验,记录实验现象并解释原因。
典例分析
题型一:原电池原理
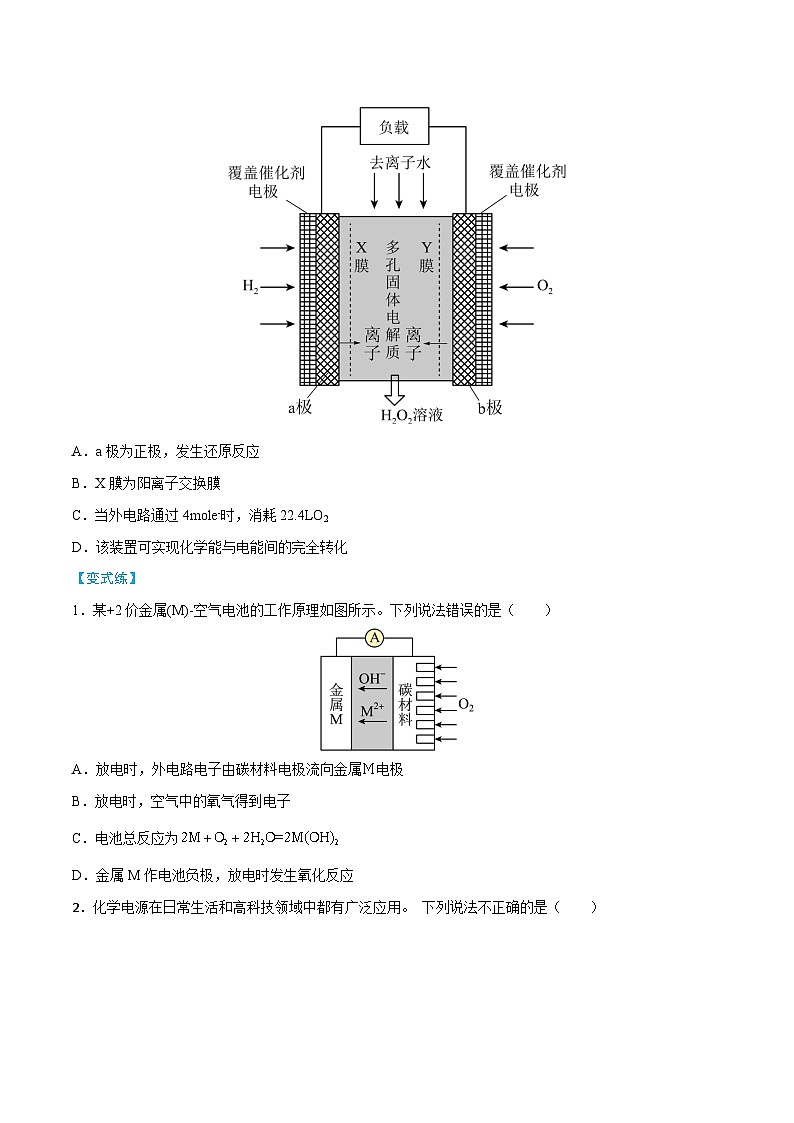
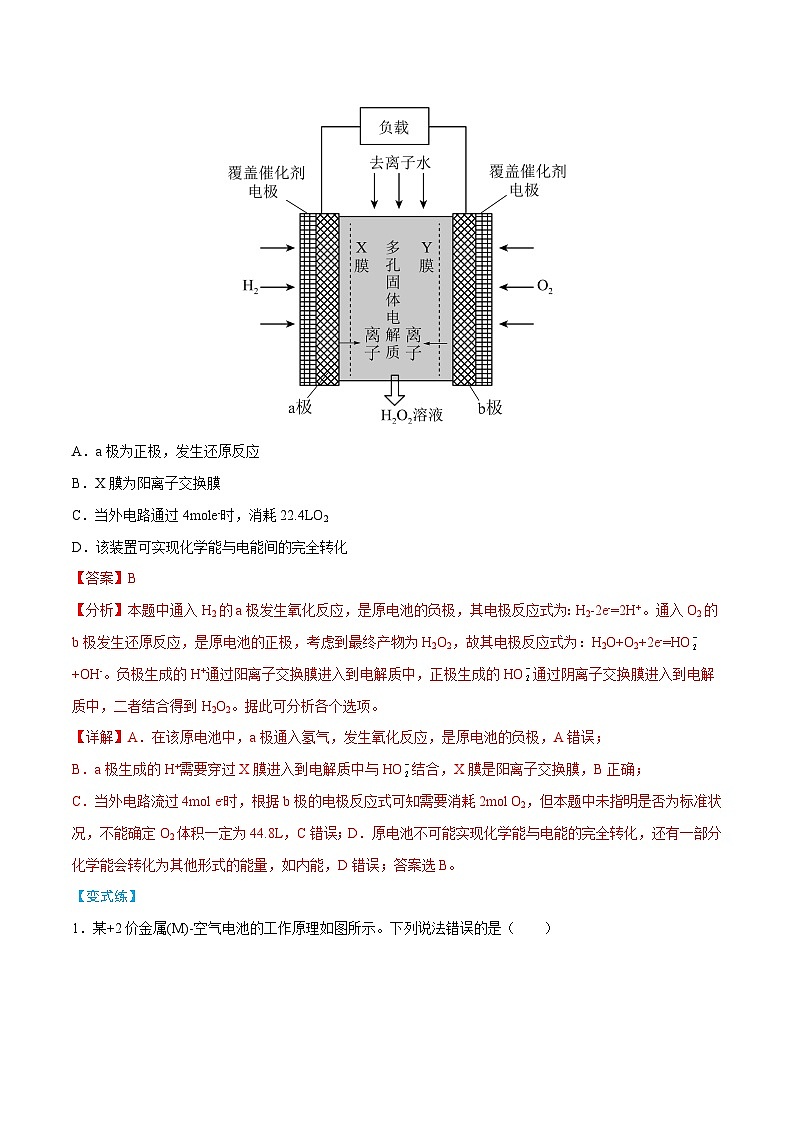
【典例1】《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示。下列说法正确的是( )
A.a极为正极,发生还原反应
B.X膜为阳离子交换膜
C.当外电路通过4mle-时,消耗22.4LO2
D.该装置可实现化学能与电能间的完全转化
【答案】B
【分析】本题中通入H2的a极发生氧化反应,是原电池的负极,其电极反应式为:H2-2e-=2H+。通入O2的b极发生还原反应,是原电池的正极,考虑到最终产物为H2O2,故其电极反应式为:H2O+O2+2e-=HO+OH-。负极生成的H+通过阳离子交换膜进入到电解质中,正极生成的HO通过阴离子交换膜进入到电解质中,二者结合得到H2O2。据此可分析各个选项。
【详解】A.在该原电池中,a极通入氢气,发生氧化反应,是原电池的负极,A错误;
B.a极生成的H+需要穿过X膜进入到电解质中与HO结合,X膜是阳离子交换膜,B正确;
C.当外电路流过4ml e-时,根据b极的电极反应式可知需要消耗2ml O2,但本题中未指明是否为标准状况,不能确定O2体积一定为44.8L,C错误;D.原电池不可能实现化学能与电能的完全转化,还有一部分化学能会转化为其他形式的能量,如内能,D错误;答案选B。
【变式练】
1.某+2价金属(M)-空气电池的工作原理如图所示。下列说法错误的是( )
A.放电时,外电路电子由碳材料电极流向金属M电极
B.放电时,空气中的氧气得到电子
C.电池总反应为
D.金属M作电池负极,放电时发生氧化反应
【答案】A
【分析】M-空气电池中,金属M失去电子生成M2+,为负极,正极氧气得到电子生成OH-,则电极M为负极,碳材料电极为正极,电池总反应为:2M+O2+2H2O═2M(OH)2,电池工作时,电子由负极(M)经外电路流向正极(碳材料),据此分析解答。
【详解】A.电池工作时,电子由负极经外电路流向正极,即外电路电子由M电极流向碳材料电极,故A错误;B.放电时,正极(碳材料)上空气中的氧气得到电子生成OH-,故B正确;C.结合分析可知,电池总反应为:2M+O2+2H2O═2M(OH)2,故C正确;D.原电池工作时,负极金属M失去电子生成M2+,发生氧化反应,故D正确;故选:A。
2.化学电源在日常生活和高科技领域中都有广泛应用。 下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.乙:正极的电极反应式为 Ag2O+2e−+H2O=2Ag+2OH−
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:在铅蓄电池中,负极材料为铅,在放电过程中被氧化
【答案】A
【详解】A.甲为铜锌原电池,锌为负极,铜为正极,H+在铜上得电子发生还原反应,所以Cu电极附近溶液中H+浓度减小,A错误;B.乙为纽扣电池,正极为Ag2O得电子发生还原反应,反应式为Ag2O+2e-+H2O═2Ag+2OH-,B正确;C.丙为锌锰干电池,锌筒作负极,发生氧化反应被消耗,所以锌筒会变薄,C正确;D.丁为铅蓄电池,放电时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极材料为铅,在放电过程中被氧化,D正确;故答案为:A。
题型二:原电池电子流向判断及应用
【典例2】科学家发明了电动势法测水泥的初凝时间,原理如图所示,反应的总方程式为:。电池工作时,下列有关说法正确的是( )
A.Cu电极质量增大
B.为电池负极
C.电子从Cu经溶液流向电极
D.2ml Cu和的总能量低于和2ml Ag的总能量
【答案】A
【分析】根据电池反应式知,较活泼金属铜作负极,氧化银作正极,负极上铜失电子和氢氧根离子生成氧化铜和水,电子从负极铜经导线流向正极氧化银,氧化银上有大量电子,根据异性相吸原理,溶液中阳离子向正极移动;电流从正极氧化银流向负极铜。
【详解】A.Cu电极作为负极,失去电子,生成Cu2O,质量增加,A正确;
B.在总反应中作氧化剂,氧化剂在原电池中作正极,B错误;
C.在原电池中,电子是从负极经导线流向正极,不经过溶液,C错误;D.由题意知,该装置组成了原电池,反应过程中化学能转化为电能,反应物的总能量高于生成物的总能量,故2ml Cu和 1ml Ag2O 的总能量高于 1ml Cu2O 和 2ml Ag 的总能量,D错误;故选A。
【变式练】
1.下列关于下图所示原电池装置的说法中,不正确的是( )
A.Cu为原电池的正极
B.能将化学能转化为电能
C.电子从Cu经导线流向Zn
D.Cu上发生的反应为2H++2e-=H2↑
【答案】C
【分析】图示原电池装置中,Zn比Cu活泼,Zn作负极,Zn失去电子,发生的电极反应为,Cu作正极本身不反应,硫酸作电解质,溶液中氢离子在正极得电子,发生的电极反应为,
【详解】A.根据上述分析,Cu为原电池的正极,A正确;B.该装置为原电池,能将化学能转化为电能,B正确;C.Zn失去电子,经导线流向Cu,氢离子在铜电极得电子产生氢气,C错误;
D.Cu作正极,发生的电极反应为,D正确;
答案选C。
2.将铜片、锌片和CuSO4溶液组装成原电池装置,当导线中有1ml电子通过时,下列说法不正确的是( )
A.溶液中移向锌电极
B.铜片作正极,Cu在正极发生还原反应
C.锌片质量减少65g,铜片质量增加32g
D.电子由锌片通过导线流向铜片
【答案】C
【详解】A.将铜片、锌片和CuSO4溶液组装成原电池装置,锌为活泼金属,锌作负极,铜做正极,根据阴离子移向负极,因此溶液中移向锌电极,故A正确;B.铜片作正极,溶液中的铜离子在正极得到电子发生还原反应,故B正确;C.锌片质量减少65g即1ml,根据Zn-2e-=Zn2+,转移2ml电子,铜片发生Cu2++2e-=Cu,因此铜片质量增加1ml×64 g∙ml−1=64g,故C错误;D.负极是锌,失去电子,正极是铜,铜离子在正极得到电子,因此电子由锌片通过导线流向铜片,故D正确。综上所述,答案为C。
跟踪训练
一、单选题
1.下列对于原电池装置的说法错误的是( )
A.放电时负极发生还原反应
B.放电时阴离子移向负极
C.放电时电子从负极出发经外电路移向正极
D.放电时电池装置中的化学能转化为电能
【答案】A
【详解】A.放电时负极失去电子发生氧化反应,A错误;B.放电时负极失去电子而带上正电荷,则阴离子移向负极,B正确;C.放电时负极失去电子,正极得到电子,电子从负极出发经外电路移向正极,C正确;D.放电时为原电池,电池装置中的化学能转化为电能,D正确;故答案为A。
2.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag。下列有关说法错误的是( )
A.正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极
C.电池工作时,OH-向Cu电极移动
D.2mlCu和1mlAg2O的总能量高于1mlCu2O和2mlAg的总能量
【答案】B
【详解】A.由总反应知Ag2O得电子变为Ag,则正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,A正确;B.Cu失去电子,为负极,则Ag2O/Ag为正极,电子从Cu经外电路流向Ag2O/Ag电极,电子不能通过溶液,B错误;C.阴离子向负极移动,故OH-向Cu电极移动,C正确;D.此装置能量转化为化学能转化为电能,即反应物总能量高于生成物总能量,故2mlCu和1mlAg2O的总能量高于1mlCu2O和2mlAg的总能量,D正确;故答案为B。
3.下列说法正确的是( )
A.图1所示装置能将化学能转化为电能
B.图2所示反应为吸热反应
C.锌锰干电池中,锌筒作负极
D.蓄电池充电时,没有发生氧化还原反应
【答案】C
【详解】A.图1没有形成闭合电路,不能构成原电池,所示装置不能将化学能转化为电能,故A错误;B.图2所示反应,生成物总能量低于反应物总能量,为放热反应,故B错误;C.锌锰干电池中,锌失电子发生氧化反应,锌筒作负极,故C正确;D.蓄电池充电时,阳极发生氧化反应、阴极发生还原反应,发生氧化还原反应,故D错误;选C。
4.氢燃料电池是目前最具发展前景的新能源方式,如能普及并应用在车辆及其他高污染之发电工具上,将能显著减轻空气污染及温室效应。下列有关氢燃料电池的说法正确的是( )
A.通入氢气的电极发生还原反应
B.电解液中阳离子向通入氢气的方向移动
C.正极的电极反应式为:O2+4H++4e-═2H2O
D.放电过程中电解液的浓度不断增大
【答案】C
【详解】A.通入氢气的电极是负极,发生氧化反应,A错误;B.电解液中阳离子向正极移动,反应中通入氧气的一端为正极,即电解液中阳离子向通入氧气的方向移动,B错误;C.正极上,氧气与氢离子结合生成水,电极反应式为:O2+4H++4e-═2H2O,C正确;D.放电过程中不断的生成水,电解液的浓度减小,D错误;故选C。
5.有A、B、C、D四种金属,当A、B用导线连接浸泡在稀硫酸中,组成原电池时,A的质量减小;将A、C分别投入等浓度的盐酸中,C比A反应剧烈;将金属B浸入到D的盐溶液中,有D生成。则A、B、C、D金属活动性由强到弱的顺序为( )
A.B.
C.D.
【答案】D
【详解】由题干信息,当A、B用导线连接浸泡在稀硫酸中,组成原电池时,A的质量减小,说明A为负极,故A比B活泼;将A、C分别投入等浓度的盐酸中,C比A反应剧烈,故C比A活泼;将金属B浸入到D的盐溶液中,有D生成,故B比D活泼,综上分析可知,A、B、C、D金属活动性由强到弱的顺序为C>A>B>D,故答案为:D。
6.将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计(装置如右图),若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g,则该过程中产生H2(标准状况下)的体积为( )
A.2.24LB.3.36LC.4.48LD.6.72L
【答案】C
【详解】由题意可知,该原电池中,锌易失电子发生氧化反应而作负极,电极反应式为Zn-2e-=Zn2+,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,则负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,锌和稀硫酸反应离子方程式为2H++Zn=Zn2++H2↑,根据反应化学方程式得氢气的物质的量n(H2)=n(Zn)==0.2ml,标况下H2的体积为V(H2)=0.2ml×22.4L/ml=4.48L,C选项符合题意;答案为C。
7.银锌纽扣电池如图,电池反应式为:,下列说法正确的是( )
A.锌作正极
B.负极发生还原反应
C.负极的电极方程式为:
D.电池工作时,电流从经导线流向Zn
【答案】D
【详解】A.在反应中,Zn的化合价升高,则Zn作还原剂,发生氧化反应,故Zn作负极,A错误;B.负极发生氧化反应,B错误;C.负极的电极方程式为:Zn+2OH--2e-=Zn(OH)2,C错误;D.Ag2O作正极,故电池工作时,电流从Ag2O经导线流向Zn,D正确;故选D。
8.图为某锌-铜原电池示意图,下列说法正确的是( )
A.电流由铜片通过导线流向锌片
B.锌片为负极,且发生还原反应
C.正极电极反应式:2H++ 2e-= H2↑
D.该装置能将化学能完全转变为电能
【答案】A
【详解】锌-铜、硫酸铜原电池中,锌比铜活泼,故锌为负极,发生氧化反应,电极反应为:Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应为:Cu2++2e-=Cu,据此分析解题:
A.原电池中电流由正极经导线流向负极,故电流由铜片通过导线流向锌片,A正确;B.由分析可知,锌片为负极,且发生氧化反应,B错误;C.由分析可知,正极电极反应式:Cu2++2e-=Cu,C错误;D.原电池是将化学能直接转化为电能的装置,但原电池工作过程中会发热,故该装置不能将化学能完全转变为电能,还转化为热能和其他形式的能量,D错误;故答案为:A。
二、实验题
9.已知可逆反应:据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路)。进行如下操作:
a.向烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
b.若改向烧杯中滴加溶液,发现微安表指针向前述相反方向偏转。
试回答下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?_______
(2)两次操作过程中指针偏转方向为什么相反?_______
(3)a操作过程中,棒发生的反应为_______
(4)b操作过程中,棒发生的反应为_______
【答案】(1)两次操作过程均能形成原电池,都是把化学能转化为电能
(2)因操作1中是负极,是正极;操作2中是正极,是负极,电子由负极流向正极,则指针偏转方向不同
(3)
(4)
【详解】(1)a.向(B)烧杯中逐滴加入浓盐酸,c(H+)变大,平衡正反应方向移动,构成原电池,放电,化学能转为电能,微安表指针偏转;b.若改向(B)烧杯中滴加40%NaOH溶液,平衡向逆反应方向移动,构成原电池,放电,化学能转为电能,微安表指针偏转;
故答案为:两次操作过程均能形成原电池,都是把化学能转化为电能。
(2)a.向(B)烧杯中逐滴加入浓盐酸,平衡正反应方向移动,构成原电池,C1是负极,C2是正极,放电,化学能转为电能,微安表指针偏转;b.若改向(B)烧杯中滴加40%NaOH溶液,平衡向逆反应方向移动,C1是正极,C2是负极,构成原电池,放电,化学能转为电能,电流方向与原来相反,微安表指针向前述相反方向偏转;故答案为:因操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极,电子由负极流向正极,则指针偏转方向不同。
(3)a.向(B)烧杯中逐滴加入浓盐酸,平衡正反应方向移动,构成原电池,C1是负极,发生氧化反应,反应式为:2I−−2e−=I2;故答案为:2I−−2e−=I2。
(4)b.若改向(B)烧杯中滴加40%NaOH溶液,平衡向逆反应方向移动,C2是负极,氧化反应,反应式为: ;故答案为:。
10.分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中Ⓐ为电流表。请回答下列问题:
(1)以下叙述中,正确的是_______(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中向铜片方向移动
(2)某同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
①正极的材料是_______,负极发生的电极反应式为:_______。
②外电路中的电子流向是:_______。
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是_______。
(3)Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应式为:_______。若电解液为氢氧化钠溶液,负极的电极材料为_______。
【答案】(1)CD
(2) 银(或Ag) Cu-2e-=Cu2+ 从铜电极流向银电极 0.05NA
(3) 2H++2e-=H2↑ 铝(或Al)
【详解】(1)A.如图甲,该装置没有形成闭合回路,不能形成原电池,故A错误;
B.甲烧杯中不能形成原电池,Cu与稀硫酸不反应,没有现象,装置乙为原电池,Zn比Cu活泼,Zn作负极,Cu作正极,电极反应式为,有气泡产生,故B错误;C.如图,甲装置中虽然没有形成原电池,但是Zn与硫酸发生反应,,减小,pH增大;装置乙为原电池,总反应为,减小,pH增大,故C正确;
D.装置甲为化学腐蚀,装置乙为原电池,所以装置乙反应生产气体的速率快,故D正确;E.装置乙为原电池,Zn比Cu活泼,Zn作负极,Cu作正极,电子从Zn极流出经外电路流向Cu极,故E错误;
F.在原电池中,阴离子向负极移动,装置乙为原电池,Zn比Cu活泼,Zn作负极,向Zn极移动,故F错误;
故填CD;
(2)①如图,电解质溶液为溶液,其中Cu比Ag活泼,Cu作负极,电极反应式为,Ag作正极,电极反应式为,故填银(或Ag);;
②该电池中,Cu作负极,Ag作正极,电子从Cu极流出,经外电路流向Ag极,故填从铜电极流向银电极;
③Cu作负极,电极反应式为,Ag作正极,电极反应式为,根据电极反应式,可知正极增重,生成5.4gAg时,转移电子数目为,故填;
(3)可以和电解质溶液发生反应的是负极,若两极都发生反应则活泼性较强的一极是负极;如图,若电解液为盐酸, 因Mg比Al活泼,所以Mg作为负极,Al为正极,负极电极反应式为;若电解液为氢氧化钠溶液,因Al能与NaOH反应,所以Al作负极,电极反应式为,Mg作正极,故填;铝(或Al)。电极材料
电流表指针是
否发生偏转
解释
锌片、铜片
否
没有电解质溶液,不能发生原电池反应
锌片、石墨棒
否
实验装置
实验现象
解释
锌片溶解,表面产生无色气泡
锌的还原性比H2强,溶液中的H+直接得到Zn失去的电子生成H2
①锌片溶解,表面产生无色气泡
②铜片表面无明显变化
铜的还原性比H2弱,不能置换H2,电子不能在溶液中移动,锌的电子不能转移到铜片,H+只能在锌片表面被还原成H2
①锌片溶解,表面产生无色气泡
②石墨棒表面无明显变化
石墨为惰性材料,不能置换H2,电子不能通过溶液转移到石墨棒,H+只能在锌片表面被还原成H2
实验材料
实验现象
解释
Zn、Cu、H2SO4
①锌片溶解
②铜片不溶解,表面产生无色气泡
③电流表指针偏转
锌失去的电子通过导线转移至铜片表面产生电流,溶液中的H+在铜片表面获得Zn失去的电子生成H2
Zn、石墨、H2SO4
①锌片溶解
②石墨棒表面产生无色气泡
③电流表指针偏转
锌失去的电子通过导线转移至石墨棒表面产生电流,溶液中的H+在石墨棒表面获得Zn失去的电子生成H2
Cu、石墨、H2SO4
铜片不溶解,电流表指针不偏转
铜的还原性比H2弱,不能发生氧化还原反应,没有电子转移,因而不能产生电流
相关试卷
这是一份高中化学人教版 (2019)必修 第二册实验活动9 乙醇、乙酸的主要性质优秀当堂检测题,文件包含实验活动9乙醇乙酸的主要性质原卷版docx、实验活动9乙醇乙酸的主要性质解析版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册实验活动7 化学反应速率的影响因素优秀测试题,文件包含实验活动7化学反应速率的影响因素原卷版docx、实验活动7化学反应速率的影响因素解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份人教版 (2019)必修 第二册实验活动6 化学能转化成电能精练,共14页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。










