



所属成套资源:备战2024年高考化学一轮复习(新高考专用)
考点14 氯及其化合物(核心考点精讲精练)-备战高考化学一轮复习(新高考专用)
展开
这是一份考点14 氯及其化合物(核心考点精讲精练)-备战高考化学一轮复习(新高考专用),文件包含考点14氯及其化合物核心考点精讲精练-备战高考化学一轮复习新高考专用原卷版docx、考点14氯及其化合物核心考点精讲精练-备战高考化学一轮复习新高考专用教师版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
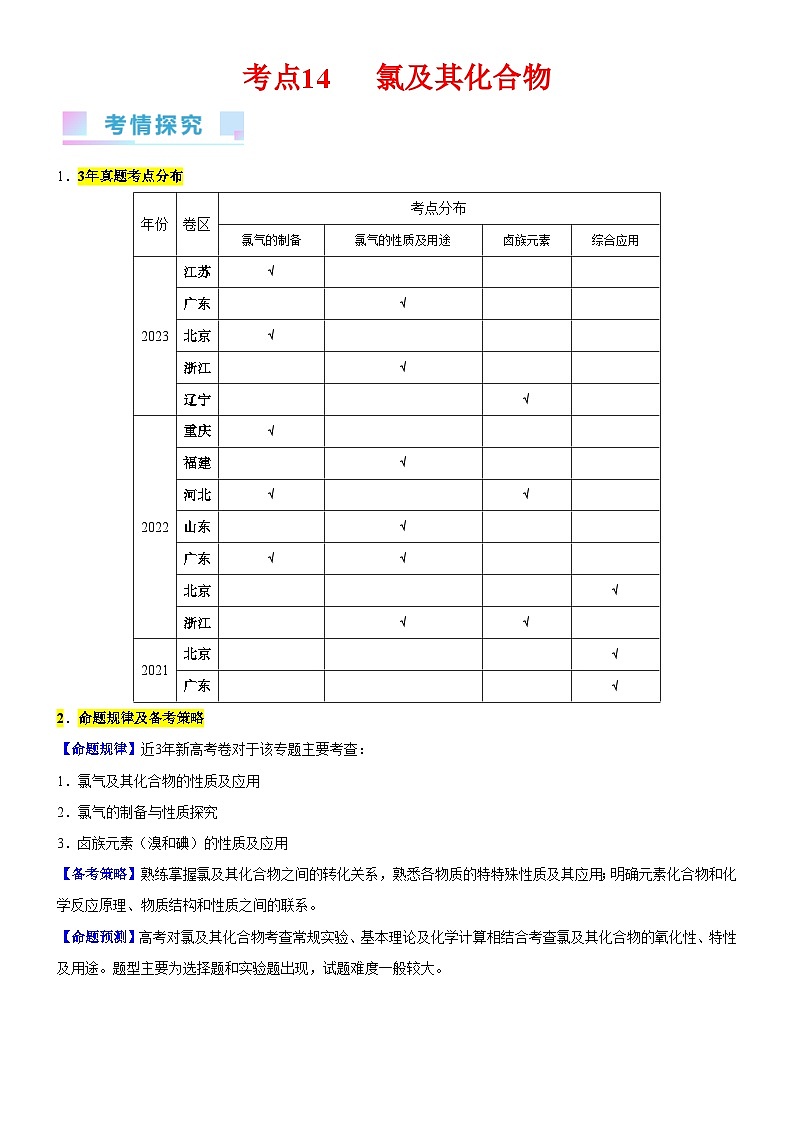
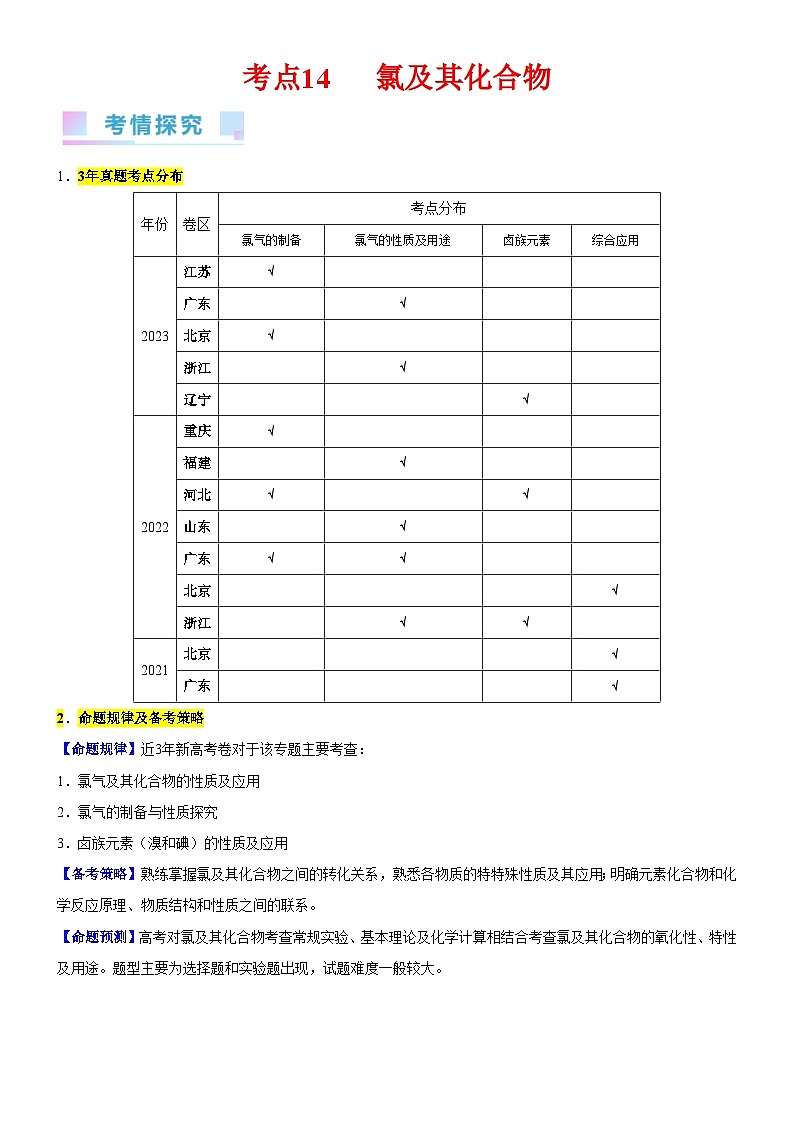
1.3年真题考点分布
2.命题规律及备考策略
【命题规律】近3年新高考卷对于该专题主要考查:
1.氯气及其化合物的性质及应用
2.氯气的制备与性质探究
3.卤族元素(溴和碘)的性质及应用
【备考策略】熟练掌握氯及其化合物之间的转化关系,熟悉各物质的特特殊性质及其应用;明确元素化合物和化学反应原理、物质结构和性质之间的联系。
【命题预测】高考对氯及其化合物考查常规实验、基本理论及化学计算相结合考查氯及其化合物的氧化性、特性及用途。题型主要为选择题和实验题出现,试题难度一般较大。
考法1 氯气的性质及制备
1.氯气的物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。闻有毒气体及未知气体的方法是用手在瓶口轻轻煽动,仅使极少量气体进入鼻孔。
2. 氯气的化学性质:氯气化学性质非常活泼,很容易得到电子,作强氧化剂,能与金属、非金属、水以及碱反应。
(1)与金属反应(与变价金属反应,均是金属氧化成高价态)
= 1 \* GB3 ①与钠反应:________________________(产生________________)
= 2 \* GB3 ②与铜反应:________________________(产生________________)
= 3 \* GB3 ③与铁反应:________________________(产生________________)
常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
(2)与非金属反应
= 1 \* GB3 ①H2+Cl22HCl(发出________色火焰,有________生成)——可用于工业制盐酸
H2+Cl22HCl(会发生________)——不可用于工业制盐酸
= 2 \* GB3 ②2P+3Cl22PCl3(氯气不足;产生白雾)
2P+5Cl22PCl5(氯气充足;产生白烟)
(3)与水反应:________________________________
①将氯气溶于水得到氯水(浅________色),氯水含多种微粒,其中有H2O、Cl2、HclO、Cl-、H+、OH-(极少量,水微弱电离出来的)。②氯气溶于水生成的HClO是一种极弱的酸,但是一种强氧化剂,能漂白、杀菌,它的漂白是一种氧化性漂白,与Na2O2、H2O2的漂白原理是一样的。③Cl2可使润湿的有色布条褪色,不能使干燥的有色布条褪色,说明Cl2没有漂白性,而是HClO起漂白作用。④Cl2使润湿石蕊试先变红后褪色,其原因是Cl2与H2O作用生成的酸使石蕊先变红,HClO强氧化性使变色后的石蕊氧化褪色(漂白)。⑤光照氯水,黄绿色逐渐褪色,溶液pH逐渐________(HClO转化成了盐酸)。⑥氯水应保存在棕色瓶中且置于阴凉处。
(4)与碱反应
Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气)
2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O(用于制漂粉精或漂白粉)
漂白液的有效成分为________,漂白粉(精)的有效成分为________。漂白粉之所以具有漂白性,原因是:Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO生成的HClO具有漂白性。漂白粉久置空气会失效(涉及两个反应):Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,↑,漂白粉变质会有CaCO3存在,外观上会结块,久置空气中的漂白粉加入浓盐酸会有CO2气体生成,含CO2和HCl杂质气体。所以,漂白粉应密闭保存,避免与空气接触。
(5)与某些还原性物质反应
= 1 \* GB3 ①2FeCl2+Cl2 = 2FeCl3
= 2 \* GB3 ②2KI+Cl2 = 2KCl + I2(使湿润的淀粉-KI试纸变________色,用于氯气的检验)
= 3 \* GB3 ③SO2+Cl2+2H2O = 2HCl + H2SO4(将SO2气体和Cl2气体混合后作用于有色溶液,漂白效果将大大减弱)自来水用氯水杀菌消毒,所以用自来水配制以下溶液如KI、KBr、FeCl2、Na2SO3、Na2CO3、NaHCO3、AgNO3、NaOH等溶液会变质。
(6)与某些有机物反应
= 1 \* GB3 ①CH4+Cl2 CH3Cl + HCl(取代反应)
= 2 \* GB3 ②CH2=CH2+Cl2 → CH2ClCH2Cl(加成反应)
3. 氯气的实验室制法
(1)实验原理:________________________________。
温馨提示:还可以使用KMnO4、K2Cr2O7、KClO3等作氧化剂与浓盐酸反应,使用以上物质时,反应不需要加热,如2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)实验装置:
①Cl2的净化用水或________洗气,除去混在Cl2中的HCl气体;用________除去混在Cl2中的水蒸气。②由于Cl2的密度比空气大,常用________法收集,还可用排饱和食盐水的方法收集。③用润湿的KI淀粉试纸检验(放在瓶口),如试纸变________,则表示Cl2已收满。④由于Cl2有毒,多余的Cl2不能直接排放,一般用________溶液吸收,而不能用水或澄清石灰水吸收。因Cl2在水中溶解度不大,澄清石灰水中溶解的Ca(OH)2的量很少,只能吸收少量的Cl2。
(3)验满方法:①将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,观察到试纸立即变蓝,则证明已集满。②将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸先变红后褪色,则证明已集满。③实验室制取Cl2时,常常根据集气瓶中气体的颜色判断是否收集满。
(4)注意事项:①必须用浓盐酸,MnO2与稀盐酸不反应;②为了减少制得的Cl2中HCl的含量,加热的温度不宜过高,以减少HCl的挥发;③实验结束后,先使反应停止并排出残留的Cl2,再拆卸装置,避免污染空气;④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
【典例1】(2023·枣阳市第一高级中学高三月考)下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )
【拓展延伸】
1.氯水性质的多样性
(1)H+表现酸性:如在Na2CO3溶液中加入氯水,有气泡产生,CO32―+H+== CO2↑+H2O;
(2)HClO表现强氧化性:如氯水漂白物质,用氯水杀菌、消毒;
(3)表现Cl―的性质:Ag+ + Cl― == AgCl↓;
(4)表现Cl2的性质:如向KBr溶液中滴加氯水,Cl2+2KBr== 2KCl+2Br2;
(5)多微粒同时表现:如将氯水加入石蕊试液中,观察到:先变红(H+作用),后褪色(HClO作用)。
2.新制氯水与久置氯水的比较
(1)新制氯水:浅黄绿色,有强氧化性和漂白性;含有Cl2、HClO、H2O、H+、Cl―、ClO―等微粒;
(2)久置氯水:无色,无强氧化性和漂白性,含有H2O、H+、Cl―等微粒。
【典例2】(2023·瑞金第一中学模拟预测)Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:______________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:_____________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
(4)装置④中的X试剂为______________。
(5)装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是____________。
(6)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 ml·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3ClO-+I-===3Cl-+IOeq \\al(-,3),IOeq \\al(-,3)+5I-+3H2O===6OH-+3I2,实验测得数据如下表所示。
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
Ⅲ.测定饱和氯水中氯元素的总量
(7)某小组设计的实验方案为:使用如图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是____________________________。(不考虑实验装置及操作失误导致不可行的原因)
(8) 资料:次氯酸会破坏酸碱指示剂;次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):________。
1.(2023·浙江绍兴·统考二模)下列关于元素及其化合物的性质说法不正确的是
A.将Cl2通入冷的石灰乳可制得漂白粉
B.用FeCl3溶液可检验工业废水中是否含有酚类物质
C.Al与氨水反应可生成H2
D.工业上可用Na2CO3溶液吸收氮氧化物,防止其污染环境
2.(2023·广东茂名·茂名市第一中学校考模拟预测)氯气性质的微型实验装置如图所示。①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有氢氧化钠溶液、石蕊溶液、淀粉—KI溶液、含KSCN的溶液,实验时滴几滴浓盐酸。下列说法不正确的是
A.③处先变红后褪色,是因为氯水具有酸性和强氧化性
B.④处变蓝色
C.⑤处变红色
D.本实验可推知氧化性
3.(2024·湖南长沙·湖南师大附中校考模拟预测)(三氯化六氨合钻)是合成其他含钴配合物的重要原料,实验中可由金属钴及其他原料制备。
已知:①在时恰好完全沉淀为;
②不同温度下在水中的溶解度如图所示。
(一)的制备
易潮解,C(Ⅲ)的氧化性强于,可用金属钴与氯气反应制备。实验中利用如图装置(连接用橡胶管省略)进行制备。
(1)用图中的装置组合制备,连接顺序为 (填标号)。装置B的作用是 。
(2)装置A中发生反应的离子方程式为 。
(二)的制备
步骤如下:
Ⅰ.在100mL锥形瓶内加入4.5g研细的,和5mL水,加热溶解后加入0.3g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下,并缓慢加入溶液。
Ⅲ.在60℃下反应一段时间后,经过________、________、过滤、洗涤、干燥等操作,得到晶体。
根据以上步骤,回答下列问题:
(3)在步骤Ⅱ加入浓氨水前,需在步骤Ⅰ中加入的原因之一是利用溶于水电离出,使的电离平衡逆向移动,请解释另一原因: 。
(4)步骤Ⅱ中在加入溶液时,控制温度在10℃以下并缓慢加入的目的是控制反应速率同时 。
(5)制备的总反应的化学方程式为 。
(6)步骤Ⅲ中的操作名称为 、 。
考法2 卤族元素
1.卤素及化合物的性质比较:
2.卤素元素的有关特性:
(1)F2遇水发生置换反应,生成HF并放出O2。
(2)HF是弱酸、剧毒,但能腐蚀玻璃4HF + SiO2 = SiF4↑ + 2H2O;HF由于形成分子间氢键相互缔合,沸点反常的高。
(3)溴是唯一的液态非金属,易挥发,少量的液溴保存要用水封。
温馨提示:能使溴水褪色的原因:被H2S、SO2、SOeq \\al(2-,3)、I-等还原剂还原而褪色;与NaOH、Na2CO3等碱性物质发生反应而褪色;与较活泼金属(如Mg+Br2===MgBr2)反应而褪色;能与溴发生加成反应的不饱和烃及其衍生物,如烯烃、炔烃等;能被溴水氧化的、含有醛基的化合物。
(4)碘易升华,遇淀粉显蓝色;碘的氧化性较弱,它与变价金属反应时生成低价化合物。
(5)AgX中只有AgF溶于水,且不具有感光性;CaF2中只有CaF2难溶。
3.卤素间的置换反应及X-离子的检验:
(1)Cl2 + 2Br- = Br2 + 2Cl-, Cl2 + 2I- = I2 + 2Cl-, Br2 + 2I- = I2 + 2Br-。结论:氧化性:Cl2 > Br2 > I2;还原性:I- > Br- > Cl-
(2)溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化:
(3)X-离子的检验:
①AgNO3溶液—沉淀法:
②置换—萃取法:
【典例4】(2023年威海一中高三月考) 从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子方程式:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 ml Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
【拓展延伸】海水中的化学工艺流程
【典例5】(2023·石家庄一中高三月考)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_______________________。
(3)B中溶液发生反应的离子方程式是_________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
(5)过程Ⅲ实验的目的是___________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________________,得电子能力逐渐减弱。
1.(2023·上海·统考模拟预测)下列海带提碘的操作中不合理的是
2.(2023·广东汕头·统考三模)碘元素在人体内发挥着重要作用,可预防大脖子病。某实验小组从海带中提取碘的工艺流程如图,下列有关说法错误的是
A.灼烧时需要用到玻璃棒、酒精灯、三脚架、泥三角、坩埚和坩埚钳
B.操作①和③均为过滤
C.反应②中离子反应方程式为
D.采用减压蒸馏,可以降低萃取剂的沸点,便于和的分离
3.(2023·河北唐山·统考二模)海水中提取镁的工艺流程:
(1)该工艺流程中属于分解反应的有 个,请写出其中属于氧化还原反应的化学方程式 。
(2)脱水得到的过程中,通入HCl的作用是 。
(3)25℃时,在沉镁的过程中,将溶液滴加到悬浊液中,当混合溶液中pH=12时,同时存在、两种沉淀,则此时溶液中 。判断此时 (填“是”或“否”)完全沉淀。(,,当某离子浓度降到以下时,认为该离子已经完全沉淀。)
(4)新工艺向含氧化镁熔浆中添加三氯化铈()和氯气反应,生成和无水氯化镁。请写出该反应的化学方程式 。
(5)某实验小组对进行热重曲线分析:
①分析181℃时固体产物的化学式为 。
②写出在300℃时生成固体产物(一种含镁的碱式盐)的化学方程式 。
【基础过关】
1.(2023·上海·统考模拟预测)向饱和氯水中加入少量亚硫酸钠固体,下列说法正确的是
A.溶液pH减小B.溶液颜色变深C.漂白性增强D.导电性减弱
2.(2023·河南·校联考模拟预测)卤素的应用广泛,常运用于化学工业尤其是有机合成工业上。下列关于卤素单质或其化合物的叙述正确的是
A.漂白液中次氯酸钠的电离方程式:NaClO =Na+ +Cl-+O2-
B.向溴化亚铁溶液中滴入少量氯水的离子方程式:2Fe2+ +Cl2=2Fe3++2Cl-
C.在含有KI的溶液中可以大量存在H+、Mg2+、、
D.加热含1mlHCl的浓盐酸与足量MnO2的混合物,产生5.6L(标准状况)的氯气
3.(2023·江苏盐城·统考三模)周期表中VIIA元素及其化合物应用广泛。氢氟酸可用作雕刻玻璃;可溶于苯、等有机溶剂,极易水解;卤素互化物(如ICl、)具有强氧化性;卤化银具有感光性(的电离平衡常数分别为:、;HClO的电离平衡常数为:)。下列化学反应表示正确的是
A.溶于水:
B.ICl溶于NaOH溶液:
C.溶于水:
D.少量通入NaClO溶液中:
4.(2023·广东广州·统考三模)某溶液的主要成分为NaClO(含有一定量的NaOH),既能杀菌消毒又能漂白。下列用来解释事实的离子方程式不正确的是
A.该溶液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=Cl-+ClO-+H2O
B.该溶液与洁厕灵(主要成分为HCl)混合产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O
C.该溶液与过氧化氢溶液混合产生O2:2ClO-+H2O2=2Cl-+O2↑+2OH-
D.该溶液加白醋可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO-
5.(2023·湖北·校联考模拟预测)三氟化氯是极强助燃剂,能发生自耦电离:,其分子的空间构型如图所示。下列推测合理的是
A.与反应生成和B.分子是含有极性键的非极性分子
C.比更难发生自耦电离D.熔沸点:
6.(2023·江苏扬州·扬州中学校考模拟预测)氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br-,可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO;亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂。实验室欲由下列装置制取高浓度的HClO溶液,有关实验装置和原理能达到各自实验目的的是
A.制取氯气B.制取氯水
C.提高HClO浓度D.分离HClO
7.(2023·四川成都·石室中学校考模拟预测)NCl3可用于面粉的漂白和杀菌。已知:NCl3为黄色油状液体,在热水中易水解,熔点为-40°C,沸点为70°C,95°C以上易爆炸。实验室可用Cl2和NH4Cl溶液反应制取NCl3所用装置如下:
完成下列填空:
(1)仪器a的名称是 。D装置盛装的物质是 ,D装置的作用是_ 。
(2)NCl3水解的反应液有漂白性,写出NCl3水解的化学方程式: 。
(3)向NH4Cl溶液中通入过量Cl2,B装置中反应的化学方程式为 ,待反应至油状液体不再增加,关闭A、B装置间的止水夹,控制水浴加热的温度范围为 ,将产品NCl3蒸出。
待反应结束,为测定溶液中残留的NCl3的物质的量浓度,进行如下操作:
i.取仪器a中的反应液25.00mL,加入过量饱和Na2SO3溶液充分反应后,再加入过量30%的NaOH溶液,微热。
ii.用·L-1的稀硫酸吸收产生的NH3,得到溶液A。
iii.用0.100ml·L-1的NaOH标准溶液滴定溶液A至滴定终点,消耗VmLNaOH标准溶液。
(4)滴定至终点时溶液中溶质仅有(NH4)2SO4和Na2SO4,滴定过程中水的电离程度_ (填序号)。
a.先增大后减小 b.先减小后增大 c.增大 d.减小
(5)用含V的代数式表示溶液中残留的NCl3的物质的量浓度为 ml·L-1。
8.(2023·湖南岳阳·统考模拟预测)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。某化学兴趣小组在实验室制取氯水和氯酸钾,并进行相关实验。
Ⅰ.用如图所示实验装置制取氯水和氯酸钾。
(1)氯酸钾中氯原子的杂化方式为 ,装置A圆底烧瓶中发生反应的化学方程式为 。
(2)在确保KOH溶液完全反应的条件下,若对调装置B和C的位置,C中氯酸钾的产率会 (填“增大”“减小”或“不变”),原因是 。
Ⅱ.测定从装置C试管中分离得到的粗产品中的质量分数(粗产品中混有的杂质是和);碱性条件下,氧化性较弱,不能氧化。测定粗产品中的纯度的实验过程如下:
步骤1:取3.00g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,KOH溶液调节pH,然后滴加过量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2min,冷却。
步骤3:将溶液转移到碘量瓶中(如图)加将溶液调至弱酸性,加过量的的KI溶液,加盖水封、于暗处放置5min。
步骤4:以淀粉为指示剂,用标准溶液滴定碘量瓶中的溶液至终点,平行操作三次。平均消耗溶液。相关反应为。
(3)步骤2中,煮沸溶液1~2min的目的是 。
(4)步骤3发生反应的离子方程式为 。
(5)使用碘量瓶时,加盖水封的目的是 。
(6)粗产品中的质量分数为 。(保留三位有效数字)
【能力提升】
1.(2023·江苏南通·统考三模)NaClO是家用消毒液的有效成分,这是利用了NaClO的
A.碱性B.强氧化性C.还原性D.受热后不稳定性
2.(2023·浙江温州·乐清市知临中学校考二模)下列关于元素及其化合物的性质和用途,以及其对应关系正确的是
A.氯气能使鲜花褪色,是因为氯气具有氧化性,所以可以用作干布的漂白
B.铝比铁更活泼,所以铝制品在空气中更容易被腐蚀
C.浓硫酸在常温下可以钝化铁,发生了化学反应,所以铁罐可以用于浓硫酸的运输
D.氮气的性质比较稳定,所以可用于冶炼金属镁时的冷却气
3.(2023·山东菏泽·山东省鄄城县第一中学校考三模)党的二十大报告指出,面对突如其来的新冠肺炎疫情,我们坚持人民至上、生命至上。在抗击新冠肺炎症情中,化学知识起到了重要的作用。下列有关说法不正确的是
A.新冠病毒直径约为80~100nm,扩散到空气中可形成气溶胶
B.医院常用95%的酒精消毒
C.“84消毒液”是杀灭“新冠病毒”的药物之一,其有效成分为次氯酸钠
D.高温杀灭“新冠病毒”,其原理是破坏蛋白质分子的空间结构,使其变性
4.(2023·江苏扬州·统考三模)以处理后的海水(含NaI)为原料制取的某工艺流程如下:
下列说法正确的是
A.“沉淀”后所得上层清液中
B.加Fe还原前用沉淀的目的是实现的富集
C.“滤渣”只含一种金属
D.“氧化”的目的是将、完全转化为、
5.(2023·江西·校联考二模)工业上从海水中制溴的步骤为:(Ⅰ)先把盐卤加热到363K后控制pH为3.5,通入氯气把溴置换出来;(Ⅱ)再用空气把溴吹出并用碳酸钠溶液吸收;(Ⅲ)最后再用硫酸酸化,单质溴又从溶液中析出。其中,碳酸钠溶液吸收溴单质的反应可以分三步进行,其反应的机理如图所示。下列说法正确的是
第一步:
第二步:
第三步:
A.由反应机理可知整个反应过程只涉及极性键的断裂和形成
B.反应产生的CO2主要是由Br2在水溶液中产生的HBr与溶液中CO反应生成的
C.对比氯气与Na2CO3溶液的反应,常温下在碱性溶液的稳定性:ClO- > BrO-
D.当1ml Br2完全参与上述反应后,产生的Br-与BrO的个数之比为3:1
6.(2023·四川乐山·统考三模)海洋中有丰富的食品、矿产和水产资源等,海水开发利用的部分过程如图所示,已知粗盐含有、Ca2+、Mg2+杂质;下列说法错误的是
A.过程①蒸馏法分离出盐可以利用太阳能
B.②中可依次加入NaOH、BaCl2、Na2CO3、盐酸
C.过程③电解每获得1mlNaOH时需转移电子1NA
D.过程④和过程⑤所涉及的物质均属于电解质
7.(2023·河北衡水·衡水市第二中学校考三模)三氯化氮是一种黄色油状液体,可用于漂白和杀菌。已知:熔点为-40℃,沸点为70℃,95℃以上易爆炸。在弱酸性溶液中稳定,在热水中易水解,遇碱则迅速反应。在实验室可用和溶液反应制取,所用仪器如图(忽略部分夹持装置):
回答下列问题:
(1)根据气流方向,各仪器的连接顺序为a接 , 接 ,g接d;装置A中使用恒压滴液漏斗的优点是
(2)若用装置A制取氯气,则试剂X可选用 (填字母);D中仪器的名称为
A. B. C. D.
(3)实验过程中,在B中蒸馏烧瓶中观察到的现象是 ,反应生成的遇热水易水解,反应液有漂白性.写出水解的化学方程式:
(4)纯度测定:的制取是可逆反应,根据反应,利用间接碘量法测定氯气的量即可测定的纯度
实验步骤:ⅰ.准确称量C中的产物0.4g置于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气
ⅱ.将混合气通入200mLKI溶液中,待试管中无色液体变成黄色,关闭氮气(溶液体积变化忽略不计)
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用标准液进行滴定,滴定至终点时消耗溶液18.00mL。
(已知:反应原理为)
①确定滴定终点的现象为
②的纯度为 (保留三位有效数字)
8.(2023·中山纪念中学高三三模)次氯酸(HClO)的浓溶液呈黄色,是极强氧化剂,常用作消毒剂及除甲醛(HCHO)的试剂。某学习小组设计下列装置制备HClO并验证其氧化性(夹持仪器及降温装置已省略)。
已知:Cl2O为棕黄色气体,极易溶于水并迅速反应生成HClO。
回答下列问题:
(1)HClO的结构式为____,仪器a的名称为____。
(2)制备HClO时要打开活塞K1、K3,关闭K2,待装置A中反应结束时再通入一段时间N2。
①仪器C中制备Cl2O时,发生反应的化学方程式为2Cl2+2Na2CO3+H2O-=Cl2O+2NaCl+2____(填化学式),仪器B、D中的试剂分别为____(填字母)。
a.浓H2SO4、CCl4
b.饱和食盐水、CCl4
c.饱和食盐水、浓H2SO4
②反应结束后再通入一段时间N2的目的是____。
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。
①将E中HClO溶液转移到F中的具体操作为____(答出对开关的操作)。
②反应结束时,F的溶液中含有的离子主要有Fe3+、Cl-、SO、H+,该反应的离子方程式为____。
(4)HClO可用于除去HCHO,生成一种常见强酸和两种常见无污染的氧化物。
①该反应的化学方程式为____。
②若除去15gHCHO,则转移电子的个数为____NA(NA表示阿伏加德罗常数)。
【真题感知】
1.(2023·广东·统考高考真题)利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合,一段时间后
A.U型管两侧均有气泡冒出,分别是和B.a处布条褪色,说明具有漂白性
C.b处出现蓝色,说明还原性:D.断开,立刻闭合,电流表发生偏转
2.(2023·辽宁·统考高考真题)某小组进行实验,向蒸馏水中加入,充分振荡,溶液呈浅棕色,再加入锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知为棕色,下列关于颜色变化的解释错误的是
3.(2022·浙江·统考高考真题)下列推测不合理的是
A.相同条件下,Br2与PBr3反应比Cl2与PCl3反应难
B.OPBrCl2与足量H2O作用生成2种酸
C.相同条件下,与水反应由快到慢的顺序:OPBr3、OPCl3、OPF3
D.PBr3与足量C2H5OH作用可得到P(OC2H5)3
4.(2022·北京·高考真题)某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、(绿色)、(紫色)。
ii.浓碱条件下,可被OH-还原为。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
(1)B中试剂是 。
(2)通入Cl2前,II、III中沉淀由白色变为黑色的化学方程式为 。
(3)对比实验I、II通入Cl2后的实验现象,对于二价锰化合物还原性的认识是 。
(4)根据资料ii,III中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将氧化为。
①化学方程式表示可能导致溶液碱性减弱的原因 ,但通过实验测定溶液的碱性变化很小。
②取III中放置后的1 mL悬浊液,加入4 mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 ,溶液绿色缓慢加深,原因是MnO2被 (填“化学式”)氧化,可证明III的悬浊液中氧化剂过量;
③取II中放置后的1 mL悬浊液,加入4 mL水,溶液紫色缓慢加深,发生的反应是 。
④从反应速率的角度,分析实验III未得到绿色溶液的可能原因 。
5.(2023·山东·统考高考真题)卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)时,与冰反应生成利。常温常压下,为无色气体,固态的晶体类型为 ,水解反应的产物为 (填化学式)。
(2)中心原子为,中心原子为,二者均为形结构,但中存在大键。中原子的轨道杂化方式 ;为键角 键角(填“>”“ <”或“=”)。比较与中键的键长并说明原因 。
(3)一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为 。若阿佛伽德罗常数的值为,化合物的密度 (用含的代数式表示)。
年份
卷区
考点分布
氯气的制备
氯气的性质及用途
卤族元素
综合应用
2023
江苏
√
广东
√
北京
√
浙江
√
辽宁
√
2022
重庆
√
福建
√
河北
√
√
山东
√
广东
√
√
北京
√
浙江
√
√
2021
北京
√
广东
√
选项
陈述Ⅰ
陈述Ⅱ
判断
A
漂白粉使用时为加快其漂白速率往往可滴加适量醋酸
酸性:CH3COOH>HClO
Ⅰ对,Ⅱ对,有
B
氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色
说明次氯酸的氧化性比氯气强
Ⅰ对,Ⅱ对,无
C
双氧水、氯气、硫酸铜均可用作杀菌消毒剂
因为双氧水、氯气、硫酸铜都具有较强氧化性
Ⅰ对,Ⅱ对,有
D
将Cl2通入NaBr溶液中,然后加入CCl4,振荡、静置,CCl4层为橙红色
说明氯的氧化性比溴的强
Ⅰ对,Ⅱ对,无
滴定次数
1
2
3
KI溶液体积/mL
19.98
20.02
20.00
氟
氯
溴
碘
单质物理性质
状态
气
气(易液化)
液(易挥发)
固(易升华)
熔、沸点
熔、沸点逐渐________
颜色
淡黄绿色
黄绿色
红棕色
紫黑色
密度
密度逐渐增大
X2与H2化合
条件
冷暗处
光照
加热
持续加热
程度
剧烈爆炸
爆炸
缓慢
化合同时分解
X2与H2O化合
反应
2F2+2H2O=4HF+O2
X2 + H2O = HX + HXO
程度
剧烈
缓慢
微弱
极弱
水溶性
反应生成氢氟酸
水溶性依次减小,有机溶剂中溶解性依次增大
化合价
只有-1价
有-1、+1、+3、+5、+7等
含氧酸
化学式
无含氧酸
有HXO、HXO2、HXO3、HXO4等
强弱程度
同一价态的酸性依次减弱
卤化银
颜色
AgF(白)
AgCl(白)
AgBr(淡黄)
AgI(黄)
水溶性
易溶
均难溶,且溶解度依次减小
感光性
难分解
见光均易分解,且感光性逐渐增强
溶剂
溶质
水
苯
汽 油
四氯化碳
Br2
黄 → 橙
橙 → 橙红
橙 → 橙红
橙→ 橙红
I2
深黄→ 褐
淡紫 → 紫红
淡紫→ 紫红
紫→ 深紫
密 度
比 水 轻
比 水 轻
比 水 重
海水提取氯——氯碱工业
海水中提取溴
浓缩海水eq \(――→,\s\up7(通Cl2),\s\d5(①))溴单质eq \(―――――――――→,\s\up7(②通空气、水蒸气),\s\d5(SO2吸收))氢溴酸eq \(――→,\s\up7(通氯气),\s\d5(③))溴单质
海带中提取碘
选项
A
B
C
D
使用仪器
相关操作
灼烧
浸泡海带
过滤海带浸出液
萃取碘
选项
颜色变化
解释
A
溶液呈浅棕色
在水中溶解度较小
B
溶液颜色加深
发生了反应:
C
紫黑色晶体消失
()的消耗使溶解平衡右移
D
溶液褪色
与有色物质发生了置换反应
序号
物质a
C中实验现象
通入Cl2前
通入Cl2后
I
水
得到无色溶液
产生棕黑色沉淀,且放置后不发生变化
II
5%NaOH溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
III
40%NaOH 溶液
产生白色沉淀,在空气中缓慢变成棕黑色沉淀
棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀
相关试卷
这是一份考点2 化学平衡 (核心考点精讲精练)-备战高考化学一轮复习(新高考专用),文件包含考点2化学平衡核心考点精讲精练-备战高考化学一轮复习新高考专用原卷版docx、考点2化学平衡核心考点精讲精练-备战高考化学一轮复习新高考专用解析版docx等2份试卷配套教学资源,其中试卷共52页, 欢迎下载使用。
这是一份考点1 化学反应速率(核心考点精讲精练)-备战高考化学一轮复习(新高考专用),文件包含考点1化学反应速率核心考点精讲精练-备战高考化学一轮复习新高考专用原卷版docx、考点1化学反应速率核心考点精讲精练-备战高考化学一轮复习新高考专用解析版docx等2份试卷配套教学资源,其中试卷共57页, 欢迎下载使用。
这是一份考点2 原电池 新型电源(核心考点精讲精练)-备战高考化学一轮复习(新高考专用),文件包含考点2原电池新型电源核心考点精讲精练-备战高考化学一轮复习新高考专用原卷版docx、考点2原电池新型电源核心考点精讲精练-备战高考化学一轮复习新高考专用教师版docx等2份试卷配套教学资源,其中试卷共65页, 欢迎下载使用。








