专题复习 高考化学 考点12 离子的检验与推断 讲义
展开一、离子的检验
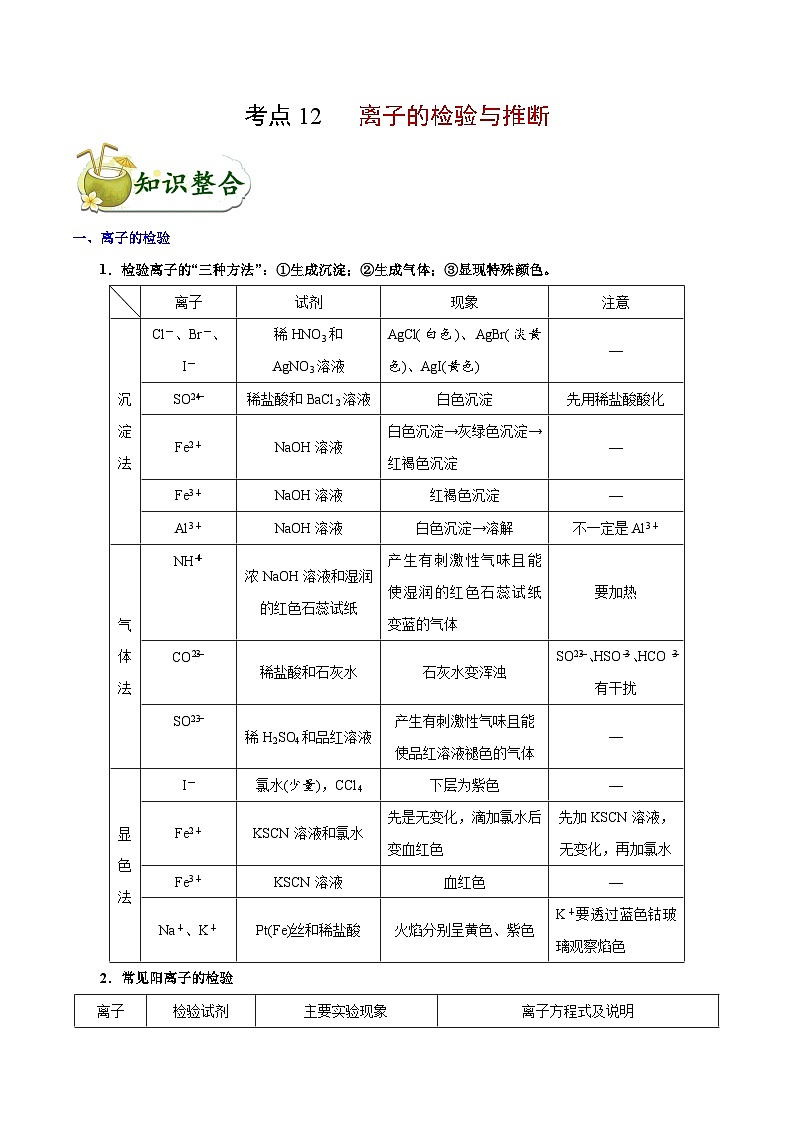
1.检验离子的“三种方法”:①生成沉淀;②生成气体;③显现特殊颜色。
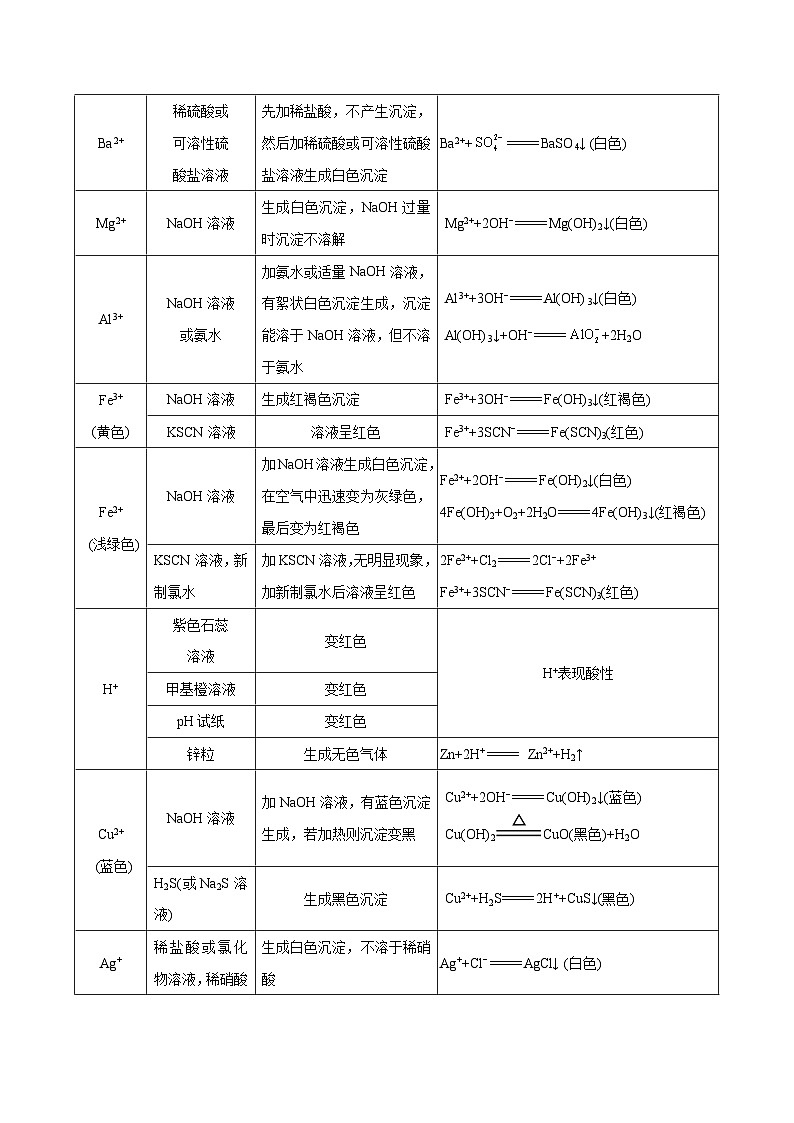
2.常见阳离子的检验
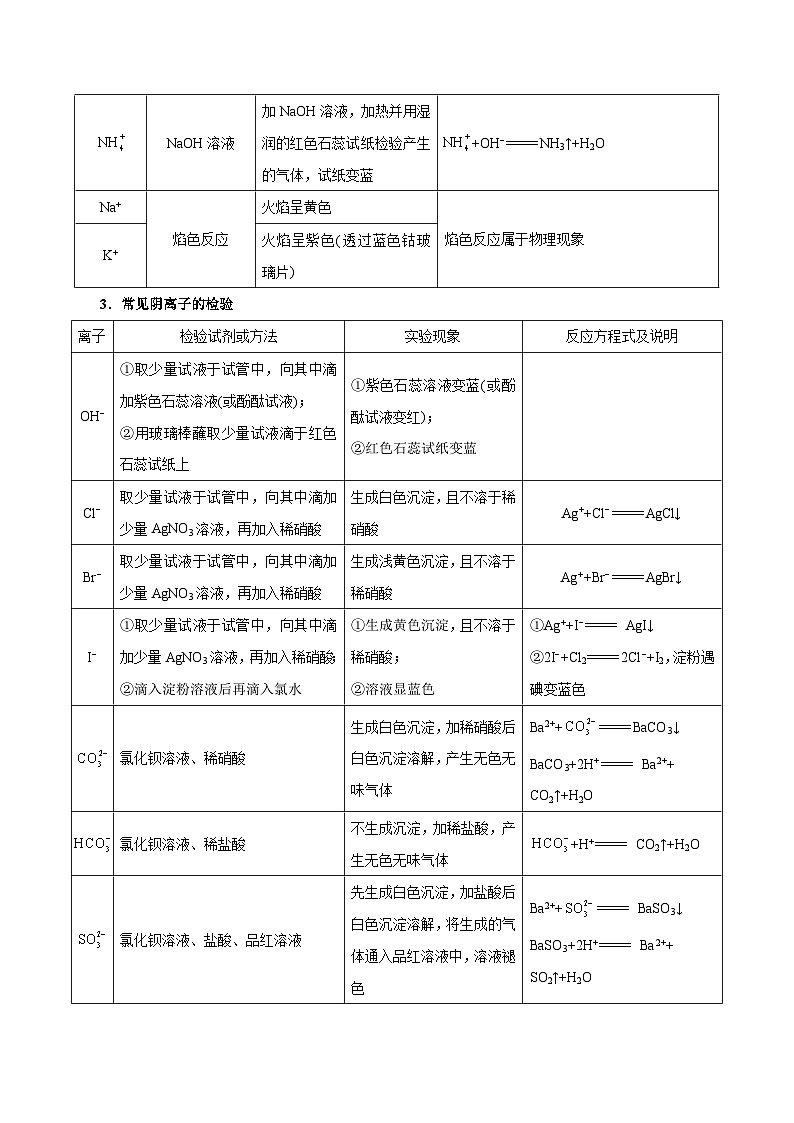
3.常见阴离子的检验
二、离子的推断
1.离子推断题的解题思路
该考点主要以选择题及填空题的形式出现,离子推断可以把实验操作、离子反应、离子共存、离子检验、电荷守恒等知识综合起来考查,是综合性较强的题目。其一般解题思路为
必须注意两点:(1)所加试剂引入的离子对后续实验的影响;(2)用电荷守恒判断溶液中还可能含有的离子时要将定性与定量的方法相结合。
2.离子推断题的解题原则
(1)互斥性原则。利用题给条件判断出一定存在某种离子时,可将不能与之共存的离子排除掉,从而判断出一定没有哪种离子。
(2)电中性原则。任何溶液中,阴、阳离子所带电荷总数是守恒的,即溶液呈电中性。这个隐含条件往往被忽略,从而造成漏选或错选。如题中各种阳离子一一被排除后,根据电中性原则,最后剩余的那种阳离子肯定存在;反之,阴离子亦然。
(3)进出性原则。在进行离子检验时,往往要加入试剂,这样就会引入新的离子,原溶液中是否存在该种离子就无法判断,如加入过量BaCl2溶液时,过量的Ba2+、Cl−将影响对原溶液中是否有Ba2+或Cl−的判断;还有一些离子会随实验过程的变化而消失(如原溶液中的在酸性条件下转化为Al3+),可能对后续的检验产生影响。
(4)推断结果时应从三个方面考虑:肯定存在的离子,肯定不存在的离子,不能判定存在与否的离子。并且这三个方面是相互独立的,任何一种离子只能出现一次,不能重复出现。
考向一 离子检验
典例1 下列关于离子检验的说法正确的是
A.检验溶液中是否含有Ba2+:取少量待测液,向其中加入少量稀硫酸,若有白色沉淀产生,则溶液中含有Ba2+
B.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是酸性KMnO4溶液
C.检验溶液中是否含有COeq \\al(2-,3):取少量待测液,向其中加入适量稀盐酸,观察是否有大量气泡产生
D.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SOeq \\al(2-,4)或SOeq \\al(2-,3)
【答案】B
【解析】如果溶液中含有Ca2+、Ag+等,向其中加入少量稀硫酸,会有硫酸钙、硫酸银等白色沉淀产生,所以不能确定溶液中含有Ba2+,故A项错误;硫酸亚铁可将酸性KMnO4还原而使酸性KMnO4溶液褪色,故B项正确;HCOeq \\al(-,3)、SOeq \\al(2-,3)、HSOeq \\al(-,3)遇稀盐酸也可产生大量气泡,故C项错误;若存在Ag+,加入BaCl2溶液会产生氯化银白色沉淀,D项错误。
1.下列离子在未知溶液中的检验方法正确的是
【答案】D
【解析】A项,会产生干扰,错误;B项,会产生干扰,错误;C项,使酸性高锰酸钾溶液褪色的不一定是Fe2+,如等,错误;D项,氯气能把I-氧化成I2,淀粉遇碘变蓝,因此可以检验I-的存在,正确。
离子检验简答题的答题模板
考向二 离子推断
典例1 有一混合物的水溶液,可能含有以下离子中的若干种:K+、、Cl−、Mg2+、Fe3+、、,现取三份各 100 mL 溶液进行如下实验:
①向第一份中加入AgNO3溶液,有白色沉淀产生;
②向第二份中加入足量NaOH溶液后加热,收集到气体 0.896 L(标准状况);
③向第三份中加入足量BaCl2溶液,得到沉淀6.27 g,沉淀经足量盐酸洗涤后,剩余2.33 g。
试回答下列问题:
(1)肯定存在的离子有 ,肯定不存在的离子有 。
(2)可能存在的离子是 ,为确定该离子是否存在,可取少许原溶液,然后 (填实验操作)。
(3)试分别确定肯定存在的离子在原溶液中各自的物质的量浓度 。
【思路分析】应思考题目给出n()、n()和n()的具体数值,其用意是什么?为了弄清该数据隐含的信息,我们应联想到“任何溶液都必须呈电中性”来加以验证。
【解析】由①知溶液中可能含Cl−、、,由②知溶液中一定含,且n()=0.04 ml,由③知溶液中一定含、,则一定不含Mg2+、Fe3+(二者与不能大量共存),且n()= QUOTE =0.01 ml,n()= QUOTE =0.02 ml,所以得出结论:溶液中一定含、、,一定不含Mg2+、Fe3+,由于n()×2+n()×2=0.01×2+0.02×2=0.06>
n()×1=0.04×1,故必存在K+。又因溶液中可能存在Cl−,则n(K+)≥0.02 ml。所以c()=0.1 ml/L,c()=0.2 ml/L,c()=0.4 ml/L,若原溶液中不存在Cl−,则c(K+)=0.2 ml/L,若存在Cl−,则c(K+)>0.2 ml/L,故c(K+)≥0.2 ml/L。检验可能存在的Cl−时要注意、的干扰。
【答案】(1)、、、K+ Mg2+、Fe3+
(2)Cl− 加入足量的稀硝酸和硝酸钡溶液,过滤,向滤液中滴入AgNO3溶液,若有白色沉淀生成,则证明有Cl−存在,否则不存在
(3)c()=0.1 ml/L,c()=0.2 ml/L,c()=0.4 ml/L,c(K+)≥0.2 ml/L
2.某混合物的溶液中只含有一下离子中的若干种:、、、、、、,现取两份溶液进行如下实验:
①第一份加入过量溶液加热后,收集到气体,无沉淀生成.
②第二份加入足量溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后质量为.
(1)溶液中一定不存在的离子是________,不能确定是否存在的离子是________.
(2)溶液中肯定存在的阴离子是________,其浓度为________.
(3)试判断是否存在?________(填“是”或“否”),判断的理由是________.
【答案】、、 是 溶液中存在和,可能含有,且,,根据电荷守恒可知一定含有钾离子
【解析】
【分析】
某混合物的溶液中只含有一下离子中的若干种:、、、、、、,现取两份溶液进行如下实验:①第一份加入过量溶液加热后,收集到气体,无沉淀生成,则溶液中一定无、,一定有,②第二份加入足量溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后质量为,溶液一定有,无, 据此解答。
【详解】
(1)由以上分析可知溶液中一定不存在的离子是:、、;不能确定是否存在的离子是:;
(2)肯定存在的阴离子是:;根据第二份沉淀的质量可知其物质的量为:,其浓度为;
(3)溶液中存在和,可能含有,且,,根据电荷守恒可知一定含有钾离子。
离子推断的四项基本原则
1.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
【答案】B
【解析】加入BaCl2溶液得到白色沉淀,原溶液中可能含有或或Ag+等,A错误;溶于CCl4呈紫色的为I2,即原溶液中含有I−,B正确;观察K+的焰色反应应透过蓝色钴玻璃,排除Na+的干扰,C错误;检验应加入浓NaOH溶液,且需要加热,D错误。
2.下列实验操作、现象和结论均正确的是
【答案】A
【解析】AlOeq \\al(-,2)结合HCOeq \\al(-,3)电离产生的H+生成Al(OH)3,A正确;将Fe(NO3)2样品溶于稀硫酸,NOeq \\al(-,3)(H+)将Fe2+氧化为Fe3+,B错误;观察K的焰色时,应透过蓝色的钴玻璃,C错误;检验NHeq \\al(+,4)应使用浓NaOH溶液且加热,D错误。
3.有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 ml;
(3)向第三份中加足量BaCl2溶液后,得千燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测不正确的是( )
A.K+一定存在
B.Ba2+、Mg2+一定不存在
C.Cl- 一定存在
D.混合溶液中CO32-的浓度为0.1 ml/L
【答案】C
【解析】
试题分析:(1)向第一份中加入AgNO3溶液,有沉淀产生,则溶液中可能有Cl-、CO32-、SO42-;(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 ml,则溶液中一定有0.04 ml NH4+;(3)向第三份中加足量BaCl2溶液后,得千燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,可以确定生成硫酸钡2.33g(0.01ml)、碳酸钡3.94g(0.02ml),则每份溶液中含0.01ml SO42- 和0.02ml CO32-,一定没有Ba2+和Mg2+。A.根据电荷守恒, K+一定存在 ,A正确;B. Ba2+、Mg2+一定不存在,B正确;C. 无法判断Cl- 是否存在 ,C不正确; D. 混合溶液中CO32-的浓度为0.1 ml/L,D正确。本题选C。
4.现有 A、B、C、D、E五种均可溶于水的固体物质,是由以下表格中提供的几种离子组成(每种离子只能用一次):
现分别进行如下实验:
①将D与E的溶液混合加热,产生有刺激性气味的气体
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解
③在常温下用pH 试纸测定溶液A的pH>7
下列说法不正确的是
A.物质E的化学式为Ba(OH)2 B.物质D中一定含有 NH
C.物质C中一定含有C1- D.难以确定物质 A的组成
【答案】D
【解析】
A.分析可知,物质E的化学式为Ba(OH)2,A说法正确;
B.物质D为碘化铵,一定含有NH,B说法正确;
C.物质C为氯化铁,一定含有C1-,C说法正确;
D.物质A为碳酸钠,可以确定物质A的组成,D说法不正确;
答案为D。
5.某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO、SO、NO中的若干种,现取适量溶液进行如下一系列实验
下列有关判断正确的是
A.原试液中一定有Fe2+、SO、H+、NH、Al3+
B.原试液中一定没有Ba2+、CO、NO
C.步骤③中发生反应的离子方程式为: 2AlO+CO2+3H2O=2Al(OH)3↓+CO
D.沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
【答案】B
【解析】该溶液为强酸性溶液,则CO32-不存在,Fe2+和NO3-不能同时存在,试液中加入过量硝酸钡溶液,生成气体证明一定含有Fe2+、则原溶液中一定不存在NO3-,气体为NO,沉淀A为BaSO4,原溶液中一定不存在Ba2+,一定存在SO42-,溶液A中加入过量氢氧化钠溶液生成气体B为NH3,确定原溶液中含有NH4+,沉淀B为Fe(OH)3,由于溶液B中含有Ba2+,OH-,溶液B加入少量二氧化碳发生反应③,生成的沉淀一定含有BaCO3沉淀,可能生成沉淀Al(OH)3,溶液B中不一定含有AlO2-,则原溶液中不一定含有Al3+,以此解答该题。
【详解】
A.由以上分析可知原溶液中一定有Fe2+、SO、H+、NH,不一定含有Al3+,故A错误;
B.上述分析可知,原溶液中一定没有的离子为:Ba2+、CO、NO,故B正确;
C.步骤③中反应的离子方程式可能为,或,故C错误;
D.沉淀B为Fe(OH)3,红褐色沉淀,故D错误;
答案选B。
6.向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1ml/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
A.原混合液中c(SO42-):c(Cl-)=1:1
B.向D点溶液中通入C02气体,立即产生白色沉淀
C.图中A点沉淀中含有BaSO4和Al(OH)3
D.AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓
【答案】A
【解析】
Al2(SO4)3和AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,反应如下:Ba2++SO42-=BaSO4↓,Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,假设1mlAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3ml,提供6mlOH-,1mlAl2(SO4)3中含有2mlAl3+,由反应Al3++3OH-=Al(OH)3↓可知,2mlAl3+完全沉淀,需要6mlOH-,故从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,A~B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,B~C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解。则可依次分析四个选项如下:
A、前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L~6L为Ba(OH)2溶液与溶液中AlCl3反应,二者消耗的氢氧化钡的物质的量相等为3L×1ml/L=3ml,由生成硫酸钡可知3n[Al2(SO4)3]=n[Ba(OH)2],故n[Al2(SO4)3]=1ml,由氯化铝与氢氧化钡生成氢氧化铝可知3n(AlCl3)=2[Ba(OH)2]=6ml,故n(AlCl3)=2ml,因此原溶液中c[Al2(SO4)3]:c(AlCl3)=1:2,即c(SO42-):c(Cl-)=1:2,故A错误;
B、D点的溶液中含有大量的OH-、Ba2+、AlO2-,通入二氧化碳立即产生碳酸钡沉淀,通入足量的二氧化碳后还能生成氢氧化铝沉淀,B正确;
C、根据以上分析可知图中A点沉淀中含有BaSO4和Al(OH)3,C正确;
D、根据以上分析可知AB段反应的离子方程式为Al3++3OH-=Al(OH)3↓,D正确;
答案选A。
7.某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlOeq \\al(-,2)、S2-、SOeq \\al(2-,3)、COeq \\al(2-,3)、SOeq \\al(2-,4)。现取该溶液进行实验,实验结果如图:
请回答下列问题:
(1)生成沉淀甲的离子方程式为________________________________________。
(2)由溶液甲生成沉淀乙的离子方程式为____________________________________。
(3)已知气体甲由两种氧化物组成(不包括水蒸气和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入表格。
(4)综上所述,该溶液肯定存在的离子有__________________________________。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是______________________________。
【答案】(1)2S2-+SOeq \\al(2-,3)+6H+===3S↓+3H2O
(2)Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑
(3)检验SO2 品红溶液 红色褪去 除尽SO2 酸性高锰酸钾溶液 溶液紫色变浅
(4)AlOeq \\al(-,2)、S2-、COeq \\al(2-,3)、SOeq \\al(2-,3)、Na+
(5)取沉淀丙加入足量的稀盐酸,若沉淀不完全溶解,则原溶液中含有SOeq \\al(2-,4),若沉淀完全溶解,则没有SOeq \\al(2-,4)
【解析】无色溶液则一定不存在Fe3+,与过量HBr反应生成气体甲和淡黄色沉淀甲,沉淀若是AgBr,则不存在S2-、COeq \\al(2-,3)、SOeq \\al(2-,3),就不可能生成气体甲,所以淡黄色沉淀为单质硫,是S2-与SOeq \\al(2-,3)、H+反应生成的,溶液中一定存在S2-和SOeq \\al(2-,3),一定不存在Ag+、Ba2+、Al3+,根据电荷守恒Na+一定存在;溶液甲中含有过量的HBr,与过量的NH4HCO3反应生成的气体乙为CO2,白色沉淀只能为Al(OH)3,说明原溶液中一定含有AlOeq \\al(-,2);溶液乙与过量Ba(OH)2溶液反应生成的气体丙为NH3,白色沉淀为BaCO3或BaSO4,所以溶液中一定存在的离子有Na+、S2-、SOeq \\al(2-,3)、AlOeq \\al(-,2); 一定不存在的离子为Ag+、Fe3+、Ba2+、Al3+;可能存在的离子为COeq \\al(2-,3)、SOeq \\al(2-,4)。
(4)已知气体甲由两种氧化物组成(不包括水蒸气和HBr),说明溶液中还含有COeq \\al(2-,3),综上可知,溶液中一定含有AlOeq \\al(-,2)、S2-、COeq \\al(2-,3)、SOeq \\al(2-,3)、Na+。
(5)BaSO4不溶于盐酸,BaCO3溶于盐酸,所以可用盐酸检验是否含有SOeq \\al(2-,4)。
8.1 L某混合溶液,可能含有的离子如下表:
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是______________。
(2)BC段离子方程式为_________________________________________________。
(3)V1、V2、V3、V4之间的关系为________________________________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为______________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
【答案】(1)Mg2+、Fe2+、Fe3+、、
(2)+OH-===NH3·H2O
(3)V2-V1=3(V4-V3)
(4)①Cl2+2I-===I2+2Cl- ②10∶15∶4
【解析】(1)根据题图,开始加入NaOH时,无沉淀产生,则说明溶液中含有H+,随后加入NaOH,有沉淀产生,沉淀量达到最大时继续加入NaOH,沉淀量先保持不变后完全溶解,则说明一定含有Al3+、,一定不含有Mg2+、Fe2+、Fe3+。根据离子共存知识,、与H+、Al3+不能大量共存,故一定不含有、。因此溶液中一定不含的离子为Mg2+、Fe2+、Fe3+、、。
(2)BC段的离子反应为与OH-的反应。
(3)V1~V2段的反应为Al3++3OH-===Al(OH)3↓,V3~V4段的反应为Al(OH)3+OH-===+2H2O,两段消耗的NaOH的物质的量之比为3∶1,即V2-V1=3(V4-V3)。
(4)由于还原性:I->Br->Cl-,向混合溶液中通入Cl2,I-先与Cl2反应,待I-完全被氧化,Br-才与Cl2反应。通入2.8 L Cl2时,溶液中仍有I-,故只发生Cl2和I-的反应:Cl2+2I-===I2+2Cl-,则原溶液中n(Br-)=1.5 ml,n(Cl-)=1.25 ml-×2 ml=1 ml;通入2.8~5.6 L Cl2时,发生反应:Cl2+2I-===I2+2Cl-、Cl2+2Br-===Br2+2Cl-,Br-消耗的n(Cl2)= ml=0.05 ml,故通入5.6 L Cl2时,I-消耗的n(Cl2)=(-0.05) ml=0.2 ml,则n(I-)=0.2 ml×2=0.4 ml,故原溶液中c(Cl-)∶c(Br-)∶c(I-)=n(Cl-)∶n(Br-)∶n(I-)=1∶1.5∶0.4=10∶15∶4。
1.[2019新课标Ⅲ]离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH−H2O
【答案】A
【解析】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
A、根据电荷守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A错误;
B、根据以上分析可知水中的SO42-、Cl-、NO3-等阴离子通过阴离子交换树脂被除去,B正确;
C、通过净化处理后,溶液中离子的浓度降低,导电性降低,C正确;
D、根据以上分析可知阴离子交换树脂填充段存在反应H++OH-=H2O,D正确;答案选A。
2.[11月浙江选考]取某固体样品,进行如下实验
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是
A. K2SO4、Ba(OH)2、Na2CO3
B. Na2CO3、AgNO3、KNO3
C. K2CO3、NaCl、Ba(NO3)2
D. KNO3、MgCl2、NaOH
【答案】C
【解析】A. K2SO4、Ba(OH)2、Na2CO3硫酸钡和碳酸钡沉淀,硫酸钡不溶于水盐酸,不符合③,故A错误;B. Na2CO3、AgNO3、KNO3三者能够反应生成碳酸银沉淀,与盐酸反应会生成氯化银沉淀,不符合③,故B错误;C. K2CO3、NaCl、Ba(NO3)2三者能够反应生成碳酸钡沉淀,滤液中可能含有碳酸根离子,加入氯化钡溶液生成白色沉淀,滤渣碳酸钡能够与盐酸反应放出二氧化碳而溶解,符合上述实验过程,故C正确;D. KNO3、MgCl2、NaOH三者能够反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应没有气体放出,不符合③,故D错误;故选C。
3.[4月浙江选考]某固体混合物中可能含有:K+、Na+、Cl-、COeq \\al(2-,3)、SOeq \\al(2-,4)等离子,将该固体溶解所得到的溶液进行如下实验:
下列说法正确的是
A.该混合物一定是K2CO3和NaCl
B.该混合物可能是Na2CO3和KCl
C.该混合物可能是Na2SO4和Na2CO3
D.该混合物一定是Na2CO3和NaCl
【答案】B
【解析】过量硝酸钡之后产生的白色沉淀溶于过量盐酸,说明有COeq \\al(2-,3)、无SOeq \\al(2-,4),溶液加入AgNO3/HNO3产生白色沉淀说明有Cl-,颜色反应显黄色说明有Na+,但不能确定是否含有K+。
4.[全国卷Ⅱ]某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为
A.NaHCO3、Al(OH)3
B.AgCl、NaHCO3
C.Na2SO3、BaCO3
D.Na2CO3、CuSO4
【答案】C
【解析】A项中,NaHCO3、Al(OH)3加入足量水中,NaHCO3溶解,Al(OH)3不溶解;加入稀盐酸,固体全部溶解,且有气泡产生;NaHCO3、Al(OH)3均能与H2SO4反应,最后不会有固体剩余;B项中,NaHCO3溶于水,AgCl不溶于水,加入足量稀盐酸,AgCl仍不溶解;C项中Na2SO3溶于水,BaCO3不溶于水,BaCO3能溶于稀盐酸:BaCO3+2HCl===BaCl2+H2O+CO2↑,Na2SO3、BaCO3均能与稀硫酸反应:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O、BaCO3+H2SO4===BaSO4↓+H2O+CO2↑;D项中,CuSO4和Na2CO3都能溶于稀硫酸。
离子
试剂
现象
注意
沉
淀
法
Cl-、Br-、
I-
稀HNO3和
AgNO3溶液
AgCl(白色)、AgBr(淡黄色)、AgI(黄色)
—
SOeq \\al(2-,4)
稀盐酸和BaCl2溶液
白色沉淀
先用稀盐酸酸化
Fe2+
NaOH溶液
白色沉淀→灰绿色沉淀→红褐色沉淀
—
Fe3+
NaOH溶液
红褐色沉淀
—
Al3+
NaOH溶液
白色沉淀→溶解
不一定是Al3+
气
体
法
NHeq \\al(+,4)
浓NaOH溶液和湿润的红色石蕊试纸
产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体
要加热
COeq \\al(2-,3)
稀盐酸和石灰水
石灰水变浑浊
SOeq \\al(2-,3)、HSOeq \\al(-,3)、HCOeq \\al(-,3)有干扰
SOeq \\al(2-,3)
稀H2SO4和品红溶液
产生有刺激性气味且能使品红溶液褪色的气体
—
显
色
法
I-
氯水(少量),CCl4
下层为紫色
—
Fe2+
KSCN溶液和氯水
先是无变化,滴加氯水后变血红色
先加KSCN溶液,无变化,再加氯水
Fe3+
KSCN溶液
血红色
—
Na+、K+
Pt(Fe)丝和稀盐酸
火焰分别呈黄色、紫色
K+要透过蓝色钴玻璃观察焰色
离子
检验试剂
主要实验现象
离子方程式及说明
Ba2+
稀硫酸或
可溶性硫
酸盐溶液
先加稀盐酸,不产生沉淀,然后加稀硫酸或可溶性硫酸盐溶液生成白色沉淀
Ba2++BaSO4↓ (白色)
Mg2+
NaOH溶液
生成白色沉淀,NaOH过量时沉淀不溶解
Mg2++2OH−Mg(OH)2↓(白色)
Al3+
NaOH溶液
或氨水
加氨水或适量NaOH溶液,有絮状白色沉淀生成,沉淀能溶于NaOH溶液,但不溶于氨水
Al3++3OH−Al(OH)3↓(白色)
Al(OH)3↓+OH−+2H2O
Fe3+
(黄色)
NaOH溶液
生成红褐色沉淀
Fe3++3OH−Fe(OH)3↓(红褐色)
KSCN溶液
溶液呈红色
Fe3++3SCN−Fe(SCN)3(红色)
Fe2+
(浅绿色)
NaOH溶液
加NaOH溶液生成白色沉淀,在空气中迅速变为灰绿色,最后变为红褐色
Fe2++2OH−Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O4Fe(OH)3↓(红褐色)
KSCN溶液,新制氯水
加KSCN溶液,无明显现象,加新制氯水后溶液呈红色
2Fe2++Cl22Cl−+2Fe3+
Fe3++3SCN−Fe(SCN)3(红色)
H+
紫色石蕊
溶液
变红色
H+表现酸性
甲基橙溶液
变红色
pH试纸
变红色
锌粒
生成无色气体
Zn+2H+ Zn2++H2↑
Cu2+
(蓝色)
NaOH溶液
加NaOH溶液,有蓝色沉淀生成,若加热则沉淀变黑
Cu2++2OH−Cu(OH)2↓(蓝色)
Cu(OH)2CuO(黑色)+H2O
H2S(或Na2S溶液)
生成黑色沉淀
Cu2++H2S2H++CuS↓(黑色)
Ag+
稀盐酸或氯化物溶液,稀硝酸
生成白色沉淀,不溶于稀硝酸
Ag++Cl−AgCl↓ (白色)
NaOH溶液
加NaOH溶液,加热并用湿润的红色石蕊试纸检验产生的气体,试纸变蓝
+OH−NH3↑+H2O
Na+
焰色反应
火焰呈黄色
焰色反应属于物理现象
K+
火焰呈紫色(透过蓝色钴玻璃片)
离子
检验试剂或方法
实验现象
反应方程式及说明
OH−
①取少量试液于试管中,向其中滴加紫色石蕊溶液(或酚酞试液);
②用玻璃棒蘸取少量试液滴于红色石蕊试纸上
①紫色石蕊溶液变蓝(或酚酞试液变红);
②红色石蕊试纸变蓝
Cl−
取少量试液于试管中,向其中滴加少量AgNO3溶液,再加入稀硝酸
生成白色沉淀,且不溶于稀硝酸
Ag++Cl−AgCl↓
Br−
取少量试液于试管中,向其中滴加少量AgNO3溶液,再加入稀硝酸
生成浅黄色沉淀,且不溶于稀硝酸
Ag++Br−AgBr↓
I−
①取少量试液于试管中,向其中滴加少量AgNO3溶液,再加入稀硝酸;
②滴入淀粉溶液后再滴入氯水
①生成黄色沉淀,且不溶于稀硝酸;
②溶液显蓝色
①Ag++I− AgI↓
②2I−+Cl22Cl−+I2,淀粉遇碘变蓝色
氯化钡溶液、稀硝酸
生成白色沉淀,加稀硝酸后白色沉淀溶解,产生无色无味气体
Ba2++BaCO3↓
BaCO3+2H+ Ba2++
CO2↑+H2O
氯化钡溶液、稀盐酸
不生成沉淀,加稀盐酸,产生无色无味气体
+H+ CO2↑+H2O
氯化钡溶液、盐酸、品红溶液
先生成白色沉淀,加盐酸后白色沉淀溶解,将生成的气体通入品红溶液中,溶液褪色
Ba2++ BaSO3↓
BaSO3+2H+ Ba2++
SO2↑+H2O
取少量试液于试管中,向其中加入足量稀盐酸后,再加入BaCl2溶液
加入盐酸不产生沉淀,加入BaCl2溶液后生成白色沉淀
Ba2++ BaSO4↓
加热浓缩溶液,加入浓硫酸和铜片
有红棕色的气体产生,溶液变蓝色
Cu+4H++2Cu2++2NO2↑+2H2O
S2−
①稀硫酸或盐酸;
②Pb(NO3)2溶液、稀硝酸
①生成无色有臭鸡蛋气味的气体;
②生成黑色沉淀,且不溶于稀硝酸
①S2−+2H+H2S↑
②S2−+Pb2+PbS↓(黑色)
选项
离子
检验方法
A
向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊
B
向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成
C
Fe2+
取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去
D
I-
取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I−
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无
选项
实验操作
现象
结论
A
向NaAlO2溶液中滴入NaHCO3溶液
有白色沉淀生成
AlOeq \\al(-,2)结合H+的能力比COeq \\al(2-,3)强
B
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液
溶液显红色
Fe(NO3)2样品已氧化变质
C
用洁净的铂丝蘸取某溶液进行焰色反应
火焰呈黄色
原溶液中一定有Na+、无K+
D
向某无色溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NHeq \\al(+,4)
阳离子
Fe3+、Na+ 、Mg2+、Ba2+、NH
阴离子
OH-、C1-、I-、SO、CO
步骤
实验目的
试剂
现象
1
2
3
检验CO2
澄清石灰水
溶液变浑浊
可能大量含有的阳离子
H+、K+、Mg2+、Al3+、、Fe2+、Fe3+
可能大量含有的阴离子
Cl-、Br-、I-、、
Cl2的体积(标准状况)
2.8 L
5.6 L
11.2 L
n(Cl-)
1.25 ml
1.5 ml
2 ml
n(Br-)
1.5 ml
1.4 ml
0.9 ml
n(I-)
a ml
0
0
专题复习 高考化学 考点28 元素位置、原子结构、元素性质之间的相互推断 讲义: 这是一份专题复习 高考化学 考点28 元素位置、原子结构、元素性质之间的相互推断 讲义,共21页。试卷主要包含了“位”、“构”、“性”关系等内容,欢迎下载使用。
考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战高考化学一轮复习(新高考专用): 这是一份考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战高考化学一轮复习(新高考专用),文件包含考点03离子共存离子的检验与推断核心考点精讲精练-备战高考化学一轮复习新高考专用教师版docx、考点03离子共存离子的检验与推断核心考点精讲精练-备战高考化学一轮复习新高考专用学生版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
新高考化学复习讲义+练习 第06讲 离子共存、离子的检验与推断(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第06讲 离子共存、离子的检验与推断(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第06讲离子共存离子的检验与推断讲义原卷版+解析docx、新高考化学复习讲义+练习第06讲离子共存离子的检验与推断练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共47页, 欢迎下载使用。












