高中人教版 (2019)第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识课时作业
展开一、单选题(本大题共15小题,共45.0分)
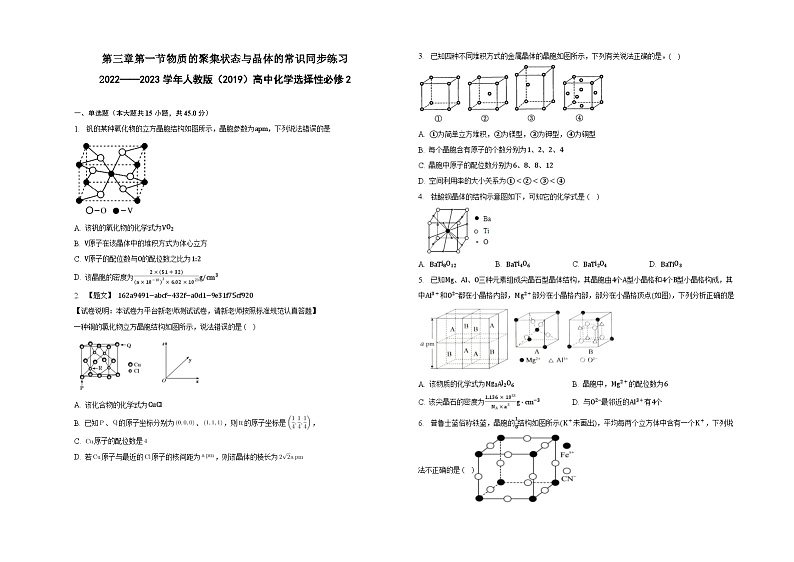
1. 钒的某种氧化物的立方晶胞结构如图所示,晶胞参数为apm,下列说法错误的是
A. 该钒的氧化物的化学式为VO2
B. V原子在该晶体中的堆积方式为体心立方
C. V原子的配位数与O的配位数之比为1:2
D. 该晶胞的密度为2×(51+32)(a×10−10)3×6.02×1023g/cm3
2. 【题文】 162a9491−abcf−432f−a0d1−9e31f75cf920
【试卷说明:本试卷为平台新老师测试试卷,请新老师按照标准规范认真答题】
一种铜的氯化物立方晶胞结构如图所示,说法错误的是( )
A. 该化合物的化学式为CuCl
B. 已知、的原子坐标分别为、,则的原子坐标是,
C. 原子的配位数是
D. 若原子与最近的原子的核间距为,则该晶体的棱长为
3. 已知四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是。( )
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有原子的个数分别为1、2、2、4
C. 晶胞中原子的配位数分别为6、8、8、12
D. 空间利用率的大小关系为①<②<③<④
4. 钛酸钡晶体的结构示意图如下,可知它的化学式是 ( )
A. BaTi8O12B. BaTi4O6C. BaTi2O4D. BaTiO3
5. 已知Mg、Al、O三种元素组成尖晶石型晶体结构,其晶胞由4个A型小晶格和4个B型小晶格构成,其中Al3+和O2−都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点(如图),下列分析正确的是
A. 该物质的化学式为Mg3Al2O6B. 晶胞中,Mg2+的配位数为6
C. 该尖晶石的密度为1.136×1033NA×a3g⋅cm−3D. 与O2−最邻近的Al3+有4个
6. 普鲁士蓝俗称铁蓝,晶胞的18结构如图所示(K+未画出),平均每两个立方体中含有一个K+,下列说法不正确的是( )
A. 化学式可以表示为KFe2(CN)6
B. 又知该晶体中铁元素有+2价和+3价两种,则Fe3+与
Fe2+的个数比为1:2
C. 一个晶胞中K+的个数为4个
D. 通过X射线衍射实验可确定晶胞的结构
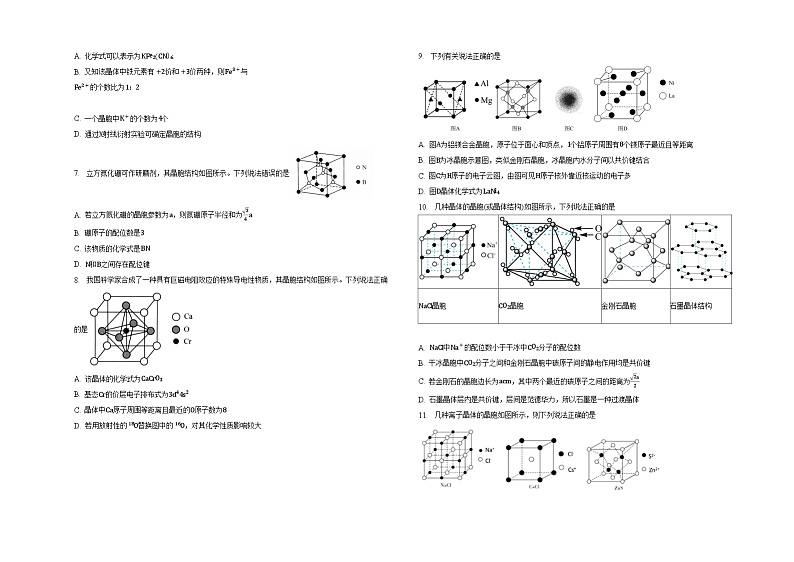
7. 立方氮化硼可作研磨剂,其晶胞结构如图所示。下列说法错误的是
A. 若立方氮化硼的晶胞参数为a,则氮硼原子半径和为34a
B. 硼原子的配位数是3
C. 该物质的化学式是BN
D. N和B之间存在配位键
8. 我国科学家合成了一种具有巨磁电阻效应的特殊导电性物质,其晶胞结构如图所示。下列说法正确的是
A. 该晶体的化学式为CaCrO3
B. 基态Cr的价层电子排布式为3d44s2
C. 晶体中Ca原子周围等距离且最近的O原子数为8
D. 若用放射性的 18O替换图中的 16O,对其化学性质影响较大
9. 下列有关说法正确的是
A. 图A为铝镁合金晶胞,原子位于面心和顶点,1个铝原子周围有8个镁原子最近且等距离
B. 图B为冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
C. 图C为H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D. 图D晶体化学式为LaNi4
10. 几种晶体的晶胞(或晶体结构)如图所示,下列说法正确的是
A. NaCl中Na+的配位数小于干冰中CO2分子的配位数
B. 干冰晶胞中CO2分子之间和金刚石晶胞中碳原子间的静电作用均是共价键
C. 若金刚石的晶胞边长为acm,其中两个最近的碳原子之间的距离为2a2
D. 石墨晶体层内是共价键,层间是范德华力,所以石墨是一种过渡晶体
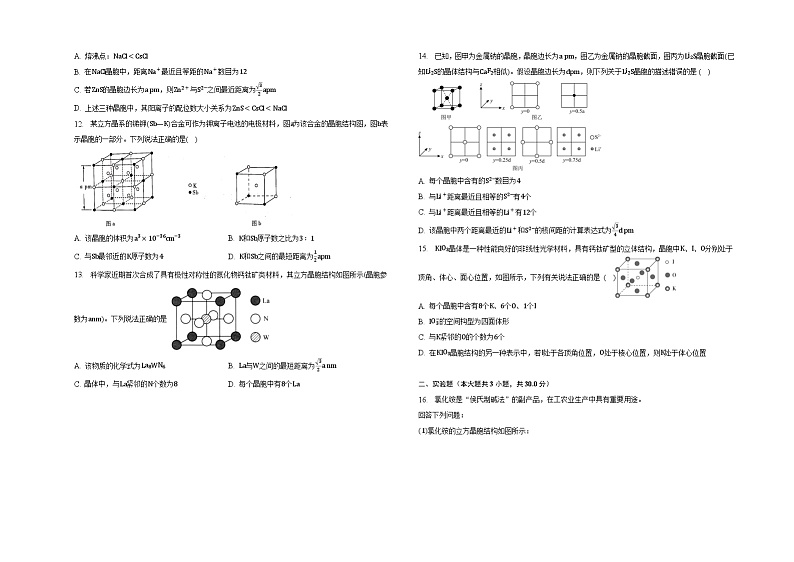
11. 几种离子晶体的晶胞如图所示,则下列说法正确的是
A. 熔沸点:NaCl
C. 若ZnS的晶胞边长为a pm,则Zn2+与S2−之间最近距离为32apm
D. 上述三种晶胞中,其阳离子的配位数大小关系为ZnS
A. 该晶胞的体积为a3×10−36cm−3B. K和Sb原子数之比为3∶1
C. 与Sb最邻近的K原子数为4D. K和Sb之间的最短距离为12apm
13. 科学家近期首次合成了具有极性对称性的氮化物钙钛矿类材料,其立方晶胞结构如图所示(晶胞参数为anm)。下列说法正确的是
A. 该物质的化学式为La8WN6B. La与W之间的最短距离为32a nm
C. 晶体中,与La紧邻的N个数为8D. 每个晶胞中有8个La
14. 已知,图甲为金属钠的晶胞,晶胞边长为a pm,图乙为金属钠的晶胞截面,图丙为Li2S晶胞截面(已知Li2S的晶体结构与CaF2相似)。假设晶胞边长为dpm,则下列关于Li2S晶胞的描述错误的是( )
A. 每个晶胞中含有的S2−数目为4
B. 与Li+距离最近且相等的S2−有4个
C. 与Li+距离最近且相等的Li+有12个
D. 该晶胞中两个距离最近的Li+和S2−的核间距的计算表达式为34d pm
15. KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示,下列有关说法正确的是 ( )
A. 每个晶胞中含有8个K、6个O、1个I
B. IO3−的空间构型为四面体形
C. 与K紧邻的O的个数为6个
D. 在KIO3晶胞结构的另一种表示中,若I处于各顶角位置,O处于棱心位置,则K处于体心位置
二、实验题(本大题共3小题,共30.0分)
16. 氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。
回答下列问题:
(1)氯化铵的立方晶胞结构如图所示:
①与NH4+等距离且最近的Cl−有______个。
②若氯化铵的密度为dg/cm3,设NA为阿伏加德罗常数的值,则晶胞参数a=___________nm(用含d、NA的代数式表示)。
(2)银氨溶液的配制,从电极反应角度探究银镜反应中物质氧化性和还原性的变化进行探究。
资料:ⅰ. [Ag(NH3)2]+⇌ [Ag(NH3)]++ NH3 K1=10−3.81
[Ag(NH3)]+ ⇌ Ag++ NH3 K2=10−3.24
ⅱ. AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______________________________________________________。
(3)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++ e− = Ag
ⅱ.氧化反应: _______________________________(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。 ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_________________________________________________________。
(4)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_____________________________________________。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是−3价的N也参与了还原+1价的Ag。经检验该假设成立,实验方案及现象是___________。
17. 氧化铍(BeO)和氧化铋(Bi2O3)为电子陶瓷粉体材料中的重要添加剂。
Ⅰ.实验室中常用氯氧化铋(BiOCl)制备。回答下列问题:
(1)工业上将金属铋(Bi)溶于足量的稀硝酸得到硝酸铋[Bi(NO3)3]溶液,所得溶液经浓缩结晶、过滤、洗涤、干燥后得硝酸铋晶体,最后煅烧硝酸铋晶体即得氧化铋产品。金属铋(Bi)溶于足量稀硝酸得到硝酸铋溶液的离子方程式:_____________________________________。
(2)将3.0 g氯氧化铋(BiOCl,白色,难溶于水)与25 mL 3 ml·L−1碳酸氢铵溶液混合,加入氨水调节溶液pH=9,50℃下反应2 h脱氯可得到(BiO)2CO3沉淀,反应装置如图甲所示(加热及夹持装置已省略),再将所得沉淀干燥并在530℃下煅烧,可得到氧化铋产品。
①图甲中仪器c的名称为_______,当观察到澄清石灰水变浑浊时说明反应过程中产生了CO2,写出产生(BiO)2CO3沉淀的化学方程式:_____________。
②加氨水调节pH为9有利于生成(BiO)2CO3沉淀的原因是____________________________。
③某研究小组探究温度对沉淀制备的影响,得到温度与所得沉淀产率的关系如图乙所示。结合图像分析,50℃时沉淀产率最高的原因是温度低于50℃时,BiOCl固体在水中的溶解度小,导致沉淀的产率降低;温度高于50℃时,_____________________________________。
(3)煅烧(BiO)2CO3时用到的硅酸盐制品有_______、酒精灯、玻璃棒、泥三角。
Ⅱ.BeO晶体的晶胞结构与ZnS的相似,如图所示。
(4)O原子的配位数是_______。
(5)设O原子与O原子的最近距离为apm,BeO晶体的密度为dg·cm−3,则阿伏加德罗常数的值为_______(用含a和d的代数式表示)。
18. 碳、硅及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Si原子有___________种空间运动状态的电子。
(2)C、O、Si电负性由小到大的顺序为___________;
(3)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:
化学键键能(kJ/ml)
SiO2晶体中Si原子采取的构型是___________(填“甲”或“乙”),从能量角度解释Si原子采取该构型的原因是___________。
碳化硅(SiC)是人工合成的无机非金属材料,其晶体结构类似于金刚石,结构如图:
(4)在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是___________(填序号)。
a.· b.
c. d.
(5)SiC晶体中硅原子与离其最近的原子间距离为d,则硅原子与离其次近的原子间距离为___________,一个硅原子周围与其次近的原子的数目为___________。
三、简答题(本大题共2小题,共16.0分)
19. CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为________,S、O、N三种元素的第一电离能由大到小为________。
(2)SO42−的立体构型是________,与SO42−互为等电子体的一种分子为________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。该配合物的中心离子是________,配体是________,NO3−中心原子的杂化轨道类型为________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________。
(5)利用CuSO4和NaOH溶液制备的Cu(OH)2检验醛基时,可生成红色的Cu2O。Cu2O的晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(12,12,12)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体的密度为d g﹒cm−3,晶胞参数为a nm,则阿伏加德罗常数的值NA=________。
20. 含铁元素的化合物和含碘元素的化合物在生活和生产中应用及其广泛。
(1)Fe元素在元素周期表中位于_______区,Fe3+的最外层电子排布式为_______
(2)要验证太阳上是否含有稀有气体Ar,可采用的方法是_______
(3)根据价层电子对互斥理论计算I3−的中心原子I周围的孤对电子对数为_______对
(4)可以通过向FeCl3溶液中滴加黄血盐K4[Fe(CN)6]制备普鲁士蓝,向FeCl2溶液中滴赤血盐K3[Fe(CN)6]制备滕氏蓝。普鲁士蓝和滕氏蓝过去在很长一段时间被视为两种物质,但近代经X射线研究发现两者的晶胞都是如图所示的结构。
①该物质的化学式为_______
②一个正方体中含有的π键数目为_______个
③下列说法正确的是_______
A.上述制备普鲁士蓝和滕士蓝办法都是氧化还原法
B.上图未标出K+,如果图为晶胞,则K+位于晶胞体心
C.普鲁士蓝和滕士蓝是具备空间网状构造原子晶体
D.图中Fe2+和Fe3+位置不能互换
(5)NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1,测知FexO中x=0.92。
①此晶体中Fe2+与Fe3+的个数比为_______
②与Fe2+(或Fe3+)距离最近且等距离的O2−围成的空间几何形状是_______
(6)KI的晶胞结构与NaCl晶胞结构相似,已知其晶体的密度为ρ g/cm3,K和I的摩尔质量分别为Mkg·ml−1和MIg·ml−1,原子半径分别为rkpm和rIpm,阿伏加德罗常数的值为NA,则晶胞中原子的体积占晶胞体积的百分率为_______(写表达式即可)
答案和解析
1.【答案】C
【解析】
【分析】
本题为物质结构与性质的考查,涉及化学式、堆积方式、配位数、密度的计算等多个方面的知识,均摊法和晶胞的相关计算是解题的关键,题目难度中等。
【解答】
A、晶胞中V原子位于顶点和体心,数目为:1+8×18=2;O原子位于上下面上和体内,数目=2+4×12=4,二者原子数目之比为1:2,故氧化物化学式为VO2,故A正确;
B、晶胞中V原子位于顶点和体心,符合体心立方的堆积方式,故B正确;
C、体心V原子的配位数为6,O原子配位数为3,所以V原子的配位数与O的配位数之比为2:1,故C错误;
D、m=2×51+4×16NAg,V=a3pm3=(a×10−10)3cm3,ρ=mV=2×(51+16×2)(a×10−10)3×6.02×1023g⋅cm−3,故D正确。
2.【答案】D
【解析】
【分析】
本题考查晶胞计算,侧重考查分析判断及空间想像能力,利用均摊法确定化学式,明确铜原子与氯原子的空间位置和坐标是解答的关键,题目难度中等。
【解答】
A.由晶胞结构可知,Cl原子处于晶胞内部,晶胞中含有4个Cl原子,Cu原子属于顶点与面心上,晶胞中含有Cu原子数目为8×18+6×12=4,故该化合物的化学式为CuCl,故A正确;
B.已知P、Q的原子坐标分别为(0,0,0)、(1,1,1),则R为包含P在内的八分之一个晶胞的中心,故R原子坐标是
(14,14,14),故B正确;
C.由图知,距离Cu最近且等距的氯原子有4个,则Cu原子的配位数是4,故C正确;
D.若Cu原子与最近的CI原子的核间距为apm,即为晶胞立方体体对角线的14,而体对角线为晶胞边长的3倍,则该晶体的棱长为433apm,故D错误;
故选D。
3.【答案】B
【解析】
【分析】
本题考查金属堆积,侧重考查学生空间想象能力、计算能力,知道每种堆积模型中典型金属,难点是计算配位数,题目难度中等。
【解答】
②为体心立方堆积,属于钾、钠、铬型;③是六方最密堆积,属于镁、锌、钛型,A项错误。
利用均摊法计算原子个数,①中原子个数为8×18=1,②中原子个数为8×18+1=2,③中原子个数为8×18+1=2,④中原子个数为8×18+6×12=4,B项正确。
③为六方最密堆积,此结构为六方锥晶胞的13,配位数为12,C项错误。
③④的空间利用率最高,都是74%,①中简单立方堆积空间利用率最小,为52%,②中体心立方堆积空间利用率为68%,所以空间利用率大小顺序为①<②<③=④,D项错误。
4.【答案】D
【解析】
【分析】
本题主要就考查了均摊法计算晶胞的组成,难度不大,解题关键是要看清晶胞在有关原子所在的位置,根据均摊法可以进行计算出晶胞中含有各种原子的个数,进而确定化学式,据此答题.
【解答】
由晶胞结构示意图可知,Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶点,每个Ti有18属于该晶胞;O处于立方体的12条棱的中点,每个O有14属于该晶胞。即晶体中N(Ba):N(Ti):N(O)=1:(8×18):(12×14)=1:1:3,所以化学式为:BaTiO3,
故选:D。
5.【答案】C
【解析】
【分析】
本题主要考查的是晶胞结构分析和相关计算,意在考查学生的分析能力和空间想象能力,解题的关键是理清不同微粒在晶胞中的相对位置。
【解答】
A.由晶胞结构可知,1个A晶格中有4个镁离子在顶点,1个在体心,1个A中的镁离子个数为:1+4×18=32,1个B晶格中有4个镁离子在顶点,1个B中的镁离子个数为:4×18=12,则该晶胞中镁离子个数为:32×4+12×4=8;1个A晶格和1个B晶格中均含有4个氧离子,则氧离子个数为4×8=32个,每个B晶格中含有4个铝离子,铝离子个数为4×4=16,该物质的化学式为MgAl2O4,A错误;
B.由A晶格结构可知每个Mg2+与4个氧离子紧相邻,其配位数为4,B错误;
C.由A项可知晶体中含有Mg、Al、O的个数,晶胞的质量为8×24+16×27+32×16NAg=1136NAg,晶胞边长为apm.所以晶体的密度ρ=1136gNA×a3×10−30cm3=1.136×1033NA×a3g⋅cm−3,C正确;
D.与O2−最邻近的Al3+在B区,由图可知,O2−、Al3+构成的立方体中,与O2−最临近的Al3+为顶点的3个,在A区中无铝离子,D错误。
6.【答案】B
【解析】
【分析】
本题考查晶胞计算,为高频考点,把握均摊法计算为解答的关键,侧重分析与计算能力的考查,题目难度不大。
【解答】
A.平均每两个立方体中含有一个K+,根据晶胞的18结构图,所以该立方体中钾离子个数=1×12=0.5,该立方体中Fex+个数=18×8=1,CN−位于每条棱中点,该立方体中含有CN−个数=12×14=3,所以平均化学式是K 0.5Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
B.KFe2(CN)6中Fe平均化合价为2.5,所以Fe3+与Fe2+的个数比为1:1,故B错误;
C.平均每两个立方体中含有一个K+,根据晶胞的18结构图,所以该立方体中钾离子个数=1×12=0.5,一个晶胞中K+的个数为4个,故C正确;
D.测定晶体的结构的方法,常采用X射线衍射法,故D正确。
7.【答案】B
【解析】
【分析】
本题考查晶胞结构,难度一般,掌握晶胞的结构及相关计算和配位数判断、均摊法即可解答。
【解答】
A.若立方氮化硼的晶胞参数为a,则该晶胞的体对角线为3a,则氮硼原子半径和为34a,故A正确;
B.由晶胞结构知,硼原子位于晶胞顶点和面心,离硼原子最近的氮原子共4个,则硼原子的配位数为4,故B错误;
C.立方氮化硼晶胞中N原子个数是4、B原子个数=8×18+6×12=4,化学式为BN,故C正确;
D.B原子含有空轨道、N原子含有孤电子对,立方氮化硼中每个B原子形成4个B−N共价键,所以立方氮化硼中B和N原子之间存在配位键,故D正确。
8.【答案】A
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.从晶胞图中可看到Ca在晶胞的顶点,数目为8×18=1,Cr在体心,数目是1个;O原子在晶胞的面心,数目为6×12=3,化学式为CaCrO3,故A正确;
B.基态Cr的价层电子排布式为3d54s1,故B错误;
C.与Ca配位的O位于晶胞面对角线的中点,距离Ca相等的共有12个,故C错误;
D. 18O和16O互为同位素,形成的化合物在化学性质上无差异,故D错误。
9.【答案】A
【解析】
【分析】
本题考查晶体知识,为高频考点,侧重考查学生的分析能力,主要晶胞的化学式计算以及共价键、分子间作用力的区别,题目难度中等。
【解答】
A.与侧面面心的Al原子等距离且最近的Mg原子处于该面的4个顶点及面心位置,而每个侧面为2个晶胞共有,故1个铝原子周围有8个镁原子最近且等距离,故A正确;
B.共价键存在于分子内,水分子间为分子间作用力,冰晶胞中主要是氢键,故B错误;
C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,只能说H原子的一个电子在原子核附近出现的概率密度大,故C错误;
D.根据均摊法可知黑球有4×12+4×12+1=5个Ni,白球有8×18=1个La,图D晶体化学式为LaNi5,故 D错误。
10.【答案】A
【解析】
【分析】
本题考查晶体结构,难度一般,理解晶体结构是解题关键。
【解答】
A.NaCl晶胞中每个Na+周围有6个Cl−,所以配位数为6,CO2晶胞中的配位数为:3×82=12,A正确;
B.干冰晶胞中CO2分子之间是分子间作用力,金刚石晶胞中碳原子间是共价键,B错误;
C.若金刚石的晶胞边长为acm,两个碳原子之间的最短距离为体对角线的四分之一,即34acm,C错误;
D.石墨晶体层内是共价键,层间是范德华力,所以石墨晶体兼有共价晶体、分子晶体、金属晶体的特征,属于混合晶体, D错误。
11.【答案】B
【解析】
【分析】
本题考查晶胞中均摊法的运用,以及配位数的计算,根据不同晶胞中的粒子排布分析,需要对这些常见的晶胞有一定程度的认知,难度不大。
【解答】
A.r(Na+)
B.在NaCl晶胞中,距离Na+最近且等距的Na+数目为12,故B正确;
C.在ZnS晶胞中,最近的Zn2+与S2−之间的距离是体对角线的14,即34a pm,故C错误;
D.NaCl晶胞中,Na+周围最近且距离相等的Cl−有6个,即配位数为6;CsCl晶胞中,Cs+的配位数为8;ZnS晶胞中,Zn2+的配位数为4,阳离子的配位数:ZnS
【解析】
【分析】
本题考查了晶胞相关计算,整体难度中等,掌握晶胞中原子数目计算方法解答本题的关键。
【解答】
A.该晶胞为正四面体结构,边长为a×10−10cm,该晶胞的体积为a3×10−30 cm3,A错误;
B.K原子数为12×1/4+8+1=12,Sb原子数为8×1/8+6×1/2=4,K和Sb原子数之比为3:1,B正确;
C.与Sb最邻近的K原子数为6,C错误;
D.K和Sb之间的最短距离为晶胞体对角线的1/4,即3a4pm,D错误。
13.【答案】B
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.晶胞中,W原子数目为1,N原子数目为6×12=3,La原子数目为8×18=1,化学式为LaWN3;
B.La与W之间的最短距离为体对角线的12,为32a nm;
C.与La紧邻的N个数为12;
D.每个晶胞中有La原子数目为8×18=1;
14.【答案】C
【解析】
【分析】
本题考查晶胞计算,侧重考查空间想象能力及计算能力,正确判断晶胞中阴阳离子位置关系是解本题关键,知道密度的计算方法,题目难度较大。
【解答】
根据图丙知,Li2S晶胞如图,
A.该晶胞中S2−个数=8×18+6×12=4,故A正确;
B.每个Li+连接4个S2−,所以与Li+距离最近且相等的S2−有4个,故B正确;
C.与Li+距离最近且相等的Li+不是12个,故C错误;
D.该晶胞中两个距离最近的Li+和S2−的核间距为晶胞体对角线长度的14,为34d pm,故D正确。
15.【答案】D
【解析】
【分析】
本题考查离子的空间构型、晶胞的相关知识等,难度不大,解题关键是对基础知识的灵活运用。
【解答】
A. K位于顶点,个数为8×18=1,O位于面心,个数为6×12=3,I位于体心,个数为1,故A错误;
B. IO3−中,中心原子价层电子对个数=3+12×(7+1−3×2)=4,且含有一个孤电子对,所以为三角锥形结构,故B错误;
C. 由晶胞结构可知,与K紧邻的O有12个,故C错误;
D. 在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×18=1,O位于棱心位置,每个棱为4个晶胞共有,O个数为12×14=3,K的个数为1,应位于体心位置,故D正确;
故选D。
16.【答案】(1)①8 ②353.5NA⋅d×107
(2) AgNO3 + 2NH3·H2O = Ag(NH3)2NO3 + 2H2O
(3)①CH3CHO–2e−+3OH−=CH3COO−+2H2O;
③可能是硝酸银溶液中的NO3−或O2等微粒做氧化剂,其氧化性随酸性减弱而减弱
(4)①合理,[Ag(NH3)]+ ⇌ Ag++ NH3,c(NH3)增大,平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,未发生银镜反应;或不合理,灰色浑浊中可能有Ag,Ag+得电子未在试管壁析出,所以无法判断。
②不加乙醛重复实验 Ⅴ 中的操作,试管壁出现银镜;或将氨通入含NaOH的潮湿Ag2O固体,水浴加热后出现银镜。
【解析】
【分析】
本题考查物质结构、原电池反应原理探究、氧化还原反应的原理,难度中等,涉及电极式的书写、氧化还原反应规律、配位数、晶胞计算等知识点,注意日常学习中的积累,有利于培养学构建思维导图,化学学科素养的培养。
【解答】
(1)①结合图片,体心的NH4+等距离且最近的Cl−有8个; ②dg/cm3=53.5gNA×1(a×10−7)3,则晶胞参数a=353.5NA⋅d×107nm
(2)在洁净的试管中加入1mL2%AgNO3溶液,然后边振荡试管边逐滴滴入2%氨水,使最初产生的沉淀溶解,制得银氨溶液;AgNO3和氨水生成Ag(NH3)2NO3,生成Ag(NH3)2NO3的化学方程式为:
AgNO3 + 2NH3·H2O = Ag(NH3)2NO3 + 2H2O
(3)①甲同学查阅资料:银镜反应时,Ag+被还原成Ag;CH3CHO发生氧化反应,由于反应在碱性条件下进行,则CH3CHO被氧化成CH3COO−,电极反应式为:CH3CHO–2e−+3OH−=CH3COO−+2H2O
③AgNO3属于强酸弱碱盐,其水溶液呈酸性,AgNO3溶液中的NO3−以及溶解的O2等微粒也具有氧化性,也可能将做氧化剂将乙醛氧化,实验Ⅲ中向左侧烧杯中滴加氨水,随着溶液酸性的减弱,这些微粒的氧化性也会减弱,从而使得指针的偏转幅度减小,不能证明“随c(Ag+)降低,Ag+氧化性减弱”,
故答案为:可能是硝酸银溶液中的NO3−或O2等微粒做氧化剂,其氧化性随酸性减弱而减弱
(4)①由于溶液中存在平衡:[Ag(NH3)]+⇌Ag++NH3,实验IV向银氨溶液中滴加浓氨水,c(NH3)增大,上述平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,故未发生银镜反应;但实验IV的现象中溶液略显灰色,该灰色浑浊中可能有Ag,正一价的银得电子未在试管壁析出,故也可能无法判断,
故答案为:合理,[Ag(NH3)]+⇌Ag++NH3,c(NH3)增大,平衡逆向移动,c(Ag+)降低,Ag+氧化性减弱,未发生银镜反应;或不合理,灰色浑浊中可能有Ag,正一价的银得电子未在试管壁析出,所以无法判断;
②实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是N−3也参与了还原Ag+1,要检验该假设成立,可采用对比实验,实验方案及现象为:不加乙醛重复实验Ⅴ中的操作,试管壁出现银镜或将氨通入含NaOH的潮湿Ag2O固体(结合题给资料ii),水浴加热后出现银镜,
故答案为:不加乙醛重复实验Ⅴ中的操作,试管壁出现银镜或将氨通入含NaOH的潮湿Ag2O固体,水浴加热后出现银镜;
17.【答案】(1)Bi+4H++NO3−=Bi3++NO↑+2H2O
(2)①分液漏斗; 2BiOCl+2NH4HCO3(BiO)2CO3+2NH4Cl+CO2↑+H2O
②氨水会与HCO3−反应生成CO32−
③NH3⋅H2O分解,使溶液的pH降低,不利于CO32−的形成,导致沉淀的产率降低
(3)坩埚
(4)2
(5)252a3d×1030
【解析】
【分析】
本题以氧化铋的制取为载体,考查陌生方程式的书写、对原理的分析评价、仪器识别、对试剂与条件控制的分析评价、晶胞计算等,是对学生综合能力的考查。
【解答】
(1)金属与稀硝酸反应时,硝酸一般被还原为NO,Bi与稀硝酸生成Bi(NO3)3、NO与水,反应离子方程式为:Bi+4H++NO3−=Bi3++NO↑+2H2O;
(2)①由仪器结构特征可知,仪器c为分液漏斗;BiOCl与NH4HCO3反应有(BiO)2CO3和CO2生成,可以理解为:2mlBiOCl与1mlNH4HCO3反应生成1ml(BiO)2CO3、1mlNH4Cl、1mlHCl,生成的HCl又与NH4HCO3反应生成NH4Cl、CO2、H2O产生(BiO)2CO3沉淀的化学方程式:2BiOCl+2NH4HCO3(BiO)2CO3+2NH4Cl+CO2↑+H2O;
②氨水显碱性,会与HCO3−反应生成大量的CO32−,有利于生成(BiO)2CO3沉淀;
③温度高于50℃时,NH3⋅H2O分解,氨气逸出,溶液pH降低,不利于CO32−的形成,使沉淀产率降低;
(3)灼烧(BiO)2CO3时用到的硅酸盐制品有坩埚、酒精灯、玻璃棒、泥三角;
(4)以顶面的O原子为例,该晶胞中有2个Be原子与其配位,该晶胞上方的晶胞中也含有2个Be原子与其配位,所以O原子的配位数为4;
(5)O原子与O原子的最近距离为面对角线的一半,设晶胞的棱长为x,则有2x=2apm,所以x=2apm=2a×10−10cm,则晶胞的体积为22a3×10−30cm3,根据Be原子的个数可知晶胞中含有4个BeO单元,所以晶胞的质量为(9+16)×4NAg,所以有(9+16)×4NAg22a3×10−30cm3=dg/cm3,解得NA=252a3d×1030。
18.【答案】(1)14
(2) Si
(4)a
(5) 263d 3
【解析】
【分析】本题考查物质结构和性质,侧重考查基础知识的掌握和运用、空间想象能力及计算能力,明确元素周期律、原子结构、晶胞计算方法是解本题关键,难点是(4)②题的计算,注意该题采用的解题方法,题目难度中等。
【解答】(1)基态Si原子电子排布1s22s22p63s23p2,其空间运动状态电子就有14种,
故答案为:14;
(2)元素对键合电子吸引力:Si
故答案为:乙;Si原子与O原子形成4个Si−O键的总键能比生成两个Si=O键的总键能大,体系更稳定,所以SiO2采用乙构型更稳定;
(4)硅原子半径比碳原子大,从图中微粒大小关系判断,较小的碳原子在碳化硅立方晶胞的八个顶点和六个面面心位置,较大的硅原子在体对角线高顶点14处,且四个硅原子对应的顶点处于交错位置,和该顶点所在面的面心构成正四面体,一个晶胞内体对角线均分四段,五个点上的原子顺序是“碳−硅−空−空−碳”,
故答案为:a;
(5)如果SiC晶体中硅原子与最近碳原子间距离为d,为晶胞体对角线长度的14,晶胞边长为4d3,硅原子与离其次近的原子间距离为同一平面上两个Si原子之间的距离,其距离为面对角线长度的一半=22×4d3pm=263d;
每个晶胞中硅原子与离其次近的原子间距离为同一平面上两个Si原子之间的距离,如果将晶胞中Si原子位于顶点和面心上,则C原子处于原来晶胞中Si原子位置,则新的晶胞中距离顶点上Si原子次近的距离为面心上Si原子,每个晶胞中距离顶点Si原子次近的Si原子个数为3.
故答案为:263d;3。
19.【答案】(1)1s22s22p63s23p63d9或[Ar]3d9;N>O>S;
(2)正四面体;CCl4(或SiF4等);
(3)Cu2+;NH3;sp2;
(4)CuSO4和Cu(NO3)2均为离子晶体,SO42−所带电荷比NO3−大,故CuSO4晶格能较大,熔点较高;
(5)①(14,14,14);Cu;②288×1021d×a3
【解析】
【分析】
本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间构型、等电子体、杂化方式、化学键、晶体类型与性质、晶胞结构与计算等,注意同周期第一电离能变化异常情况,掌握均摊法进行晶胞有关计算。
【解答】
(1)Cu是29号元素,原子核外电子排布式为1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级1个电子形成Cu2+,故Cu2+核外电子排布式为:1s22s22p63s23p63d9,同主族自上而下第一电离能减小,N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能为:N>O>S,
故答案为:1s22s22p63s23p63d9;N>O>S;
(2)SO42−中S原子孤电子对数=6+2−2×42=0,价层电子对数=4+0=4,离子空间构型为正四面体形,SO42−中含有5个原子、价电子总数为32,没有原子平均价电子数为6.4,与之等电子体的分子只能是最外层电子数为7的4个原子与最外层电子数为4的1个原子形成的微粒,有CCl4(或SiF4)等,
故答案为:正四面体;CCl4(或SiF4);
(3)配合物中,配位体:提供孤电子对的分子或离子;中心离子:一般指接受电子对的原子;配位数:中心原子周围的配位原子个数,所以在配合物[Cu(NH3)4](NO3)2中,Cu2+为中心离子,NH3为配体,NO3−中心原子N的孤电子对数=5+1−2×32=0,杂化轨道数目=3+0=3,N原子杂化方式为:sp2;
故答案为:Cu2+;NH3;sp2;
(4)CuSO4和Cu(NO3)2均为离子晶体,SO42−所带电荷比NO3−大,故CuSO4晶格能较大,熔点较高,
故答案为:CuSO4和Cu(NO3)2均为离子晶体,SO42−所带电荷比NO3−大,故CuSO4晶格能较大,熔点较高;
(5)①D在A、C连线中点位置,A、D距离等于晶胞体对角线的14,D到各坐标平面距离均等于晶胞棱长的14,由B的参数可知晶胞棱长为1,故D的坐标参数为:(14,14,14),晶胞中黑色球数目=4,白色球数目=1+8×18=2,二者数目之比为2:1,化合物化学式为Cu2O,故黑色球代表Cu、白色球代表O,即D代表Cu原子,
故答案为:(14,14,14);Cu;
②晶胞质量=4×64+2×16NAg=d g⋅cm−3×(a×10−7cm)3,故NA=288×1021d×a3,
故答案为:288×1021d×a3。
20.【答案】(1) d 3s 23p 63d 5
(2)对太阳光进行光谱分析
(3)3
(4)KFe2(CN)6 ; 6 D
(5)19:4 正八面体
(6)4π ×10−30NAρ(rk3+r13)3(Mk+Mr)×100%
【解析】
【分析】本题考查元素周期表结构、核外电子排布式、“均摊法”确定晶体化学式、晶胞概念与常见结构、σ键与π键、配位数及相关数目的判断等知识,难度中等。
【解答】(1)Fe元素原子序数26,在元素周期表中位于d区,Fe3+的最外层电子排布式为 3s 23p 63d 5
(2)要验证太阳上是否含有稀有气体Ar,可采用的方法是:对太阳光进行光谱分析
(3)I3−中心I原子外层8个电子,其中两个分别和两端I原子生成共价键,剩余6个电子是3对孤对电子。
(4)①立方体结构中Fe3+离子的个数为:4×18=12,Fe2+离子的个数为:4×18=12,CN−离子的个数为:12×14=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN−),得N(K+)=12,
普鲁士蓝中n(K+):n(Fe3+):n(Fe2+):n(CN−)=1:1:1:6,则其化学式为KFe[Fe(CN)6];②每个CN−含有2个π键,每个立方体中含有CN−个数为3,所以一个立方体中含有6个π键,
③由题意可知,在制备普鲁士蓝和藤士蓝时,没有元素法生价态变化。产物应该是一种盐,晶体是离子晶体。若晶胞体心有一K+,其电荷也不平衡,故ABC错误,答案为D。
(5)①设含y个Fe2+,则有(0.92−y)个Fe3+,而正、负化合价代数和为零,得:2y+3×(0.92−y)
=2,解得y=0.76(个),此晶体中Fe2+与Fe3+的个数比为0.76:(0.92−0.76)=0.76:0.16=19:4;
②由NaCl晶体结构可推知,与Fe2+(或Fe3+)距离最近且等距离的有6个,这6个O2−所围成的几何形状为正八面体。
(6)一个晶胞中,含有4个KI,所以一个晶胞中,V球=4×43π(rK3+rI3)=163π(rK3+rI3),KI晶体的密度为ρg/cm3,K和I的摩尔质量分别为MK g/ml和M1g/ml,则ρ=4×(MK+MI)NAa3,则a3=4(MK+MI)ρNA×1030,所以KI晶胞中原子的体积占晶胞体积的百分率为V球a3×100%=163π(rK3+rI3)4×(MK+MI)ρNA×100%×10−30=4π×10−30NAρ(rK3+rI3)3(MK+MI)×100%,
故答案为:4π×10−30NAρ(rK3+rI3)3(MK+MI)×100%。 NaCl晶胞
CO2晶胞
金刚石晶胞
石墨晶体结构
实验
实验操作
实验现象
Ⅳ
往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热
闻到刺激性气味,溶液略显灰色,试管壁未见银镜
Ⅴ
往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热
试管壁立即出现银镜
化学能
键能
化学能
键能
C−C
331
C−O
343
Si−Si
197
Si−O
466
C=C
620
C=O
805
Si=Si
272
Si=O
640
高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识当堂检测题: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002451_t7/?tag_id=28" target="_blank">第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识当堂检测题</a>,共16页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 物质的聚集状态与晶体的常识巩固练习: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002451_t7/?tag_id=28" target="_blank">第一节 物质的聚集状态与晶体的常识巩固练习</a>,共6页。试卷主要包含了下列物质属于晶体的是,下列说法错误的是,下列有关晶胞的叙述错误的是,下列关于晶体的说法不正确的是等内容,欢迎下载使用。
人教版 (2019)选择性必修2第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识同步测试题: 这是一份人教版 (2019)选择性必修2<a href="/hx/tb_c4002451_t7/?tag_id=28" target="_blank">第三章 晶体结构与性质第一节 物质的聚集状态与晶体的常识同步测试题</a>,共16页。试卷主要包含了选择题,填空题,解答题等内容,欢迎下载使用。













