

2024安徽省皖北六校高一上学期期末联考试题化学含解析
展开考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:鲁科版必修第一册第1章~第3章第1节。
5.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 Cl-35.5 Ca-40
一、选择题(本题共15小题,每小题3分,共45分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1.氧化还原反应广泛存在于生产和生活中,下列现象与氧化还原无关的是
A.植物光合作用 B.食物腐败
C.易燃物的自燃 D.酸雨腐蚀大理石雕像
2.分类是学习和研究化学的重要方法,下列分类不合理的是
A.K2CO3属于钾盐、碳酸盐 B.NaOH属于可溶性强碱
C.液氯属于混合物 D.Na2O属于碱性氧化物
3.诗词是中华文化的瑰宝,下列诗句描述的现象与丁达尔效应有关的是
A.日照香炉生紫烟,遥看瀑布挂前川 B.千锤万凿出深山,烈火焚烧若等闲
C.春蚕到死丝方尽,蜡炬成灰泪始干 D.野火烧不尽,春风吹又生
4.下列物质能通过化合反应得到的是
①FeCl2 ②2Fe(OH)3 ③NaHCO3 ④FeCl3
A.全部 B.③④ C.①②③ D.②③④
5.根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的可能方法。下列物质间的转化通过一步反应不能实现的是
A.Ca(OH)2→NaOH B.CaCO3→Ca(OH)2
C.Cl2→HClO D.Na→NaOH
6.杭州亚运会上,中国跳水队延续了从未让亚运金牌旁落的强热表现.将跳水项目的10枚金牌全部收入囊中。下列物质不能用于水池消毒的是
A.臭氧(O3) B.次氯酸钠(NaClO)
C.二氧化氯(ClO2) D.明矾[KAl(SO4)2·12H2O]
7.下列离子方程式正确的是
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B碳酸钙与盐酸反应:+2H+=H2O+CO2↑
C.硫酸与氢氧化钡反应:H+++OH-+Ba2+=BaSO4↓+H2O
D.氯气与澄清石灰水反应:Cl2+2OH-=Cl-+ClO-+H2O
8.氧化还原反应是一类重要的化学反应,下列转化必须加入氧化剂才能实现的是
A.C→CO2 B.Cl2→Cl- C.→SO2 D.H2O→O2
9.下列各组中的离子,能在溶液中大量共存的是
A.Ca2+、、H+、 B.Ba2+、OH-、、
C.K+、、、Cl- D.Fe2+、Cl-、Na+、OH-
10.实验室中做化学实验或进行科学研究时,需要配制各种不同浓度的溶液。下列关于配制480mL1ml/LNaOH溶液的说法错误的是
A.应选用500mL的容量瓶
B.容量瓶使用之前需要检查是否漏水
C.称量好的NaOH固体直接转入容量瓶,再加水稀释
D.没有洗涤烧杯和玻璃棒会导致所配溶液浓度偏小
11.钠及其化合物在工业生产中有重要作用,如图是钠的“价—类”二维图,下列说法正确的是
A.Na在空气中燃烧生成Na2O
B.Na2O和Na2O2与H2O反应生成物完全相同
C.NaOH固体在空气中易变质,需密封保存
D.相同条件下,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,生成气体的体积不同
12.将绿矾(FeSO4·7H2O)溶于水配制成溶液喷施在叶面上,可解决植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是
A.“铁肥”易被空气氧化变质
B.可用KMnO4溶液检验“铁肥”是否发生变质
C.为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉
D.FeSO4·7H2O的摩尔质量为278g/ml
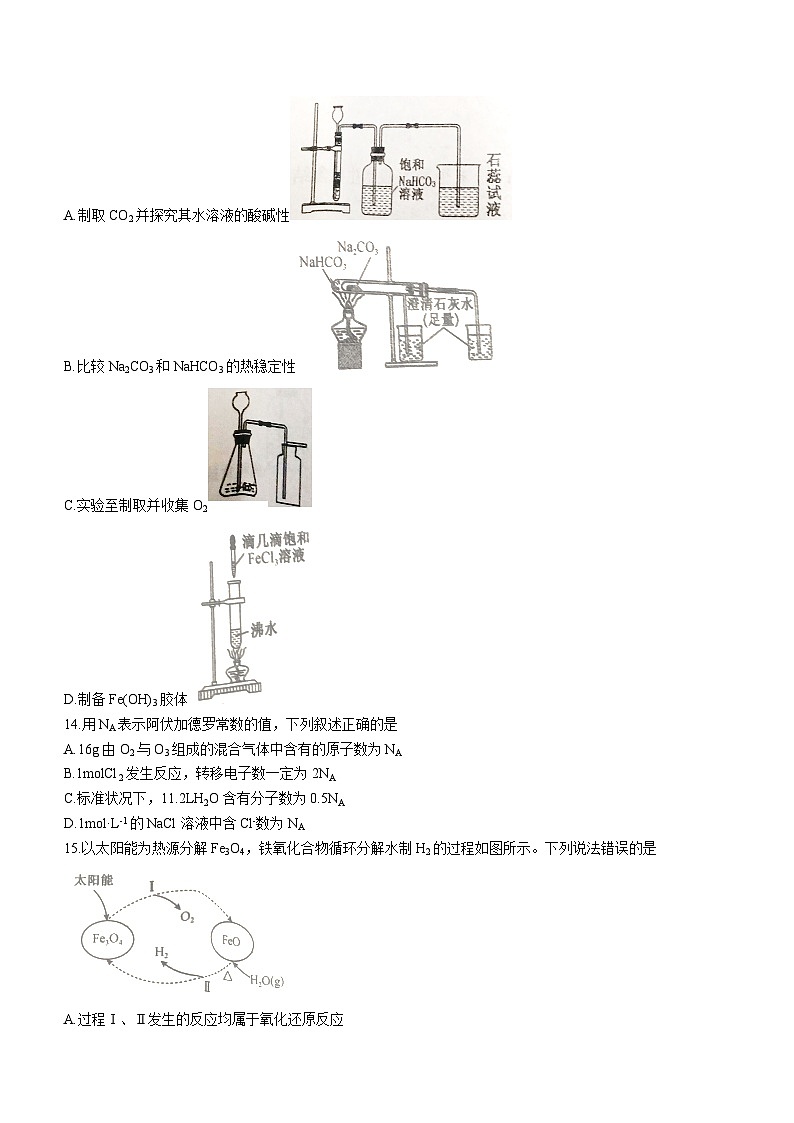
13.在实验中需要根据实验目的设计合适的实验装置。利用如图所示装置不能达到实验目的的是
A.制取CO2并探究其水溶液的酸碱性
B.比较Na2CO3和NaHCO3的热稳定性
C.实验至制取并收集O2
D.制备Fe(OH)3胶体
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.16g由O2与O3组成的混合气体中含有的原子数为NA
B.1mlCl2发生反应,转移电子数一定为2NA
C.标准状况下,11.2LH2O含有分子数为0.5NA
D.1ml·L-1的NaCl溶液中含Cl-数为NA
15.以太阳能为热源分解Fe3O4,铁氧化合物循环分解水制H2的过程如图所示。下列说法错误的是
A.过程Ⅰ、Ⅱ发生的反应均属于氧化还原反应
B.该制氢过程中,固体的颜色不会发生变化
C.过程Ⅰ中每消耗116gFe3O4理论上转移2ml电子
D.过程Ⅱ的化学方程式为3FeO+H2O(g)Fe3O4+H2
二、非选择题(本题共4小题,共55分)
16.(14分)氮化硅(Si3N4)陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得:
3SiO2+6C+2N2Si3N4+6CO
已知:Si3N4中N元素的化合价为-3。
回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是___________(填化学式)。碳元素存在多种单质,其中金刚石和石墨是应用最广泛的两种,它们互为_________。
(2)该反应的氧化剂是_________(填化学式,下同),被氧化的物质是_______,氧化产物与还原产物的质量之比为_______。
(3)用双线桥法标出上述反应中电子转移的方向和数目:______________。
(4)若生成标准状况下33.6LCO,则反应过程中转移_____电子。
17.(13分)如图为制取无水氯化铁粉末的装置,已知氯化铁粉末很容易吸水生成含结晶水的化合物。
回答下列问题:
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):_______。
(2)装置A中发生反应的离子方程式为_________。
(3)装置E的作用是__________。
(4)这套实验装置的缺陷是没有尾气处理装置,应增加一个装NaOH溶液的烧杯吸收尾气,尾气吸收过程中反应的化学方程式为_____________。
(5)利用制取的无水氯化铁固体配制少量FeCl3饱和溶液并制备Fe(OH)3胶体。
①溶解制取的无水氯化铁固体时,发现溶液偏浅绿色,取少量溶液于试管中,滴加几滴酸性高锰酸钾溶液,发现高锰酸钾颜色褪去,发生反应的离子方程式为_______;溶解所得溶液中含有Fe2+的原因可能是_____________。
②向沸水中滴加少量FeCl3饱和溶液,继续煮沸,至_________(填实验现象)时停止,得到Fe(OH)3胶体。
18.(14分)以饱和食盐水为原料可以制得多种化工产品,其中部分物质的制取如图所示,水已略去,已知B为黄绿色气体,C气体在标准状况下的密度为0.089g·L-1,A与B的反应可以用来生产漂白液,生成的E为漂白液的有效成分。
回答下列问题:
(1)气体C的化学式为_______;C在盛有B的集气瓶中燃烧时的现象为______。
(2)检验D中阴离子的方法为________。
(3)标准状况下,11.2LB与足量C反应生成F的质量为___g。
(4)实验室一般用F的浓溶液配制其稀溶液,若配制100mL0.5ml·L-1的稀溶液,需用量筒量取10ml·L-1的浓溶液______mL。下列操作可能导致所配溶液浓度偏高的是_______(填字母)。
A.量取F的浓溶液时仰视读数 B.转移前容量瓶中有水
C.转移时液体溅出 D.定容时俯视读数
(5) A中金属元素的某种氧化物可以与CO2反应制取O2,写出该反应的化学方程式:______________。
19.侯德榜为我国化工事业的发展做出了卓越贡献,是我国近代化学工业的奠基人之一,他结合中国国情对氨碱法进行改进,确定了新的工艺流程——侯氏制碱法:将氨碱法和合成氨法两种工艺联合起来,方法流程如图所示。
回答下列问题:
(1)向精制盐水中通入NH3、CO2的顺序及理由为______(提示:从两种气体的溶解度进行分析)。
(2)写出NaHCO3煅烧时发生反应的化学方程式:___________。
(3)该流程中循环利用的物质为________(填化学式)。
(4)侯氏制碱法除了制取得到纯碱,还生成了一种副产品_____(填名称),可以用来_______。
(5)所得纯碱中可能含有少量NaCl杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
ⅰ.称取ag样品,溶于水中;
ⅱ.加入足量氯化钙溶液;
ⅲ.过滤、洗涤、干燥、称量,所得沉淀质量为bg。
①证明步骤中Na2CO3已经沉淀完全的方法是_______。
②该样品中碳酸钠的质量分数为______%(用含a,b的代数式表示)。
2023~2024学年度第一学期高一年级期末联考·化学
参考答案、提示及评分细则
1.D
光合作用、食物腐败、易燃物的自燃均与氧化还原反应有关,A、B、C项均不符合题意;大理石的主要成分为CaCO3,与酸雨发生的反应为复分解反应,与氧化还原反应无关,D项符合题意。
2.C
K2CO3既属于钾盐又属于碳酸盐,A项不符合题意;NaOH属于可溶性强碱,B项不符合题意;液氯是Cl2处于液态,属于单质,是纯净物,C项符合题意;Na2O属于碱性氧化物,D项不符合题意。
3.A
在阳光的照射下﹐香炉峰生起紫色的烟霞,此现象的产生与丁达尔效应有关,A项符合题意;“千锤万凿出深山,烈火焚烧若等闲”描述的为CaCO3煅烧生成CaO,与丁达尔效应无关,B项不符合题意;C、D描述的均是燃烧及生命活动,与丁达尔效应无关,C、D项均不符合题意。
4.A
Fe粉与FeCl3在溶液中发生化合反应可以制取FeCl2,Fe(OH)2暴露在空气中与H2O和O2发生化合反应可以制取Fe(OH)3,Na2CO3与CO2、H2O发生化合反应可以制取NaHCO3,铁在氯气中燃烧可以直接生成FeCl3,所有物质均可以通过化合反应得到,A项符合题意。
5.B
Ca(OH)2与Na2CO3反应生成CaCO3与NaOH,A项不符合题意;CaCO3通过一步反应无法转化为Ca(OH)2,B项符合题意;Cl2与H2O反应可以生成HCl和HClO,C项不符合题意;Na与H2O可以反应生成NaOH和H2,D项不符合题意。
6.D
臭氧(O3)、次氯酸钠(NaClO),二氧化氯(ClO2)均具有漂白性,可用于水池消毒,A、B、C项均不符合题意;明矾[KA(SO4)2·12H2O]在水的净化中起吸附作用而不能消毒,D项符合题意。
7.D
铁与盐酸反应生成氯化亚铁,A项错误;碳酸钙是沉淀,不能拆分,B项错误;硫酸与氢氧化钡反应正确的离子方程式为2H+++2OH-+Ba2+=BaSO4↓+2H2O,C项错误;氯气与氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,D项正确。
8.A
C元素化合价升高,必须加入氧化剂才能实现,A项符合题意;Cl元素化合价降低,需要加入还原剂或者自身与碱、水等反应,B项不符合题意;S、O元素化合价都无变化,C项不符合题意;O元素化合价升高,但可以通过电解生成,反应中H2O自身既作为氧化剂又作为还原剂,不一定需要加入氧化剂,D项不符合题意。
9.C
与Ca2+、H+均不共存,A项不符合题意;Ba2+与、均不共存,B项不符合题意;离子均能大量共存,C项符合题意;Fe2+与OH-不能大量共存,D项不符合题意。
10.C
配制480mL溶液时,应选用500mL容量瓶,A项正确;容量瓶使用之前需要检查是否漏水,B项正确;称量好的NaOH应在烧杯中溶解并冷却至室温,再转入容量瓶中,C项错误;没有洗涤烧杯和玻璃棒会导致转入容量瓶中的溶质的物质的量偏小,所配溶液实际浓度偏小,D项正确。
11.C
Na在空气中燃烧生成Na2O2,A项错误;Na2O与H2O反应生成NaOH,Na2O2与H2O反应生成NaOH和O2,B项错误;NaOH易潮解并与空气中的CO2反应,需要密封保存,C项正确;相同条件下,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,生成CO2的体积相同,D项错误。
12.B
Fe2+易被氧化,A项正确;应用KSCN检验“铁肥”是否发生变质,KMnO4只可以证明其已经完全变质,B项错误;加入少量铁粉可以防止“铁肥”被氧化,C项正确;摩尔质量在数值上等于相对分子质量,FeSO4·7H2O的摩尔质量为278g·ml-1,D项正确。
13.B
实验中会观察到与外管相连的澄清石灰水变浑浊,但因为外管温度更高,所以无法得出热稳定性:Na2CO3>NaHCO3,B项符合题意;A、C、D中装置均能达到实验目的,A、C、D项不符合题意。
14.A
O2和O3的混合物可看作氧原子的集合体,n(O)==1ml,即原子数目为NA,A项正确;若与水或碱反应,lmlCl发生反应,转移电子数为1ml,B项错误;标准状况下,H2O为液体,不能用Vm=22.4L·ml-1进行计算,C项错误;缺少体积,无法计算出Cl-数,D项错误。
15.C
过程Ⅰ、Ⅱ发生的反应均有单质生成,元素化合价一定发生了变化,发生了氧化还原反应,A项正确;FeO和Fe3O4均为黑色固体,固体的颜色不会发生变化,B项正确;116gFe3O4的物质的量为0.5ml,生成FeO时,理论上转移1ml电子,C项错误;根据流程中给出的信息,判断反应物和生成物,过程Ⅱ的化学方程式为3FeO+H2O(g)Fe3O4+H2,D项正确。
16.(1)CO,SiO2;同素异形体
(2)N2;C;6∶5
(3)
(4)3ml(或3NA,合理均可给分)(每空2分)
17.(1)agfdeb(c)(2分)
(2)MnO2+4H++2Cl-Mn2++Cl2+2H2O(2分)
(3)除去Cl2中混有的HCl杂质(2分)
(4)Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(5)①+8H++5Fe2+=5Fe3++Mn2++4H2O;制备FeCl3时,Fe有剩余,溶解时,Fe与FeCl3反应生成FeCl2(各2分)
②液体呈红褐色(1分)
18.(1)H2;安静的燃烧,产生苍白色火焰,集气瓶口有白雾生成
(2)取少量溶液于试管中,加入硝酸酸化,再加入硝酸银溶液,若产生白色沉淀,则为Cl-(合理即可给分)
(3)36.5
(4)5.0;AD
(5)2Na2O2+2CO2=2Na2CO3+O2(每空⒉分)
19.(1)先通入NH3,后通入CO2,CO2的溶解度小,先通入NH3有利于吸收更多的CO2,生成高浓度
(2)2NaHCO3Na2CO3+H2O+CO2↑
(3)CO2,NaCl
(4)氯化铵;作化肥(合理即可)
(5)①取少量步骤ⅱ上层清液于试管中,加入氯化钙溶液,若不产生沉淀,则已沉淀完全(合理即可)
安徽省皖北六校2023-2024学年高一上学期期末联考化学试题(Word版附解析): 这是一份安徽省皖北六校2023-2024学年高一上学期期末联考化学试题(Word版附解析),共9页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量,下列离子方程式正确的是等内容,欢迎下载使用。
安徽省皖北六校2023-2024学年高一上学期期末联考化学试题(含答案): 这是一份安徽省皖北六校2023-2024学年高一上学期期末联考化学试题(含答案),共11页。试卷主要包含了本试卷分选择题和非选择题两部分,答题前,考生务必用直径0,本卷命题范围,可能用到的相对原子质量,下列离子方程式正确的是等内容,欢迎下载使用。
2024酒泉四校高一上学期期中联考化学试题含解析: 这是一份2024酒泉四校高一上学期期中联考化学试题含解析,文件包含甘肃省酒泉市四校2023-2024学年高一上学期期中联考化学试题原卷版docx、甘肃省酒泉市四校2023-2024学年高一上学期期中联考化学试题含解析docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。











