

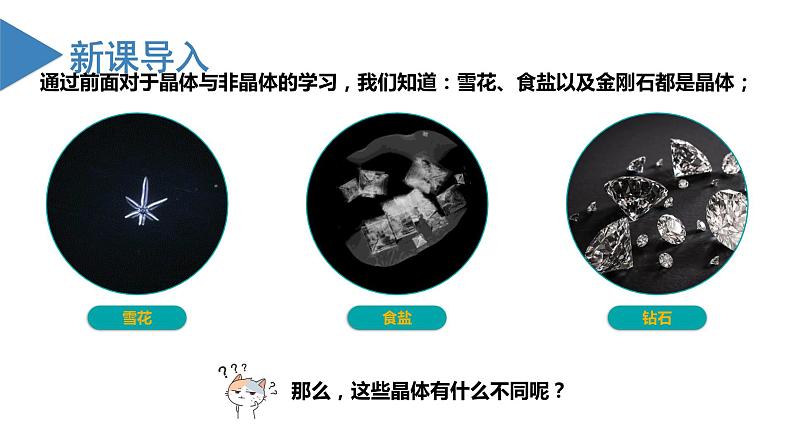
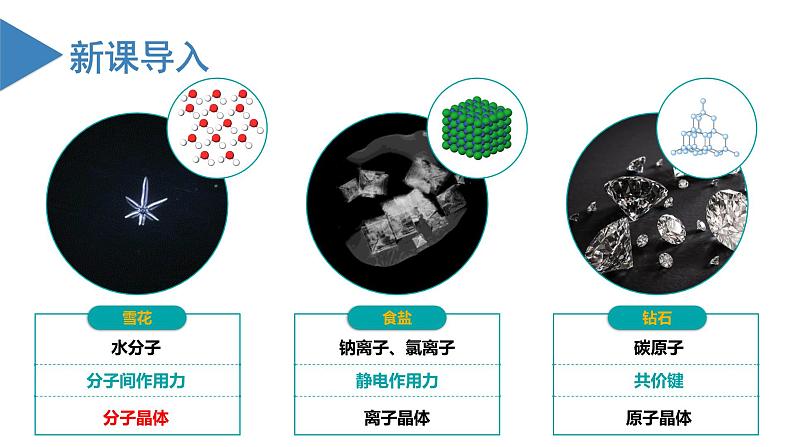


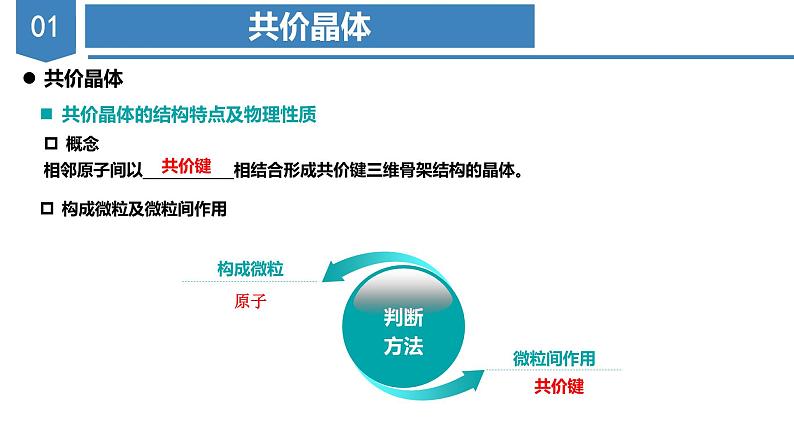











沪科技版(2020)选择性必修2共价晶体评优课课件ppt
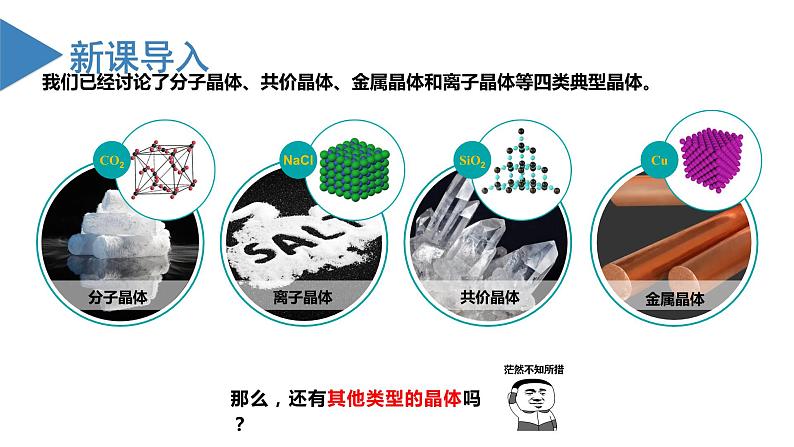
展开我们已经讨论了分子晶体、共价晶体、金属晶体和离子晶体等四类典型晶体。
混合型晶体和过渡型晶体
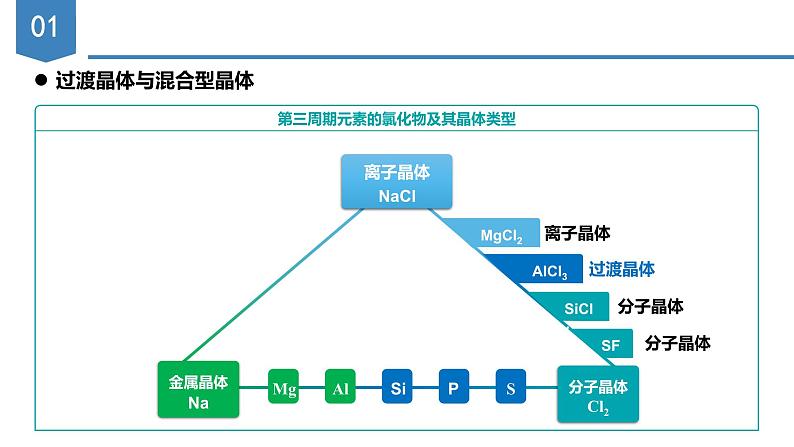
第三周期元素的氯化物及其晶体类型
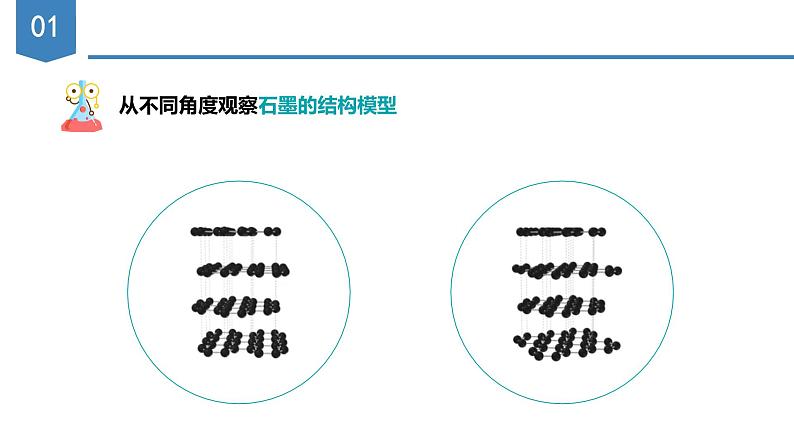
从不同角度观察石墨的结构模型
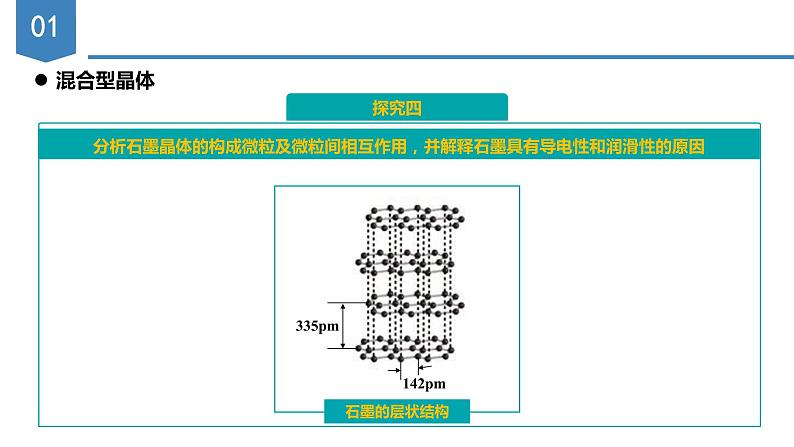
实验测得:石墨晶体是层状结构的,层内的碳原子的核间距为142 pm,层间距离为335 pm。
分析石墨晶体的构成微粒及微粒间相互作用,并解释石墨具有导电性和润滑性的原因
石墨的导电性:因为石墨晶体的层间距离为335pm,远大于正常化学键的键长。说明层与层之间没有化学键相连,是靠范德华力维系的。由于相邻碳原子平面之间相隔较远,电子不可能从一个平面跳跃到另一个平面,故石墨的导电性只能沿着石墨平面的方向
石墨的润滑性:因为分子间作用力较弱,层与层之间易于断开而滑动,所以石墨具有润滑性
在石墨晶体中既有共价键又带有金属键性质,而层间结合则依靠分子间作用力。所以这是一种十分典型的混合键型单质晶体。
石墨晶体中,既有 ,又有 和 ,属于 。
①同层内,碳原子采用 杂化,以 相结合形成 结构。所有碳原子的p轨道平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。②层与层之间以 相结合。
观察下图所示的熔点变化并根据所学内容解释:熔点变化的原因。
从NaX的构成来看,其构成为活泼金属与较活泼的非金属构成,属于典型的离子晶体。
而离子键的强弱,与离子所带电荷成正比,与离子半径成反比,从F-离子到I-,离子半径增大,离子键强度减弱,故晶体熔点逐渐降低。
分子晶体熔化时需克服分子间作用力或氢键,熔点较低;共价晶体需克服共价键,熔点较高;由图可知:SiX4为分子晶体。
硅的卤化物属于分子晶体,熔化时,克服分子间作用力,而硅的卤化物组成与结构相似,故相对分子质量越大,分子间作用力越强,所以熔点逐渐升高。
根据所学和实验图像推测:TiF4是离子化合物,熔点较高TiCl4 、 TiBr4、TiI4是共价化合物
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共价键成分。
电负性差值越大,离子键成分的百分数越高
根据表中数据,归纳影响离子键的因素
钛的卤化物(TiX4)
从表格中可知:上述晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体
离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
问题1:冶炼铝通常采用电解熔融Al2O3(熔点:2 054℃)的方法,为什么不电解熔融态AlCl3(熔点:192.6℃)?
资料1 氯化铝晶体的导电性随温度变化图
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6的形式存在
从资料1可知,当温度达到熔点时,AlCl3为液体,电导率几乎变到零,这说明体系中不存在自由移动的离子。结合资料2,AlCl3分子的结构,可知不能用电解熔融态氯化铝来冶炼铝
问题2:判断AlCl3的晶体类型
结合资料2,AlCl3分子的结构,熔融态氯化铝为共价化合物,所以其为分子晶体;
结合资料1:AlCl3晶体的导电性随温度变化图,在接近熔点时导电性提高,说明体系中存在一定数量的离子,这些离子可以在一定范围内运动,推测固态氯化铝晶体是离子晶体;
综合以上两点:AlCl3中的化学键既有一定的离子性,又有一定的共价性,即AlCl3是介于离子晶体和分子晶体之间的过渡晶体。
纯粹的典型晶体是没有的( )
离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子键成分的百分数越小( )
在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅限于晶体微观空间的一个个分子中( )
四类晶体都有过渡型( )
石墨的二维结构内,每个碳原子的配位数为3( )
石墨的导电只能沿石墨平面的方向进行( )
石墨晶体层与层之间距离较大,所以石墨的熔点不高( )
请同学们回顾所学内容,判断下列问题的对与错
晶体 X 射线衍射分析
常用仪器:_____________。
测定过程:当单一波长的X射线通过晶体时,X射线和晶体中的_____________相互作用,会在记录仪上产生 或者 。
根据晶体的X射线衍射谱图,可以计算原子间的距离,判断哪些原子直接存在化学键,确定键长和键角,从而得出分子的空间结构。还可以获得晶胞的形状和大小,原子的排列方式、原子的数目和位置。
1.在解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是( )A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点C.KF、KCl、KBr、KI的熔点依次降低D.F2、Cl2、Br2、I2的熔点和沸点逐渐升高
2.下列氧化物中所含离子键成分的百分数最小的是( )A.N2O3 D.Bi2O3
3.石墨晶体是层状结构,在每一层内,每一个碳原子都与其他三个碳原子相结合。如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )A.10 B.18 C.24 D.14
4.石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。(1)熔点:石墨_____(填“>”“<”或“=”)金刚石。(2)石墨中C—C的键长小于金刚石中C—C键长的原因:__________________________________________________________________________________________________________________。
金刚石中只存在C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优秀课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优秀课件ppt,文件包含人教版化学选修二322《分子晶体与共价晶体》第二课时课件pptx、322分子晶体与共价晶体第二课时教案docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体精品课件ppt,文件包含人教版化学选修二321《分子晶体与共价晶体》第一课时课件pptx、321分子晶体与共价晶体教案docx等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子晶体与共价晶体获奖ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子晶体与共价晶体获奖ppt课件,文件包含322分子晶体与共价晶体第2课时共价晶体课件精讲高二化学同步课件精讲人教版2019选择性必修2pptxpptx、322分子晶体与共价晶体第2课时共价晶体高二化学同步课件精讲及习题精练人教版2019选择性必修2含解析卷docx等2份课件配套教学资源,其中PPT共31页, 欢迎下载使用。













