

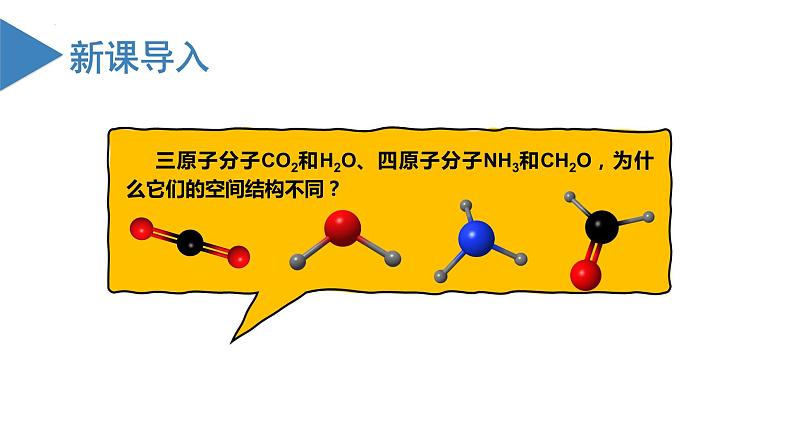










高中化学沪科技版(2020)选择性必修2共价键的形成与性质教学演示课件ppt
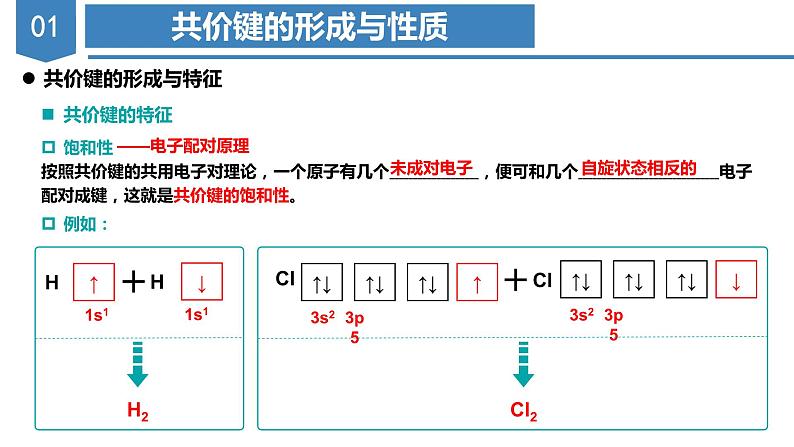
展开饱和性按照共价键的共用电子对理论,一个原子有几个 ,便可和几个 电子配对成键,这就是共价键的饱和性。
【例1】NH3分子中N原子为什么是1个,而H原子为3个?
形成氢分子的共价键(H-H)
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的 ,电子在核间出现的 越大,所形成的共价键就越 ,因此共价键将尽可能沿着__________________的方向形成,所以共价键具有方向性。
现代价键理论的基本要点
两个原子轨道重叠越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
两个原子各自提供1个自旋方向相反的电子彼此配对。
除了s轨道和s轨道重叠形成共价键外,还能找到其他轨道重叠形成共价键的例子吗?
共价键类型(按成键原子的原子轨道的重叠方式分类)
H—Cl的s-p σ键的形成
HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道重叠形成
未成对电子的原子轨道相互靠拢
Cl—Cl的p-p σ键的形成
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的
s-s σ键,如:H-H
s-p σ键,如:H-Cl
p-p σ键,如:Cl-Cl
p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道“肩并肩”重叠形成。
π键的电子云具有____________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为_____;π键______旋转;不如σ键____________,较易____________。
【例1】观看氮气中氮氮三键形成的过程,思考:如何判断共价键是σ键或是π键?
共价单键为____键;
共价双键中有一个____键、一个____键;
共价三键由一个_____键和两个______键组成。
判断σ键、π键的一般规律
一方显正电性,一方显负电性
由不同原子形成的共价键
由同种原子形成的共价键
气态分子中________化学键解离成气态原子所__________的能量。
键能越大,共价键越牢固,由此形成的分子越稳定。
请同学们观察下表,并找出键能数据中存在的规律?(从成键个数,成键原子的半径分析)
规律2:成键原子相同,
形成共价键的原子的原子半径越大,键能越小
单键的键能<双键的键能<三键的键能
根据价键理论分析氮气分子中的成键情况,并解释N2通常很稳定的原因。
两个氮原子各自用三个p轨道分别形成一个σ键和两个π键。N2分子中存在N≡N,键能大,破坏它需要消耗较高的能量,因而N2通常很稳定。
N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化学事实。
从表中数据可知,N—H、O—H与H—F的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定。所以N2、O2、F2与H2的反应能力依次增强。
请同学们思考并回答以下问题:
原子间形成共价键时,原子轨道重叠程度 ,释放能量 ,所形成的共价键键能越大,共价键越 。
ΔH= 总键能- 总键能
一般来说,结构相似的分子,共价键的键能越大,分子越 。
【例1】某些化学键的键能(kJ·ml-1)如下表所示。
(1)1 ml H2在2 ml Cl2中燃烧,放出热量______ kJ。
(2)在一定条件下,1 ml H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是____(填字母)。a.Cl2>Br2>I2 b.I2>Br2>Cl2c.Br2>I2>Cl2预测1 ml H2在足量F2中燃烧比在Cl2中燃烧放热____(填“多”或“少”)。
构成化学键的两个原子的_______,因此________决定共价键的键长,__________ 越小,共价键的键长越短。
pm(1 pm=10-12 m)
同种类型的共价键,成键原子的原子半径越小,键长越小。
成键原子相同的共价键的键长:单键键长 > 双键键长 > 三键键长
一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
F原子半径很小,因此F-F的键长短,而由于键长短,两个F原子形成共价键时,原子核之间的距离小,排斥力大,因此键能小。
【例1】观察下图乙烷、乙烯和乙炔分子的结构,并回答下列问题。
(1)乙烷中有__个σ键,乙烯、乙炔中σ键与π键的个数之比分别为____、____。(2)乙烯和乙炔的化学性质为什么比乙烷活泼?
乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定,不易断裂。
在多原子分子中, 之间的夹角。
描述分子空间结构的重要参数
波长为 300 nm 的紫外光的光子所具有的能量约为 399 kJ •ml-1,这一能量比蛋白质分子中重要的化学键C一C键、C-N 键和C—S 键的键能都大。因此,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子。防晒霜之所以能有效地减轻紫外光对人体的伤害,其原因之一是它的有效成分的分子中含有π键。这些分子中的π键的电子在吸收紫外光后被激发,从而能阻挡部分紫外光。
在外界条件影响下,原子内部能量相近的原子轨道重新组合形成新的原子轨道的过程叫做原子轨道的杂化。重新组合后的新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
原子在成键时,同一原子中能量相近的原子轨道可重新组合成杂化轨道。
形成的杂化轨道数与参与杂化的原子轨道数相等且杂化轨道的能量相同。
(变:轨道的成分、能量、形状、方向,使原子的成键能力增加)
杂化轨道在角度分布上比单纯的s或p轨道在某一方向上更集中,成键时根据最大重叠原理,重叠程度越大,形成的共价键越牢固。
杂化改变原有轨道的形状和伸展方向,使原子形成的共价键更牢固。
杂化轨道为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向不同但形状完全相同。
回顾所学内容,判断下列语句正误
杂化轨道类型与分子空间结构的关系
sp3杂化轨道是由 ns轨道和 np轨道杂化而成,每个sp3杂化轨道都含有 和 的成分,sp3杂化轨道间的夹角为 ,空间结构为正四面体形。如右图所示。
sp2杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp2杂化轨道含有 和 成分,sp2杂化轨道间的夹角都是120°,呈平面三角形,如下图所示。
sp杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp杂化轨道含有 和 的成分,sp杂化轨道间的夹角为180°,呈直线形,如下图所示。
情况一:当杂化轨道全部用于形成σ键时,分子或离子的空间结构与杂化轨道的空间结构相同
情况二:当杂化轨道中有未参与成键的孤电子对时,孤电子对对成键电子对的排斥作用,会使分子或离子的空间结构与杂化轨道的形状有所不同
方法一:根据杂化轨道数目判断
判断中心原子杂化轨道类型的三种方法
杂化轨道只能用于形成σ键或者用来容纳未参与成键的孤电子对,而两个原子之间只能形成一个σ键。
根据杂化轨道的空间分布判断
根据杂化轨道之间的夹角判断
【例1】回顾所学内容,认真填写下表:
2 2 sp
3 3 sp2
4 4 sp3
共价分子空间结构的预测
孤电子对:未用于形成共价键的电子对
问题2:请同学们观察上述分子的电子式,再对照其球棍模型,运用分类、对比的方法,分析结构不同的原因。
结论:由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。
分子的空间结构除了和中心原子与结合原子间的成键电子对有关,还和中心原子的孤电子对有关,两者合称为中心原子的“价层电子对”。
价层电子对互斥模型(VSEPR mdel)
中心原子A的价层电子对(包括成键的 和未成键的 )之间由于存在排斥力,将使分子的空间结构总是采取电子对____________最弱的那种结构,以使彼此之间 最小,分子或离子的体系能量最低,最稳定。
σ键电子对数的计算由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对。
例如:H2O分子中, O有 对σ键电子对。NH3分子中, N有 对σ键电子对。
b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子= 。
x表示与 结合的原子数。
中心原子价层电子对数=σ键电子对数+孤电子对数
a表示中心原子的价电子数;对主族元素:a= ;对于阳离子:a= ;对于阴离子:a= 。
价电子数-离子所带电荷数
价电子数+离子所带电荷数
(6-3×2)÷2=0
(4-4×1)÷2=0
【例1】计算中心原子上的孤电子对数
(4-2×2)÷2=0
(6-2×2)÷2=1
价层电子对的空间结构(即VSEPR模型)
【例1】用价层电子对互斥模型完成下列问题(点“·”的原子为中心原子)。
2 2 V形
3 0 平面三角形
3 1 三角锥形
2 1 V形
4 0 正四面体形
2 2 V形
2 2 V形
VSEPR模型的应用——预测分子空间结构
由价层电子对的相互排斥,得到含有孤电子对的VSEPR模型,然后,略去VSEPR模型中的中心原子上的 ,便可得到分子的空间结构。
由于孤电子对有较大斥力,含孤电子对的分子的实测键角几乎都小于VSEPR模型的预测值。
价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子。
价层电子对之间相互排斥作用大小的一般规律:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。随着孤电子对数目的增多,成键电子对与成键电子对之间的斥力减小,键角也减小。
预测分子的空间结构的步骤
【例1】实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
CH4分子中的C原子没有孤电子对,NH3分子中N原子上有1对孤电子对,H2O分子中O原子上有2对孤电子对,对成键电子对的排斥作用增大,故键角减小。
两个原子各取出一个电子配成对,通过共用电子对来形成物质;8电子稳定构型——八隅律;“共用电子对”——共价键,即路易斯共价键理论;分子中还存在未用干形成共价键的非键合电子,又称孤对电子添加了孤对电子的结构式叫路易斯结构式。
1.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )A.仅有一个σ键B.仅有一个π键C.一个σ键,一个π键D.一个σ键,两个π键
2.分析下列化学式中画有横线的元素,选出符合要求的物质,填空。A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2(1)所有的价电子都参与形成共价键的是_______。(2)只有一个价电子参与形成共价键的是___。(3)最外层有未参与成键的电子对的是_____________。(4)既有σ键又有π键的是___。
3.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2,⑧H2O2,⑨HCN(H—C≡N)。(1)只有σ键的是_____________(填序号,下同);既有σ键又有π键的是_______。
(2)含有由两个原子的s轨道重叠形成的σ键的是______。
(3)含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是__________。
(4)含有由一个子的p轨道与另一个原子的p轨道重叠形成的σ键的是____________。
4. 下列各说法中正确的是( )A.分子中键能越高,键长越长,则分子越稳定B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键C.水分子可表示为H—O—H,分子中键角为180°D.H—O的键能为463 kJ·ml-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
5.键长、键角和键能是描述共价键的三个重要参数,下列叙述正确的是( )A.键角是描述分子空间结构的重要参数B.因为H—O的键能小于H—F的键能,所以O2、F2与H2反应的能力逐渐减弱C.H—F的键长是H—X中最长的D.碳碳三键和碳碳双键的键能分别是单键键能的3倍和2倍
6.已知H—H的键能为436 kJ·ml-1,O==O的键能为497.3 kJ·ml-1,Cl—Cl的键能为242.7 kJ·ml-1,N≡N的键能为946 kJ·ml-1,则下列叙述中正确的是( )A.N—N的键能为 ×946 kJ·ml-1=315.3 kJ·ml-1B.氮气分子中的共价键的键长比氢气分子中的短C.氧气分子中氧原子是以共价单键结合的D.氮气分子比氯气分子稳定
7.能说明BF3分子中四个原子在同一平面的理由是( )A.任意两个键的夹角为120°B.B—F是非极性共价键C.三个B—F的键能相同D.三个B—F的键长相等
8.已知某些共价键的键能、键长数据如表所示:
(1)下列推断正确的是______(填字母,下同)。A.热稳定性:HF>HCl>HBr>HIB.氧化性:I2>Br2>Cl2C.沸点:H2O>NH3D.还原性:HI>HBr>HCl>HF
(2)在HX(X=F、Cl、Br、I)分子中,键长最短的是____,最长的是___;O—O的键长_____ (填“大于”“小于”或“等于”)O==O的键长。
9.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与SO2 B.CH4与NH3C.BeCl2与BF3 D.C2H2与C2H4
10.下列分子的空间结构可用sp2杂化轨道来解释的是( )①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4A.①②③ B.①⑤⑥C.②③④ D.③⑤⑥
11.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )A.CH≡CH D.BF3
12.下列有关甲醛(HCHO)分子的说法正确的是( )①C原子采取sp杂化 ②甲醛分子为三角锥形结构③C原子采取sp2杂化 ④甲醛分子为平面三角形结构A.①② B.②③ C.③④ D.①④
13.已知某XY2分子属于V形分子,下列说法正确的是( )A.X原子一定是sp2杂化B.X原子一定为sp3杂化C.X原子上一定存在孤电子对D.VSEPR模型一定是平面三角形
14.在BrCH==CHBr分子中,C—Br采用的成键轨道是( )A.sp-p B.sp2-sC.sp2-p D.sp3-p
15.乙烯分子中含有4个C—H和1个C==C,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是( )①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道A.①③ B.②④C.①④ D.②③
16.回答下列问题(1)图(a)为S8的结构,其硫原子的杂化轨道类型为______。
(2)气态三氧化硫以单分子形式存在,其分子的空间结构为___________;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为_____。(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为______,中心原子的杂化方式为_____。
(4)As4O6的分子结构如图所示,其中As原子的杂化方式为______。(5)AlH4-中,Al原子的轨道杂化方式为______。
17.下列物质中,分子的空间结构与氨分子相似的是( )A.CO2 B.H2S C.PCl3 D.SiCl4
18.下列微粒中,中心原子含有孤电子对的是( )A.SiH4 D. NH4+
19.若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,判断下列说法中正确的是( )A.若n=2,则分子的空间结构为V形B.若n=3,则分子的空间结构为三角锥形C.若n=4,则分子的空间结构为正四面体形D.以上说法都不正确
20.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其球棍模型如图所示: , 。下列说法错误的是( )A.X的组成为CH3+ B.Y的组成为CH3-C.X的价层电子对数为4 D.Y中键角小于120°
21.美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
22.(1)利用VSEPR模型推断分子或离子的空间结构。 ________;CS2_______;AlBr3(共价分子)____________。(2)按要求写出第二周期非金属元素构成的中性分子的化学式。平面三角形分子_____,三角锥形分子_____,四面体形分子_____。
BF3 NF3 CF4
(3)为了解释和预测分子的空间结构,科学家在归纳了许多已知的分子空间结构的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是___________________________________;另一类是____________________。BF3和NF3都是四个原子的分子,BF3的中心原子是____,NF3的中心原子是_____;BF3分子的空间结构是平面三角形而NF3分子的空间结构是三角锥形的原因________________________________________________________________________________________________________________。
中心原子上的价电子都用于形成共价键
BF3分子中B原子的3个价电子都与F原子形成共价键,而NF3分子
中N原子的3个价电子与F原子形成共价键,还有一对未成键的电子对,占据了N原子周围的空间,参与相互排斥,形成三角锥形
沪科技版(2020)选择性必修2共价晶体评优课课件ppt: 这是一份沪科技版(2020)选择性必修2<a href="/hx/tb_c4036507_t3/?tag_id=26" target="_blank">共价晶体评优课课件ppt</a>,文件包含331共价晶体和分子晶体1pptx、332共价晶体和分子晶体2pptx、33共价晶体和分子晶体分层作业原卷版docx、33共价晶体和分子晶体分层作业解析版docx等4份课件配套教学资源,其中PPT共94页, 欢迎下载使用。
沪科技版(2020)2.3配位化合物和超分子获奖课件ppt: 这是一份沪科技版(2020)<a href="/hx/tb_c4036492_t3/?tag_id=26" target="_blank">2.3配位化合物和超分子获奖课件ppt</a>,文件包含23配位化合物和超分子教学课件pptx、23配位化合物和超分子分层作业原卷版docx、23配位化合物和超分子分层作业解析版docx等3份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
高中化学沪科技版(2020)选择性必修22.2分子结构与物质的性质精品课件ppt: 这是一份高中化学沪科技版(2020)选择性必修2<a href="/hx/tb_c4036487_t3/?tag_id=26" target="_blank">2.2分子结构与物质的性质精品课件ppt</a>,文件包含22分子结构与物质的性质教学课件pptx、22分子结构与物质的性质分层作业原卷版docx、22分子结构与物质的性质分层作业解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。













