










所属成套资源:2024年高考化学大二轮复习课件+讲义(含教师版及学生版)
专题二 选择题专攻 5.无机化工微流程分析 2024年高考化学二轮复习课件+讲义
展开
这是一份专题二 选择题专攻 5.无机化工微流程分析 2024年高考化学二轮复习课件+讲义,文件包含专题二选择题专攻5无机化工微流程分析pptx、专题二选择题专攻5无机化工微流程分析教师版docx、专题二选择题专攻5无机化工微流程分析docx等3份课件配套教学资源,其中PPT共44页, 欢迎下载使用。
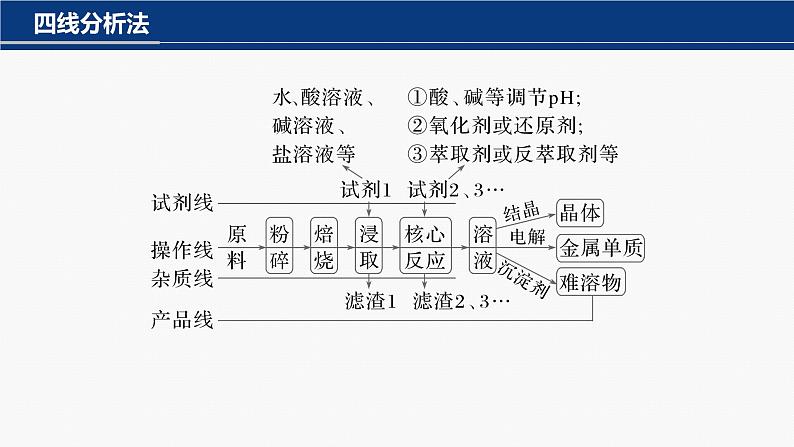
(1)试剂线:分清各步加入试剂的作用,一般是为了除去杂质或进行目标元素及其化合物间的转化等。(2)操作线:分离杂质和产品需要进行的分离、提纯操作等。(3)杂质线:分清各步去除杂质的种类,杂质的去除顺序、方法及条件等。(4)产品线:工艺流程主线,关注目标元素及其化合物在各步发生的反应或进行分离、提纯的操作方法,实质是目标元素及其化合物的转化。
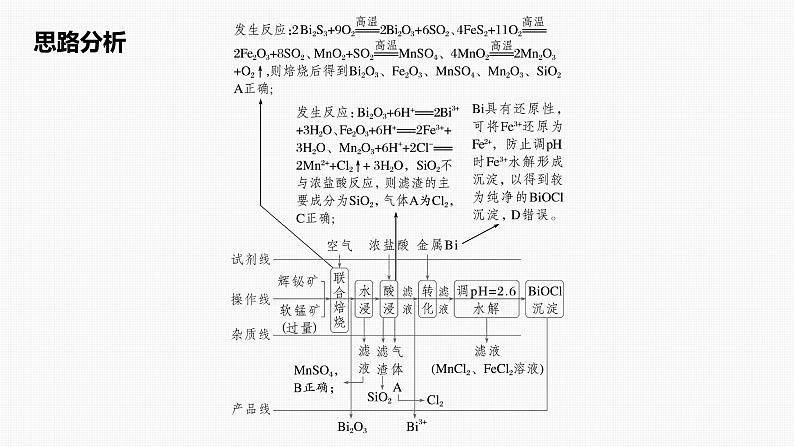
典例剖析(2023·河北邢台检测)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl,工艺流程如图所示。焙烧时过量的MnO2分解为Mn2O3,金属活动性:Fe>(H)>Bi>Cu。下列说法错误的是A.通过“联合焙烧”Bi2S3和FeS2分 别转化为Bi2O3、Fe2O3B.“水浸”所得滤液的主要溶质是MnSO4C.“酸浸”所得滤渣的主要成分是SiO2,气体A为Cl2D.向“酸浸”所得滤液中加入金属Bi的目的是消耗H+,促进Bi3+水解
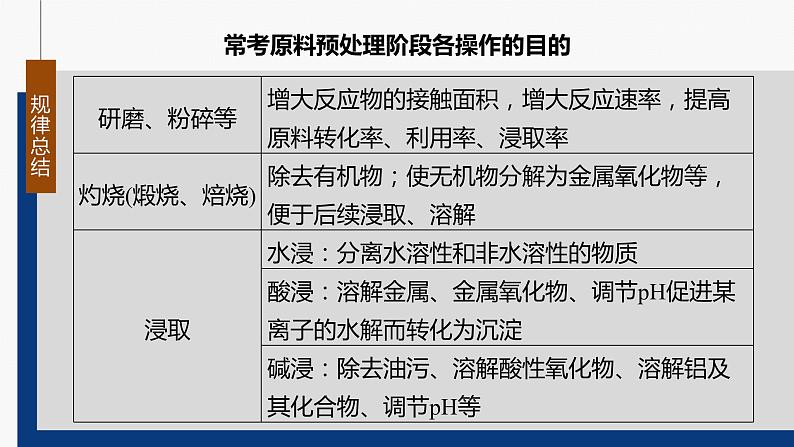
常考原料预处理阶段各操作的目的
1.(2023·湖南,9)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如图:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
下列说法错误的是A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3B.Na2S溶液呈碱性,其主要原因是S2-+H2O HS-+OH-C.“沉淀池Ⅱ”中,当Cu2+和Zn2+完全沉淀时,溶液中 =4.0× 10-12D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
当pH=1.9时氢氧化铁开始沉淀,当pH=3.5时氢氧化铝开始沉淀,当pH=4时,则会生成氢氧化铝和氢氧化铁,即“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3,A正确;硫化钠溶液中的硫离子可以水解,产生氢氧根离子,使溶液显碱性,其第一步水解的方程式为S2-+H2O HS-+OH-,B正确;
“出水”中除含有阴离子外,还含有大量的Na+、Ca2+等,故只经阴离子交换树脂软化处理后,不可用作工业冷却循环用水,D错误。
2.(2023·辽宁,10)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是
A.“焙烧”中产生CO2B.滤渣的主要成分为Fe(OH)2C.滤液①中Cr元素的主要存在形式为D.淀粉水解液中的葡萄糖起还原作用
3.(2022·山东,12)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
下列说法错误的是A.固体X主要成分是Fe(OH)3和S; 金属M为ZnB.浸取时,增大O2压强可促进金属离子浸出C.中和调pH的范围为3.2~4.2D.还原时,增大溶液酸度有利于Cu的生成
CuS精矿(含Zn、Fe元素的杂质)在高压O2作用下,用硫酸溶液浸取,与CuS反应生成CuSO4、S、H2O,Fe2+被氧化为Fe3+,然后加入NH3调节溶液pH,使Fe3+形成Fe(OH)3沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,过滤得到的滤渣中含有S、Fe(OH)3;滤液中含有Cu2+、Zn2+;然后向滤液中通入高压H2,根据元素活动性:Zn>H>Cu,Cu2+被还原为Cu单质,通过过滤分离出来;而Zn2+仍然以离子形式存在于溶液中,再经一系列处理可得到Zn单质。经过上述分析可知,固体X的主要成分是S、Fe(OH)3,金属M为Zn,A正确;
CuS难溶于硫酸溶液,在溶液中存在沉淀溶解平衡:CuS(s) Cu2+(aq)+S2-(aq),增大O2的浓度,可以消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,从而可促进金属离子的浸出,B正确;根据流程图可知,用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,结合离子沉淀的pH范围,可知中和时应该调节溶液pH的范围为3.2~4.2,C正确;
用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,若还原时增大溶液的酸度,c(H+)增大,不利于H2失去电子还原Cu单质,因此不利于Cu的生成,D错误。
4.(2022·河北,8)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
下列说法错误的是A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序B.除杂工序中产生的滤渣可用煤油进行组分分离C.中和工序中的化学反应为Li2CO3+2HBr===CO2↑+2LiBr+H2OD.参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1
由流程可知,氢溴酸中含有少量的溴,加入硫化钡将溴还原生成溴化钡和硫,再加入硫酸除杂,得到的滤渣为硫酸钡和硫;加入碳酸锂进行中和,得到的溴化锂溶液经浓缩等操作后得到产品溴化锂。还原工序逸出的Br2用NaOH溶液吸收,吸收液中含有溴化钠和次溴酸钠等物质,若直接返回还原工序,则产品中会有一定量的溴化钠,导致产品的纯度降低,A错误;
除杂工序中产生的滤渣为硫酸钡和硫,硫可溶于煤油,而硫酸钡不溶于煤油,因此可用煤油进行组分分离,B正确;中和工序中,碳酸锂和氢溴酸发生反应生成溴化锂、二氧化碳和水,C正确;根据得失电子守恒可知,溴和硫化钡反应时物质的量之比为1∶1;根据硫酸钡的化学组成及钡元素守恒可知,n(BaS)∶n(H2SO4)为1∶1,因此,参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1,D正确。
5.(2022·湖南,7)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是A.不宜用陶瓷作吸收塔内衬材料B.采用溶液喷淋法可提高吸收塔内烟气吸收效率C.合成槽中产物主要有Na3AlF6和CO2D.滤液可回收进入吸收塔循环利用
烟气(含HF)通入吸收塔,加入过量的碳酸钠,发生反应:Na2CO3+HF===NaF+NaHCO3,向合成槽中通入NaAlO2,发生反应:6NaF+NaAlO2+4NaHCO3===Na3AlF6↓+4Na2CO3+2H2O,过滤得到Na3AlF6和含有Na2CO3的滤液。陶瓷的成分中含有SiO2,SiO2能与HF发生反应,因此不宜用陶瓷作吸收塔内衬材料,故A正确;
采用溶液喷淋法可增大反应物的接触面积,提高吸收塔内烟气吸收效率,故B正确;由上述分析知,合成槽内产物主要有Na3AlF6、Na2CO3、H2O,故C错误;滤液的主要成分为Na2CO3,可进入吸收塔循环利用,故D正确。
1.(2023·河北邢台市名校联盟高三模拟)用绿矾(FeSO4·7H2O)制备电池电极材料LiFePO4的流程如下:下列说法正确的是A.反应2中氧化剂与还原剂的 物质的量之比为1∶2B.洗涤沉淀时可用玻璃棒搅拌C.可用酸性KMnO4溶液检验反应1中Fe2+是否完全反应D.溶解过程中H3PO4可抑制Fe2+的水解
反应2中H2C2O4将FePO4还原为LiFePO4,Fe元素由+3价下降到+2价,C元素由+3价上升到+4价,FePO4为氧化剂,H2C2O4为还原剂,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为2∶1,A错误;洗涤沉淀时用玻璃棒搅拌容易把滤纸捣破,B错误;
反应1中NaClO将Fe2+氧化为Fe3+,NaClO转化为NaCl,Cl-也能使酸性KMnO4溶液褪色,不能用酸性KMnO4溶液检验反应1中Fe2+是否完全反应,C错误;Fe2+在水溶液中会发生水解,溶解过程中H3PO4可以电离出氢离子,抑制Fe2+的水解,D正确。
2.(2023·福建龙岩市高三质检)锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等)可用于湿法制锌,其流程如图所示。下列说法错误的是A.“酸浸”中ZnFe2O4发生的反 应为ZnFe2O4+8H+===Zn2+ +2Fe3++4H2OB.可用ZnS除去溶液中的Cu2+的 依据是Ksp(ZnS)>Ksp(CuS)C.为提高生产效率,“酸浸”“净化Ⅰ”“净化Ⅱ”的反应温度越高越好D.“电解”的产物之一可用于替换“净化Ⅰ”中的H2O2
锌焙砂中含有ZnO、ZnFe2O4、FeO、CuO,加入硫酸酸浸,ZnO、FeO、CuO转化成相应的硫酸盐,ZnFe2O4与硫酸反应生成Zn2+、Fe3+,加入过氧化氢,将Fe2+氧化成Fe3+,加入ZnO调节pH,使Fe3+以Fe(OH)3的形式沉淀出来,过滤,向滤液中加入过量ZnS,将Cu2+以CuS的形式沉淀出来,据此分析。ZnFe2O4与H2SO4反应的离子方程式为ZnFe2O4+8H+===Zn2++2Fe3++4H2O,故A正确;
净化Ⅱ的目的是将Cu2+以CuS的形式沉淀出来,发生反应:ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),推出Ksp(ZnS)>Ksp(CuS),故B正确;过氧化氢受热易分解,温度过高,过氧化氢分解,造成原料浪费,因此不是反应温度越高越好,故C错误;
净化Ⅱ得到的溶质主要为ZnSO4,电解硫酸锌溶液,阴极电极反应式为Zn2++2e-===Zn,阳极电极反应式为2H2O-4e-===O2↑+4H+,氧气具有强氧化性,能将Fe2+氧化成Fe3+,因此氧气可以替换过氧化氢,故D正确。
3.[2023·湖北省七市(州)高三联考]铼(Re)被称为“类锰元素”,与锰的价层电子排布相同,可以与氧气反应。一种对废氧化铝载体铂铼催化剂中金属元素综合回收利用的工艺如图:下列说法正确的是A.“第1次浸出”中可以用氢氧化钠溶液 代替氨水,浸出渣1成分不变B.铼元素的最高价氧化物Re2O7为碱性氧 化物C.制备铼粉过程中,氢气只体现还原作用D.“第3次浸出”中若用HCl-NaClO3作浸出液,反应的离子方程式可能 为3Pt+16Cl-+2 +12H+===3[PtCl6]2-+6H2O
废氧化铝载体铂铼催化剂经过焙烧细磨后,加入氨水溶解Re得到NH4ReO4,浸出渣1为Pt和氧化铝;NH4ReO4晶体经过800 ℃下通入氢气制备铼粉;浸出渣1加硫酸溶解氧化铝,浸出渣2为
Pt,用于制备海绵Pt;硫酸铝用于制备净水剂,据此分析解题。Al2O3能与氢氧化钠溶液反应,不能使用氢氧化钠溶液代替氨水,故A错误;铼被称为“类锰元素”,与锰的价层电子排布相同,Mn2O7为酸性氧化物,所以Re2O7也为酸性氧化物,故B错误;
在800 ℃下通入氢气,还原NH4ReO4制备铼粉,氢气不仅作还原剂,还作保护气,防止铼粉被氧化,还可以通过气流带走生成的水蒸气和氨气,故C错误;
用HCl-NaClO3作浸出液溶解Pt,可形成配合物,反应的离子方程式可能为3Pt+16Cl-+2 +12H+===3[PtCl6]2-+6H2O,故D正确。
4.(2023·郑州市高三一模)以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:下列说法错误的是A.浸渣中的物质是Fe3O4、SiO2 和CaSO4B.“净化除杂”需先加H2O2溶液再调节溶液的pHC.操作a为蒸发浓缩、冷却结晶D.“粗硼酸”中的主要杂质是七水硫酸镁
以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),根据流程可知,加硫酸溶解,只有SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加入氧化剂,将Fe2+氧化为Fe3+,调节溶液的pH,使Fe3+、Al3+均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3。由分析可知,“浸渣”为SiO2、CaSO4,A错误;
“净化除杂”先加H2O2溶液将Fe2+转化为Fe3+,再调节溶液的pH,生成氢氧化铝和氢氧化铁沉淀,B正确;由分析可知,操作a为蒸发浓缩、冷却结晶,C正确;最后浓缩结晶时硫酸镁易结合水以晶体析出,则粗硼酸中的主要杂质是七水硫酸镁,D正确。
5.(2023·青岛市高三一模)我国首创高钛渣沸腾氯化法获取TiCl4,以高钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料采用该方法获取TiCl4并制备金属钛的流程如右。
已知“降温收尘”后,粗TiCl4中含有的几种物质的沸点如表:
下列说法错误的是A.“除钒”反应为3VOCl3+Al 3VOCl2+AlCl3B.“除硅、铝”过程中,可通过蒸馏的方法分离TiCl4中含Si、Al的杂质C.“除钒”和“除硅、铝”的顺序不可以交换D.“反应器”中应增大湿度以提高反应速率
TiO2、V2O5、SiO2、Al2O3可与C、Cl2反应生成TiCl4、VOCl3、SiCl4、AlCl3、CO、CO2等,尾气处理掉CO、CO2,得到粗TiCl4,TiCl4中的VOCl3与Al发生反应,经过除硅、铝,得到纯TiCl4,TiCl4+4Na
4NaCl+Ti得到Ti,据此分析解答。粗TiCl4中的VOCl3与Al发生反应:3VOCl3+Al 3VOCl2+AlCl3,A正确;TiCl4、SiCl4、AlCl3可通过蒸馏的方法分离TiCl4,B正确;“除钒”和“除硅、铝”的顺序不可以交换,会导致TiCl4中含有AlCl3,C正确;Na为活泼金属,可与水发生剧烈反应,D错误。
6.(2023·辽宁丹东市高三质量测试)用铬铁合金(含少量Ni、C单质)生产硫酸铬的工艺流程如下:已知浸出液中主要金属阳离子为Ni2+、C2+、Cr3+、Fe2+,下列说法正确的是A.“浸出”产生的气体主要为SO2B.“滤渣1”的主要成分为NiS、CSC.“沉铁”步骤主要反应的离子方程式为Fe2++ ===FeC2O4↓D.整个流程中铬元素先被氧化为+6价,后被还原为+3价
加入稀硫酸溶解合金,产生的气体为氢气,A错误;共有四种金属,由流程可知,沉铁后分离出硫酸铬,则“除杂”的目的是除去Ni、C元素,所以“滤渣1”的主要成分为NiS、CS,B正确;草酸是一种弱酸,不能拆,正确的离子方程式为Fe2++H2C2O4=== FeC2O4↓+2H+,C错误;流程中未产生六价铬化合物,D错误。
相关课件
这是一份专题八 选择题专攻 5.有机实验 2024年高考化学二轮复习课件+讲义,文件包含专题八选择题专攻5有机实验pptx、专题八选择题专攻5有机实验教师版docx、专题八选择题专攻5有机实验docx等3份课件配套教学资源,其中PPT共47页, 欢迎下载使用。
这是一份专题六 大题突破(二) 化工流程题的综合分析 2024年高考化学二轮复习课件+讲义,文件包含专题六大题突破二化工流程题的综合分析pptx、专题六大题突破二化工流程题的综合分析教师版docx、专题六大题突破二化工流程题的综合分析docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份专题二 选择题专攻 3.常见无机物的性质与用途 2024年高考化学二轮复习课件+讲义,文件包含专题二选择题专攻3常见无机物的性质与用途pptx、专题二选择题专攻3常见无机物的性质与用途教师版docx、专题二选择题专攻3常见无机物的性质与用途docx等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。









