
化学必背知识手册分类专题04 常见的物质制备实验【高考化学必背知识手册】24
展开
这是一份化学必背知识手册分类专题04 常见的物质制备实验【高考化学必背知识手册】24,共11页。试卷主要包含了实验室制取氯气,实验室制二氧化碳,实验室制一氧化碳,实验室制二氧化硫,实验室制一氧化氮和二氧化氮,实验室制取氨气,氨的催化氧化实验等内容,欢迎下载使用。
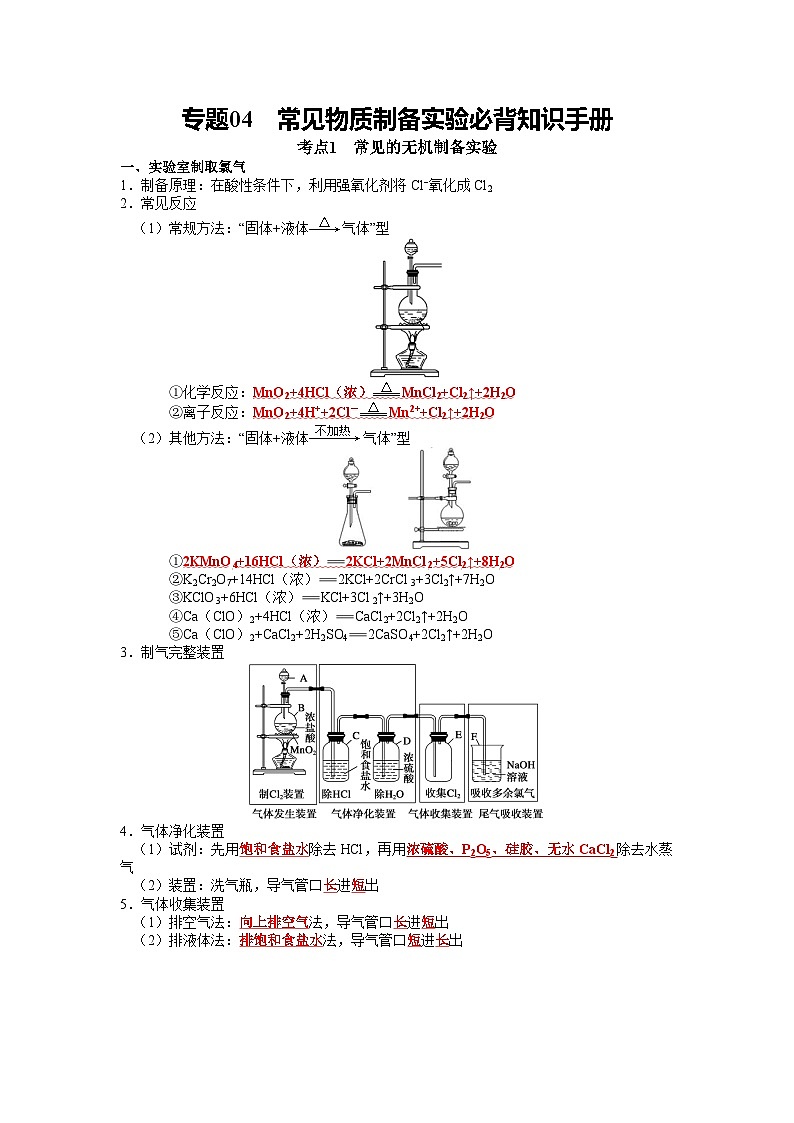
一、实验室制取氯气
1.制备原理:在酸性条件下,利用强氧化剂将Cl−氧化成Cl2
2.常见反应
(1)常规方法:“固体+液体气体”型
①化学反应:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②离子反应:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)其他方法:“固体+液体气体”型
①2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
②K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O
③KClO3+6HCl(浓)KCl+3Cl2↑+3H2O
④Ca(ClO)2+4HCl(浓)CaCl2+2Cl2↑+2H2O
⑤Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O
3.制气完整装置
4.气体净化装置
(1)试剂:先用饱和食盐水除去HCl,再用浓硫酸、P2O5、硅胶、无水CaCl2除去水蒸气
(2)装置:洗气瓶,导气管口长进短出
5.气体收集装置
(1)排空气法:向上排空气法,导气管口长进短出
(2)排液体法:排饱和食盐水法,导气管口短进长出
6.尾气吸收装置
(1)装置作用:吸收多余的氯气,防止污染空气
(2)酸性气体:一般用饱和的碱性溶液吸收
①NaOH:Cl2+2NaOHNaCl+NaClO+H2O
②Na2CO3或NaHCO3
(3)氧化性气体:一般用饱和的强还原性溶液吸收
①FeCl2:2FeCl2+Cl22FeCl3
②Na2S:Na2S+Cl2S↓+2NaCl
③Na2SO3:Na2SO3+Cl2+H2ONa2SO4+2HCl
④KI:Cl2+2KI2KCl+I2
7.检验方法
(1)最佳方法:用湿润的淀粉碘化钾试纸,现象是变蓝
(2)可用方法:用湿润的蓝色石蕊试纸,现象是先变红后褪色
8.证明Cl2中含有水蒸气和HCl
(1)实验装置
(2)所用试剂及作用
①A中:无水CuSO4,检验水蒸气
②B中:四氯化碳,除去HCl中的Cl2
③C中:硝酸银溶液,检验HCl气体
④D中:NaOH溶液,吸收多余的HCl气体,防止污染空气
二、实验室制二氧化碳
1.制备原理
(1)碳酸钙和稀盐酸:CaCO3+2HClCaCl2+CO2↑+H2O
(2)不用大理石和稀硫酸的原因:在CaCO3表面生成微溶的CaSO4沉淀,阻止反应继续进行
2.发生装置:“块状固体+液体→气体”型
4.气体净化装置
(1)试剂:先用饱和NaHCO3溶液除去HCl,再用浓硫酸、P2O5、硅胶、无水CaCl2除去水蒸气
(2)装置:洗气瓶,导气管口长进短出
5.气体收集装置
(1)排空气法:向上排空气法
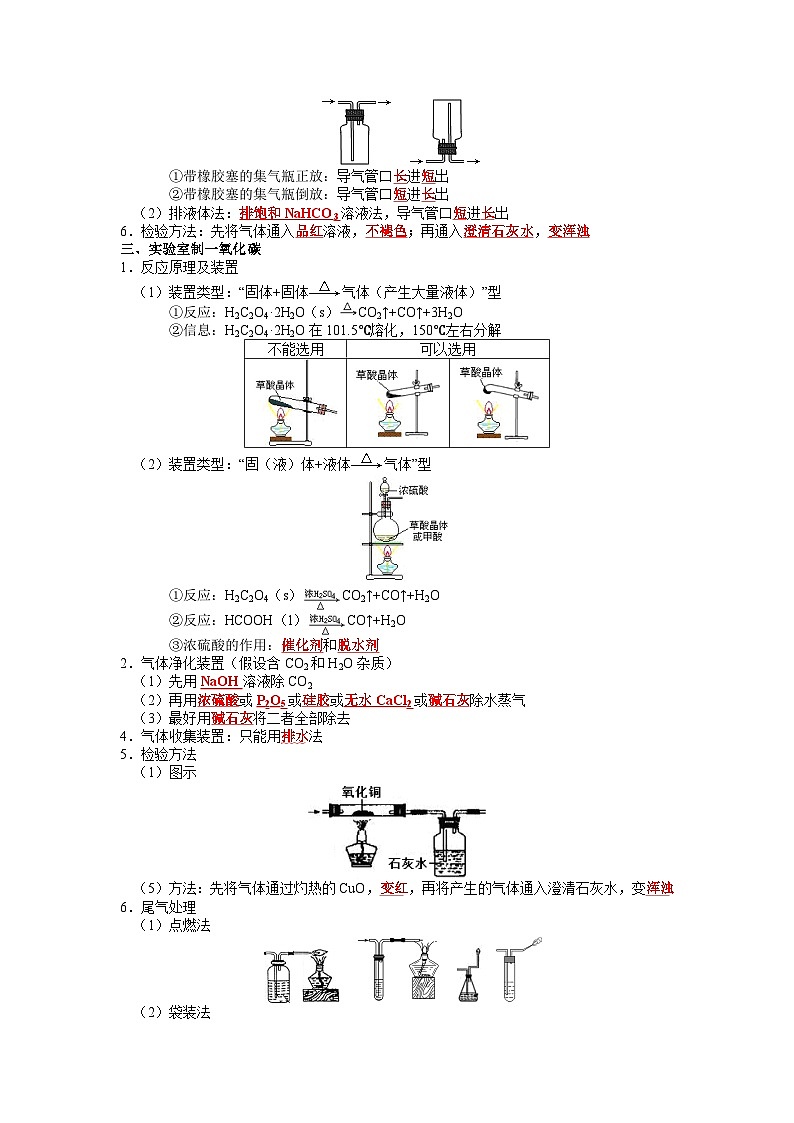
①带橡胶塞的集气瓶正放:导气管口长进短出
②带橡胶塞的集气瓶倒放:导气管口短进长出
(2)排液体法:排饱和NaHCO3溶液法,导气管口短进长出
6.检验方法:先将气体通入品红溶液,不褪色;再通入澄清石灰水,变浑浊
三、实验室制一氧化碳
1.反应原理及装置
(1)装置类型:“固体+固体气体(产生大量液体)”型
①反应:H2C2O4·2H2O(s)CO2↑+CO↑+3H2O
②信息:H2C2O4·2H2O在101.5℃熔化,150℃左右分解
(2)装置类型:“固(液)体+液体气体”型
①反应:H2C2O4(s)CO2↑+CO↑+H2O
②反应:HCOOH(l)CO↑+H2O
③浓硫酸的作用:催化剂和脱水剂
2.气体净化装置(假设含CO2和H2O杂质)
(1)先用NaOH溶液除CO2
(2)再用浓硫酸或P2O5或硅胶或无水CaCl2或碱石灰除水蒸气
(3)最好用碱石灰将二者全部除去
4.气体收集装置:只能用排水法
5.检验方法
(1)图示
(5)方法:先将气体通过灼热的CuO,变红,再将产生的气体通入澄清石灰水,变浑浊
6.尾气处理
(1)点燃法
(2)袋装法
(3)强氧化剂法(信息型)
①银氨溶液:CO+2Ag(NH3)OH(NH4)CO3+2Ag↓+2NH3
②PdCl2溶液:PdCl2+CO+H2OPd↓+CO2+2HCl
③热的高锰酸钾溶液:5CO+2KMnO4+3H2SO45CO2+K2SO4+2MnSO4+3H2O
7.CO还原CuO的实验
(1)开始时
①先点燃酒精灯B(尾气处理)
②再通入CO排尽装置内的空气,防止不纯的CO在点燃时发生爆炸
③最后点燃酒精灯A,进行CO还原CuO的实验
(2)结束时
①先熄灭酒精灯A,停止反应
②再停止通入CO,防止水倒吸入热的硬质玻璃管中使其炸裂
③最后熄灭酒精灯B
8.确定CO、CO2混合气体中含有CO的实验
(1)各装置的作用
①A装置:除去混合气体中的CO2气体。
②B装置:检验混合气体中的CO2是否除尽。
③C装置:检验气体有无还原性或初步检验是否有CO
④D装置:检验有无CO2生成,进一步确认是否有CO
⑤E装置:除去尾气中的CO2气体。
⑥F装置:除去尾气中的CO气体、防止污染空气。
(2)确定有CO的现象:B中无明显现象,C中的物质由黑色变成红色,D中的澄清石灰水变浑浊
四、实验室制二氧化硫
1.反应原理及装置
(1)装置类型:“固体+固体气体”型
①方法:Cu与浓H2SO4混合加热
②反应:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)装置类型:“固体+液体气体”型
①方法:Na2SO3粉末和中等浓度的硫酸混合
②反应:Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O
不用稀硫酸的原因;SO2易溶于水,逸出SO2的较少
不用浓硫酸的原因;在Na2SO3表面生成Na2SO4固体,阻止反应持续进行
2.气体净化装置(假设用亚硫酸钠和稀盐酸反应)
(1)先用饱和NaHSO3溶液除HCl
(2)再用浓硫酸或无水氯化钙或P2O5或硅胶除水蒸气
3.气体的收集:只能用排水法
(1)排液法:排饱和NaHSO3溶液法,导气管长进短出
(2)排气法:向上排空气法,导气管长进短出
4.气体的检验:通入品红溶液,品红褪色,加热又变红
5.尾气处理
(1)酸性气体
①吸收剂:一般用NaOH溶液
②反应:2NaOH+SO2Na2SO3+H2O
(2)还原性气体
①吸收剂:一般用酸性高锰酸钾溶液
②反应:2MnO4-+2H2O+5SO22Mn2++4H++5SO42-
6.实验安全装置
(1)安全隐患:可能发生倒吸现象
(2)在收集装置和尾气吸收装置之间加防倒吸的安全瓶
8.检验碳与浓硫酸反应所有气体产物
(1)各仪器中的试剂及其作用
①A:CuSO4粉末,检验产生的水蒸气
②B:品红溶液,检验产生的SO2气体
③C:酸性KMnO4溶液或溴水,除去SO2气体
④D:品红溶液,检验SO2能否完全除去
⑤E:澄清石灰水,检验产生的CO2气体
(2)证明有CO2气体的现象
①当D中品红溶液不褪色,E中澄清石灰水变浑浊时,说明产物中CO2气体
②若把装置D去掉,当C中溶液颜色未完全褪去,E中澄清石灰水变浑浊时,说明产物中有CO2气体
五、实验室制一氧化氮和二氧化氮
1.反应原理及装置
(1)装置类型:“固体+液体气体”型
或或
(2)药品:铜和稀(浓)硝酸
(3)反应
①NO2:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
②NO:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
2.气体的净化:一般用无水氯化钙或P2O5或硅胶除水蒸气
3.气体的收集
(1)NO:只能用排水法收集或排“惰性”气体法
(2)NO2:向上排空气法或排四氯化碳法
4.气体的检验
(1)NO:通入空气,无色气体变成红棕色气体
(2)NO2:通过湿润的淀粉碘化钾试纸变蓝
5.尾气吸收
(1)NO:一般用酸性的H2O2、酸性高锰酸钾溶液等强氧化性溶液吸收
(2)NO2:一般用NaOH、Na2CO3等碱性溶液吸收
6.特别提醒:制NO前,先通氮气、二氧化碳等气体将装置内的空气排尽
六、实验室制取氨气
1.反应原理及装置
(1)装置类型:“固体+固体气体”型
①方法:氯化铵固体与氢氧化钙固体混合加热
②反应:2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2
(2)装置类型:“液体+液体气体”型
①方法:加热浓氨水
②反应:NH3·H2ONH3↑+H2O
(3)装置类型:“固体+液体气体”型
2.气体的净化:一般用碱石灰吸水
3.气体的收集
(1)方法:向上排空气法和排四氯化碳液体法
(2)净化:试管口堵棉花的作用:防止氨气和空气发生对流,提高氨气的收集速率和纯度
4.验满方法
(1)最佳方法:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则说明氨气收集满了
(2)其他方法:用玻璃棒蘸取浓盐酸或浓硝酸放在集气瓶口,若产生白烟,则说明氨气收集满了
5.尾气吸收
(1)吸收剂:棉花最好用稀硫酸浸湿,防止污染空气
(2)注意防倒吸
6.喷泉实验的原理及操作
(1)典型实验装置及变形设计
(2)操作步骤:先打开止水夹→再挤胶头滴管
(3)形成条件:容器内外产生较大的压强差
①气体完全被液体吸收剂溶解或反应
②气体和气体完全反应生成固体或液体
③气体冷凝成液体使气压减小
④液体变成气体使气压增大
⑤外界气压压缩气体
七、氨的催化氧化实验
1.反应原理:4NH3+5O24NO+6H2O
2.氨气的提供
(1)浓氨水
①向浓氨水中通入空气,使氨挥发出来,从而使氧气和氨充分混合。
②向浓氨水中加入Na2O2,使浓氨水分解产生氨气,从而使氧气和氨充分混合。
(2)铵盐分解法提供氨气
3.氧气的提供
(1)直接通入空气法
(2)双氧水在二氧化锰的催化作用下分解:2H2O22H2O+O2↑
(3)过氧化钠和水反应:2Na2O2+2H2O4NaOH+O2↑
(4)氯酸钾和二氧化锰混合加热:2KClO32KCl+3O2↑
(5)高锰酸钾固体加热:2KMnO4K2MnO4+MnO2+O2↑
(6)过氧化钠和碳酸(氢)铵混合加热:
①NH4HCO3NH3↑+H2O↑+CO2↑或(NH4)2CO32NH3↑+H2O↑+CO2↑
②2Na2O2+2CO22Na2CO3+O2
4.典型现象
(1)锥形瓶中气体呈红棕色:这是因为NH3被氧化为NO,NO遇到空气中的O2又迅速被氧化为红棕色的NO2。
(2)通常瓶内有白烟出现:这是由于锥形瓶里有水蒸气存在,水蒸气和NO2反应生成了HNO3:3NO2+H2O=2HNO3+NO,HNO3再跟NH3反应生成微小的白色NH4NO3晶体:NH3+HNO3=NH4NO3。
(3)铂丝呈红色:这是因为NH3与O2在铂丝的表面上进行的反应是放热反应,反应放出的热量足以使铂丝继续保持红热状态。
考点2 常见的有机制备实验
一、实验室制乙酸乙酯
1.实验装置
2.实验原理:CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
(1)浓硫酸作用:催化剂和吸水剂
(2)b中现象
①液体分层,液面上方有油状液体产生
②溶液中有少量气泡产生
③可以闻到香味
(3)混合乙醇和浓硫酸的方法:将浓硫酸沿玻璃棒缓慢倒入乙醇中,边加边搅拌,冷却
(4)饱和碳酸钠溶液的作用
①溶解乙醇
②反应乙酸
③降低乙酸乙酯的溶解度,利于其分层析出
3.加热方式
(1)先小火加热,防止挥发、发生副反应
(2)先大火加热,将生成的乙酸乙酯蒸馏出来
4.实验安全措施
(1)防暴沸
①a试管中液体的体积不超过其容积的1/3
②在a试管中加入沸石或碎瓷片
(2)防倒吸
①导气管在b试管液面上方1~2cm处
②选用防倒吸的安全装置
5.产物的分离提纯
(1)方法:分液
(2)主要玻璃仪器:分液漏斗和烧杯
二、石油分馏实验
1.实验装置
2.蒸馏烧瓶规格的选择:液体体积占烧瓶容积的1/3
3.温度计水银球的位置:蒸馏烧瓶支管口处
4.常见的冷凝管及其作用
(1)水冷凝管竖直或斜向上放置(三种水冷凝管均可)的作用
①共性作用:导气,平衡气压
②个性作用:冷凝回流××液体,提高原料的利用率
(2)水冷凝管斜向下放置(只有_____水冷凝管可)的作用
①共性作用:导气,平衡气压
②个性作用:冷凝××蒸汽,得到××液体
(3)冷却水的进出口:下进上出,采用逆流原理冷却效果好
5.蒸馏过程
(1)开始时,先通冷凝水,再加热
(2)结束时,先停热,再停通冷凝水
6.加热液液混合物的实验安全措施
(1)防暴沸方法:预先加入沸石或碎瓷片或用磁力搅拌器
(2)忘记加沸石:先停热,再冷却,后补加
三、实验室制硝基苯
1.反应原理:+HNO3(浓)NO2+H2O
2.浓硫酸作用:催化剂和吸水剂
3.反应温度控制在55~60℃
(1)加热方式:水浴加热,优点使液体受热均匀
(2)温度计水银球的位置:水浴中
(3)温度不能太高的原因:防止浓硝酸分解;防止苯和浓硝酸挥发
4.反应液的混合顺序
(1)先加浓硝酸、再加浓硫酸,边加边搅拌
(2)冷却到55℃~60℃,再一滴一滴加入苯
5.长玻璃管的作用
(1)导气,平衡气压
(2)冷凝回流苯和硝酸,提高原料的利用率
6.产品的分离提纯
(1)产品及杂质:硝基苯(含少量硝酸、硫酸及苯)
(2)分离提纯过程
①先加水,液体分为三层,分液取下层液体
②水洗、干燥、蒸馏即得纯净的硝基苯
7.制得的硝基苯常常呈现棕黄色的
(1)原因:硝酸分解的二氧化氮溶解在其中
(2)除去黄色的操作步骤:水洗→碱洗→水洗
8.洗涤容器上残留的硝基苯可选乙醇或乙醚
四、实验室制溴苯
1.反应原理:+Br2Br+HBr
2.实验装置
3.实验现象
(1)剧烈反应,反应液微沸,烧瓶中充满红棕色气体,烧瓶底部有褐色的油状液体产生
(2)导管口附近出现白雾
(3)滴有AgNO3溶液锥形瓶中出现浅黄色沉淀
4.左侧长玻璃管或冷凝管的作用
(1)导气,平衡气压
(2)冷凝回流苯和溴,提高原料的利用率
5.尾气处理装置:锥形瓶
(1)试剂:NaOH溶液或碱石灰
(2)目的:吸收产生的HBr气体,防止污染空气
6.防倒吸的安全措施
(1)右侧长玻璃导管位于锥形瓶中液面以上
(2)选用防倒吸的安全装置
7.证明该反应为取代反应
(1)将气体通入四氯化碳或苯中吸收溴蒸汽
(2)再将剩余气体通入AgNO3溶液中,产生浅黄色沉淀
8.产品的分离提纯
(1)产品及杂质:溴苯(含少量苯、溴、三溴苯、FeBr3和HBr)
(2)分离提纯过程
①先加水振荡、静置,液体分三层,分液
②取下层液加NaOH溶液,振荡、静置、分液
③取下层液水洗、干燥、蒸馏,得无水溴苯
不能选用
可以选用
方法
原理
浓氨水与NaOH固体混合
①NaOH溶于水放热,促使氨水分解
②NaOH固体吸水,使c(OH-)增大,有利于NH3的生成
③加入NaOH,使c(OH-)增大,有利于NH3的生成
浓氨水与CaO固体混合
①CaO与水反应放热,促使氨水分解。
②CaO与水反应,使水减少,使c(OH-)增大,有利于NH3的生成
③生成Ca(OH)2,使c(OH-)增大,有利于NH3的生成
直形冷凝管
球形冷凝管
蛇形冷凝管
简易装置
改进装置
相关试卷
这是一份化学必背知识手册分类专题01 金属及其化合物【高考化学必背知识手册】21,共19页。试卷主要包含了单质钠的结构和性质,钠的氧化物的结构和性质,碳酸钠的性质和应用,碳酸氢钠的性质和应用,有关Na2CO3,碱金属元素,焰色试验等内容,欢迎下载使用。
这是一份化学必背知识手册分类专题02 非金属及其化合物【高考化学必背知识手册】22,共22页。试卷主要包含了卤素单质的结构,卤素单质的物理性质,卤素单质的化学性质,次氯酸和次氯酸盐,硫酸根离子的检验等内容,欢迎下载使用。
这是一份化学必背知识手册分类专题03 化学实验仪器和基本操作【高考化学必背知识手册】23,共9页。试卷主要包含了化学实验仪器的识别,广口瓶的“一材多用”,用途广泛的干燥管等内容,欢迎下载使用。








