

化学必背知识手册分类第三章 烃的衍生物-【知识手册】(人教版选择性必修3)(教师版)12
展开
这是一份化学必背知识手册分类第三章 烃的衍生物-【知识手册】(人教版选择性必修3)(教师版)12,共29页。学案主要包含了卤代烃,取代反应 消去反应等内容,欢迎下载使用。
一、卤代烃
1、概念与分类
2、卤代烃的命名
卤代烃的命名一般用 系统 命名法,与烃类的命名相似。例如:
、CH2==CH—Cl、
2-氯丁烷 氯乙烯 1,2-二溴乙烷
3、物理性质
4、几种卤代烃的密度和沸点
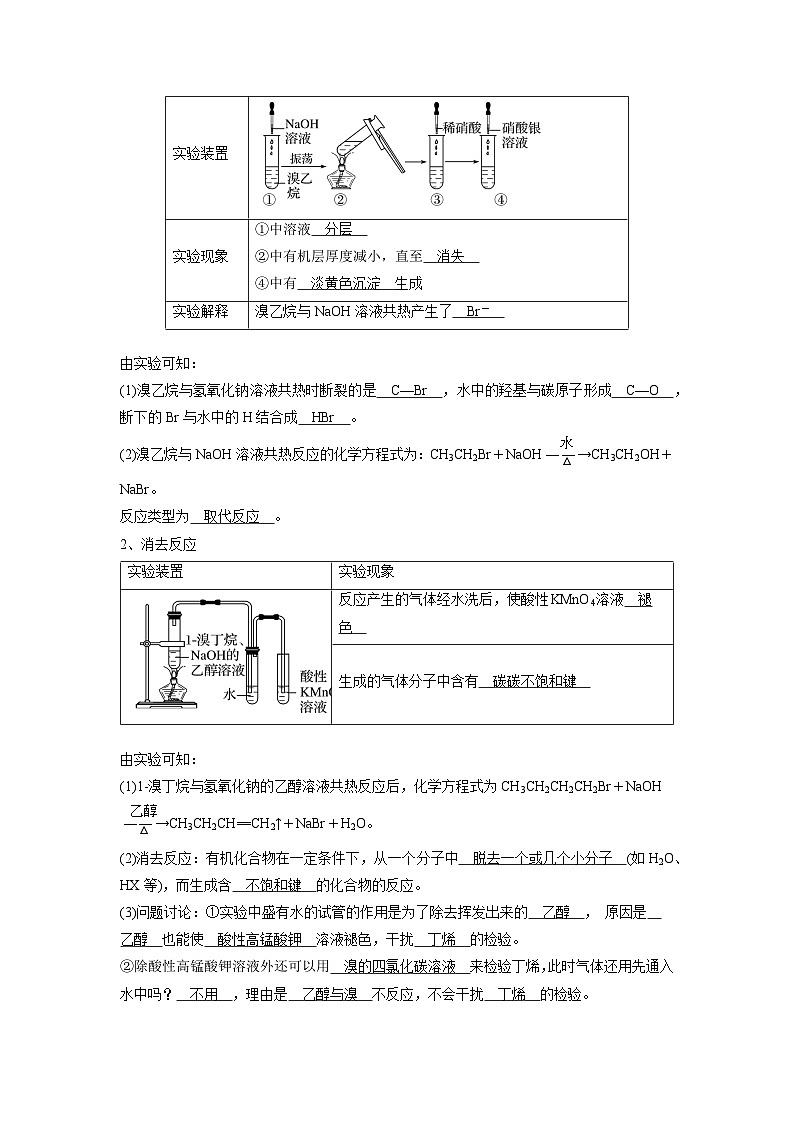
二、取代反应 消去反应
1、取代反应(水解反应)
由实验可知:
(1)溴乙烷与氢氧化钠溶液共热时断裂的是 C—Br ,水中的羟基与碳原子形成 C—O ,断下的Br与水中的H结合成 HBr 。
(2)溴乙烷与NaOH溶液共热反应的化学方程式为:CH3CH2Br+NaOHeq \(――→,\s\up11(水),\s\d4(△))CH3CH2OH+NaBr。
反应类型为 取代反应 。
2、消去反应
由实验可知:
(1)1-溴丁烷与氢氧化钠的乙醇溶液共热反应后,化学方程式为CH3CH2CH2CH2Br+NaOHeq \(――→,\s\up11(乙醇),\s\d4(△))CH3CH2CH==CH2↑+NaBr+H2O。
(2)消去反应:有机化合物在一定条件下,从一个分子中 脱去一个或几个小分子 (如H2O、HX等),而生成含 不饱和键 的化合物的反应。
(3)问题讨论:①实验中盛有水的试管的作用是为了除去挥发出来的 乙醇 , 原因是 乙醇 也能使 酸性高锰酸钾 溶液褪色,干扰 丁烯 的检验。
②除酸性高锰酸钾溶液外还可以用 溴的四氯化碳溶液 来检验丁烯,此时气体还用先通入水中吗? 不用 ,理由是 乙醇与溴 不反应,不会干扰 丁烯 的检验。
三、卤代烃的化学性质及卤代烃中卤素原子的检验
1、卤代烃的化学性质
(1)取代反应(水解反应)
R—X+NaOHeq \(――→,\s\up11(水),\s\d4(△))R—OH+NaX。
反应机理:在卤代烃分子中,由于卤素原子的电负性比碳原子的大,使C—X的电子向 卤素原子 偏移,进而使碳原子带部分正电荷(δ+),卤素原子带部分负电荷(δ-),这样就形成一个极性较强的共价键:Cδ+—Xδ-。因此,卤代烃在化学反应中,C—X较易断裂,使卤素原子被其他原子或原子团所 取代 ,生成负离子而离去。
(2)消去反应
+NaOHeq \(――→,\s\up11(醇),\s\d4(△))+NaX+H2O。
2、卤代烃中卤素原子的检验
(1)实验流程
(2)实验要点
①通过水解反应或消去反应将卤素原子转化为卤素离子。
②排除其他离子对卤素离子检验的干扰,卤素原子转化为卤素离子后必须加入稀硝酸中和过量的碱。
3、制取卤代烃的方法
(1)烷烃取代法:CH4+Cl2eq \(――→,\s\up7(光照)) CH3Cl+HCl 。
(2)烯(炔)烃加成卤素:
CH2==CH2+Br2―→ CH2BrCH2Br 。
(3)烯(炔)烃加成卤化氢:CH2 ==CH2+HCleq \(――→,\s\up7(催化剂)) CH3CH2Cl 。
(4)芳香烃取代法:+Br2eq \(――→,\s\up7(FeBr3))+HBr。
INCLUDEPICTURE "F:\\化学(新教材)人教版 选择性必修3\\左括.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\米昕\\2020\\同步\\化学\\步步高 化学 人教版 选择性必修3\\左括.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\米昕\\2020\\同步\\化学\\步步高 化学 人教版 选择性必修3\\wrd\\左括.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\米昕\\2020\\同步\\化学\\步步高 化学 人教版 选择性必修3\\wrd\\左括.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\米昕\\2020\\同步\\化学\\步步高 化学 人教版 选择性必修3\\wrd\\左括.TIF" \* MERGEFORMATINET 【特别提醒】工业上制备氯乙烷时,常用 CH2==CH2 与 HCl发生加成反应制取,因为 乙烯 与氯化氢反应产物纯净,易分离、提纯。
4、卤代烃的用途与危害
(1)用途:制冷剂、灭火剂、溶剂、麻醉剂、合成有机化合物。
(2)危害:含 氯、溴的氟代烷 可对 臭氧层 产生破坏作用,形成 臭氧 空洞,危及地球上的生物。
5、卤代烯烃
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加成聚合反应。例如,氯乙烯能加成聚合生成 聚氯乙烯 ,四氟乙烯加成聚合生成 聚四氟乙烯 。聚氯乙烯和聚四氟乙烯都是用途广泛的 高分子 材料。
nCF2==CF2―→CF2—CF2
四氟乙烯 聚四氟乙烯
第二节 醇 酚
一、醇
(一)醇的概述
1、醇的概念、分类及命名
(1)概念:醇是 羟基 与饱和碳原子相连的化合物。
饱和一元醇通式为 CnH2n+1OH 或CnH2n+2O(n≥1,n为整数)。
(2)分类
(3)命名
①步骤原则
eq \x(选主链)—选择含有与 羟基 相连的碳原子的最长碳链为,主链,根据碳原子数目称为某醇
|
eq \x(碳编号)—从距离 羟基 最近的一端给主链碳原子依次编号
|
eq \x(标位置)—醇的名称前面要用阿拉伯数字标出羟基的位置;羟基的个数用“二”“三”等表示
②实例
CH3CH2CH2OH 1-丙醇 ; 2-丙醇 ; 1,2,3-丙三醇 。
③注意:用系统命名法命名醇,确定最长碳链时不能把—OH看作链端,只能看作 取代基 ,但选择的最长碳链必须连有 —OH 。
2、物理性质
(1)沸点
①相对分子质量相近的醇和烷烃相比,醇的沸点远远 高 于烷烃。
②饱和一元醇,随分子中碳原子个数的增加,醇的沸点 升高 。
③碳原子数相同时,羟基个数越多,醇的沸点 越高 。
(2)溶解性:甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比例混溶。
(3)密度:醇的密度比水的密度 小 。
3、几种重要的醇
(二)醇的化学性质——以乙醇为例
乙醇发生化学反应时,可断裂不同的化学键。如
1、与钠反应
分子中 a 键断裂,化学方程式为2CH3CH2OH+2Na―→ 2CH3CH2ONa+H2↑ 。
2、消去反应——乙烯的实验室制法
(1)实验装置
(2)实验步骤
①将浓硫酸与乙醇按体积比约3∶1混合,即将15 mL浓硫酸缓缓加入到盛有5 mL 95%乙醇的烧杯中混合均匀,冷却后再倒入长颈圆底烧瓶中,并加入碎瓷片防止 暴沸 ;
②加热混合溶液,迅速升温到170 ℃,将生成的气体分别通入酸性KMnO4溶液和溴的四氯化碳溶液中,观察现象。
(3)实验现象
酸性KMnO4溶液、溴的四氯化碳溶液 褪色 。
(4)实验结论
乙醇在浓硫酸作用下,加热到170 ℃,发生了消去反应,生成乙烯。
分子中 b、d 键断裂,化学方程式为CH3CH2OHeq \(―――→,\s\up11(浓H2SO4),\s\d4(170 ℃))CH2== CH2↑+H2O 。
3、取代反应
(1)与HX发生取代反应
分子中b键断裂,化学方程式为C2H5OH+HXeq \(――→,\s\up7(△)) C2H5X+H2O 。
(2)分子间脱水成醚
一分子中 a 键断裂,另一分子中 b 键断裂,化学方程式为
2CH3CH2OH eq \(―――→,\s\up11(浓H2SO4),\s\d4(140 ℃)) CH3CH2OCH2CH3+H2O 。
【醚类简介】
(1)醚的概念和结构
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚。醚的结构可用R—O—R′来表示,R和R′都是烃基,可以相同,也可以不同。
(2)乙醚的物理性质
乙醚是一种无色、易挥发的液体,沸点34.5 ℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机化合物。
4、氧化反应
(1)燃烧反应:C2H5OH+3O2eq \(――→,\s\up7(点燃)) 2CO2+3H2O 。
(2)催化氧化
乙醇在铜或银作催化剂加热的条件下与空气中的氧气反应生成乙醛,分子中 a、c 键断裂,化学方程式为2CH3CH2OH+O2eq \(―――→,\s\up11(Cu或Ag),\s\d4(△)) 2CH3CHO+2H2O 。
(3)醇被酸性KMnO4溶液或酸性K2Cr2O7溶液氧化
Ⅰ.实验装置
Ⅱ.实验步骤:
①在试管中加入少量酸性重铬酸钾溶液。
②滴加少量乙醇,充分振荡,观察并记录实验现象。
Ⅲ.实验现象:溶液由黄色变为 墨绿色 。
乙醇能被酸性重铬酸钾溶液氧化,其氧化过程分为两个阶段:
eq \(CH3CH2OH,\s\d8(乙醇))eq \(――→,\s\up7(氧化))eq \(CH3CHO,\s\d8(乙醛))eq \(――→,\s\up7(氧化))eq \(CH3COOH,\s\d8(乙酸))。
5、醇消去反应的规律
(1)醇消去反应的原理如下:
(2)若醇分子中只有一个碳原子或与—OH相连碳原子的相邻碳原子上无氢原子,则不能发生消去反应。如CH3OH、、等。
(3)某些醇发生消去反应,可以生成不同的烯烃,如:有三种消去反应有机产物。
6、醇催化氧化反应的规律
(1)RCH2OH被催化氧化生成醛:
2RCH2OH+O2eq \(――→,\s\up11(Cu或Ag),\s\d4(△))2RCHO+2H2O
(2)被催化氧化生成酮:
+O2eq \(――→,\s\up11(Cu或Ag),\s\d4(△))+2H2O
(3)一般不能被催化氧化。
二、酚
(一)酚的概念及其代表物的结构
1、酚的概念
酚是羟基与 苯环 直接相连而形成的化合物。
如:、和
2、苯酚的分子结构
3、苯酚的物理性质
(二)苯酚的化学性质
1、弱酸性
实验探究
根据实验现象,完成下列反应的化学方程式:
试管②:+NaOH―→+H2O。
试管③:+HCl―→+NaCl。
试管④:+CO2+H2O―→+NaHCO3。
2、取代反应
实验探究
实验步骤:向盛有少量苯酚稀溶液的试管中滴加过量的饱和溴水。
现象: 有白色沉淀 生成。
反应的化学方程式:
+3Br2―→+3HBr,在此反应中,苯酚分子中苯环上的 氢原子 被 溴 原子取代,发生了取代反应。
3、显色反应
实验探究
实验过程:在少量苯酚溶液中滴加氯化铁溶液。
现象:溶液显 紫色 。
4、氧化反应
苯酚是 无 色晶体,但放置时间过长往往显粉 红 色,其原因是部分苯酚被空气中的氧气氧化。
5、苯、苯酚与Br2反应的比较
6、脂肪醇、芳香醇和酚的比较
7、有机分子内原子或原子团的相互影响
(1)链烃基对其他基团的影响
甲苯的硝化反应产物是三硝基甲苯,而同样条件下的苯的硝化反应只能生成一硝基苯。
(2)苯环对其他基团的影响
①水、醇、苯酚提供氢离子的能力大小:R—OH < H—OH < C6H5—OH。
②烷烃和苯均不能使酸性高锰酸钾溶液褪色,而苯的同系物可使酸性高锰酸钾溶液褪色。
(3)羟基对其他基团的影响
①羟基对C—H的影响:使和羟基相连的C—H更不稳定。
②羟基对苯环的影响:使苯环邻、对位上的氢原子更易被取代。
第三节 醛 酮
一、乙醛
(一)乙醛的性质
1、醛的概念及结构特点
醛是由烃基(或氢原子)与 醛基 相连而构成的化合物。醛类官能团的结构简式是 —CHO ,饱和一元醛的通式为 CnH2nO(n≥1) 或 CnH2n+1CHO 。
2、乙醛的结构与物理性质
3、乙醛的化学性质
(1)加成反应
①催化加氢(还原反应)
乙醛中的碳氧双键和烯烃中的碳碳双键性质类似,也能与氢气发生 加成 反应,化学方程式为CH3CHO+H2eq \(――→,\s\up11(催化剂),\s\d4(△)) CH3CH2OH 。
②与HCN加成
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏向氧原子,使氧原子带部分 负电荷 ,碳原子带部分 正电荷 ,从而使醛基具有较强的 极性 。乙醛能和一些极性试剂例如 氰化氢 (HCN)发生加成反应:+H—CN―→(2-羟基丙腈)。
(2)氧化反应
①可燃性
乙醛燃烧的化学方程式:2CH3CHO+5O2eq \(――→,\s\up7(点燃)) 4CO2+4H2O 。
②催化氧化
乙醛在一定温度和催化剂作用下,能被氧气氧化为乙酸的化学方程式:
+O2eq \(――→,\s\up11(催化剂),\s\d4(△)) 。
③与银氨溶液反应
④与新制氢氧化铜反应
⑤乙醛能被酸性高锰酸钾溶液、溴水等强氧化剂氧化。
(二)醛的结构与常见的醛
1、常见的醛
(1)甲醛:又名蚁醛,是结构最简单的醛,结构简式为 HCHO 。通常状况下是一种 无 色有强烈 刺激性 气味的气体,易溶于水。它的水溶液又称 福尔马林 ,具有杀菌、防腐性能,可用于消毒和制作生物标本。
①结构特点
甲醛的分子式为CH2O,其分子可以看成含两个醛基,如图:
②甲醛氧化反应的特殊性
甲醛发生氧化反应时,可理解为
eq \(――→,\s\up7(氧化)) eq \(――→,\s\up7(氧化))。
所以,甲醛分子中相当于有2个—CHO,当与足量的银氨溶液或新制的Cu(OH)2作用时,可存在如下量的关系:
1 ml HCHO~4 ml Ag;
1 ml HCHO~4 ml Cu(OH)2~2 ml Cu2O。
(2)苯甲醛
苯甲醛是最简单的芳香醛,俗称 苦杏仁油 ,是一种有苦杏仁气味的无色液体。苯甲醛是制造染料、香料及药物的重要原料。
2、醛的化学通性
(1)醛可被氧化为羧酸,也可被氢气还原为醇,因此醛既有 氧化 性,又有 还原 性,其氧化、还原的关系为R—CH2OHeq \(,\s\up11(氧化),\s\d4(还原))eq \(――→,\s\up7(氧化))。
(2)有机物的氧化、还原反应
①氧化反应:有机物分子中失去 氢原子 或加入 氧原子 的反应,即加氧去氢。
②还原反应:有机物分子中加入 氢原子 或失去 氧原子 的反应,即加氢去氧。
③醛基的检验:在洁净的试管中加入新制银氨溶液和少量试样后,水浴加热,有银镜生成,或在洁净的试管中加入少量试样和新制的Cu(OH)2,加热煮沸,有砖红色沉淀生成。
三、酮
(一)酮的结构与性质
1、酮的概念和结构特点
2、丙酮
(1)丙酮是最简单的酮类化合物,结构简式为:。
(2)丙酮的物理性质
常温下丙酮是无色透明液体,沸点56.2 ℃,易 挥发 ,能与 水、乙醇 等互溶。
(3)丙酮的化学性质
不能被 银氨 溶液、新制的 氢氧化铜 等弱氧化剂氧化,但能催化加氢生成 醇 。
反应的化学方程式:
+H2eq \(――→,\s\up11(催化剂),\s\d4(△))。
3、醛和酮的区别与联系
第四节 羧酸 羧酸衍生物
一、羧酸
(一)羧酸的结构与分类
1、羧酸的组成和结构
(1)羧酸:由烃基(或氢原子)与 羧基 相连而构成的有机化合物。官能团为 —COOH 或。
(2)通式:一元羧酸的通式为R—COOH,饱和一元羧酸的通式:CnH2nO2或 CnH2n+1COOH 。
2、羧酸的分类
(1)按分子中烃基的结构分类
羧酸 eq \b\lc\{\rc\ (\a\vs4\al\c1(脂肪酸:如乙酸、C17H35COOH,芳香酸:如))
(2)按分子中羧基的个数分类
羧酸 eq \b\lc\{\rc\ (\a\vs4\al\c1(一元羧酸:如乙酸,二元羧酸:如草酸HOOC—COOH,多元羧酸:如柠檬酸))
(3)按分子中烃基所含碳原子数多少分类
羧酸eq \b\lc\{\rc\ (\a\vs4\al\c1(高级脂肪酸\b\lc\{\rc\ (\a\vs4\al\c1(硬脂酸C17H35COOH,软脂酸C15H31COOH,油酸C17H33COOH)),低级脂肪酸:如甲酸、乙酸等))
3、常见的羧酸
4、羧酸的物理性质
甲酸、乙酸等分子中碳原子数较少的羧酸能够与水 互溶 。随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速 减小 ,甚至不溶于水,其沸点也 逐渐升高 。高级脂肪酸是 不溶于 水的 蜡状固体 。羧酸与相对分子质量相当的其他有机化合物相比,沸点较高 ,这与羧酸分子间可以形成 氢键 有关。
(二)羧酸的化学性质
羧酸的化学性质与乙酸相似,主要取决于官能团 羧基 。
1、酸性
由于—COOH能电离出H+,使羧酸具有 弱酸 性,一元羧酸电离的方程式:RCOOH―→
RCOO-+H+―→。
写出下列反应的化学方程式:
(1)蜂、蝎子都会分泌蚁酸,被蜂、蝎子蛰咬可涂抹稀氨水、小苏打水缓解疼痛,上述反应的化学方程式为HCOOH+NH3·H2O―→HCOONH4+H2O、HCOOH+NaHCO3―→HCOONa+H2O+CO2 ↑。
(2)苯甲酸与烧碱反应可制取防腐剂苯甲酸钠,该反应的离子方程式为+OH-
―→+H2O。
(3)设计实验,比较乙酸、碳酸和苯酚的酸性强弱。
2、酯化反应
(1)概念
羧酸和醇在酸催化下生成酯和水的反应叫酯化反应,属于取代反应。
(2)反应规律
羧酸与醇发生酯化反应时,羧酸脱去羟基,醇脱去氢。如在浓硫酸催化作用下,醋酸与乙醇(CH3CH218OH)酯化反应的化学方程式为
3、“形形色色”的酯化反应
(1)一元羧酸与二元醇或二元羧酸与一元醇的酯化反应
如:2CH3COOH+HOCH2CH2OHeq \(,\s\up11(浓硫酸),\s\d4(△)) CH3COOCH2CH2OOCCH3+2H2O 。
(2)二元羧酸与二元醇的酯化反应
①形成环状酯
+eq \(,\s\up11(浓硫酸),\s\d4(△))+2H2O。
②形成高分子化合物——聚酯
nHOOC—COOH+nHOCH2CH2OHeq \(,\s\up7(催化剂))+(2n-1)H2O。
(3)含有羧基(—COOH)和羟基(—OH)有机物的酯化反应,如乳酸()
①两分子酯化:
+eq \(,\s\up11(催化剂),\s\d4(△))+2H2O。
②羟基酸分子内脱水生成酯
eq \(,\s\up11(浓硫酸),\s\d4(△))+H2O。
③羟基酸自身聚合形成高分子化合物——聚酯
eq \(,\s\up7(催化剂)) +(n-1)H2O 。
4、醇、酚、羧酸分子中羟基氢原子的活泼性比较
由上表可知,常见分子(离子)中羟基氢原子的活泼性顺序为RCOOH > H2CO3 >
> HCOeq \\al(-,3) > H2O > ROH。运用上述实验现象的不同,可判断有机物分子结构中含有的羟基类型。
二、羧酸衍生物
(一)酯
1、酯的组成与结构
(1)酯是羧酸分子羧基中的—OH被—OR′取代后的产物,其结构可简写为。
其中:①R和R′可以相同,也可以不同。
②R是烃基,也可以是H,但R′只能是烃基。
③羧酸酯的官能团是 酯基 。
(2)饱和一元羧酸CnH2n+1COOH与饱和一元醇CmH2m+1OH生成酯的结构简式为 CnH2n+1COOCmH2m+1 ,其组成通式为 CnH2nO2 (n≥2)。
(3)命名:根据生成酯的酸和醇命名为某酸某酯。
如:CH3COOCH2CH3 乙酸乙酯 ;
HCOOCH2CH2CH3 甲酸正丙酯 。
2、酯的存在与物理性质
(1)存在:酯类广泛存在于自然界中,低级酯存在于各种水果和花草中。如苹果里含有 戊酸戊酯 ,菠萝里含有 丁酸乙酯 ,香蕉里含有乙酸异戊酯等。
(2)物理性质
低级酯是具有 芳香 气味的液体,密度一般比水 小 ,并难溶于水,易溶于乙醇和乙醚等有机溶剂中。
3、酯的化学性质
(1)酯的水解反应原理
酯化反应形成的键,即酯水解反应断裂的键。请用化学方程式表示水解反应的原理:
eq \(,\s\up7(△))。
(2)酯在酸性或碱性条件下的 水解 反应
①在酸性条件下,酯的水解是可逆反应。乙酸乙酯在稀硫酸存在下水解的化学方程式为
CH3COOC2H5+H2Oeq \(,\s\up11(稀硫酸),\s\d4(△)) CH3COOH+C2H5OH 。
②在碱性条件下,酯水解生成羧酸盐和醇,水解反应是不可逆反应。乙酸乙酯在氢氧化钠存在下水解的化学方程式为CH3COOC2H5+NaOHeq \(――→,\s\up7(△))CH3COONa+C2H5OH。
③酯在碱性条件下的水解程度比在酸性条件下水解程度大。
4、酯化反应与酯的水解反应的比较
(二)油脂
1、油脂的结构和分类
(1)概念
油脂是由 高级脂肪酸 和 甘油 生成的酯,属于酯类化合物。
(2)结构
①结构简式:。
②官能团:酯基,有的在其烃基中可能含有碳碳不饱和键。
(3)分类
油脂eq \b\lc\{\rc\ (\a\vs4\al\c1(按状态分\b\lc\{\rc\ (\a\vs4\al\c1(油:常温下呈液态植物油,脂肪:常温下呈固态动物油)),按高级脂肪酸的种类分\b\lc\{\rc\ (\a\vs4\al\c1(简单甘油酯:R、R′、R″相同,混合甘油酯:R、R′、R″不同))))
(4)常见高级脂肪酸
2、油脂的性质
(1)物理性质
①密度:比水的小。
②溶解性:难溶于水,易溶于有机溶剂。
③熔、沸点:天然油脂都是混合物,没有固定的熔、沸点。
(2)化学性质
①水解反应
如:硬脂酸甘油酯在酸性条件下水解反应的化学方程式为
+3H2Oeq \(,\s\up11(H+),\s\d4(△))3C17H35COOH+。
如:硬脂酸甘油酯在NaOH溶液中水解的化学方程式为
+3NaOHeq \(――→,\s\up7(△))3C17H35COONa+。油脂在碱性溶液中的水解反应又称为 皂化 反应,工业上常用来制取肥皂。 高级脂肪酸钠 是肥皂的有效成分。
②油脂的氢化
油酸甘油酯与氢气发生加成反应的化学方程式为
+3H2eq \(――→,\s\up11(催化剂),\s\d4(△)),
这一过程又称为油脂的 氢化 ,也可称为油脂的 硬化 。这样制得的油脂叫 人造脂肪 ,通常又称为 硬化油 。
③肥皂的制取
生产流程:
盐析:
工业上利用油脂在 碱 性条件下的水解生成 高级脂肪酸钠盐 (肥皂的主要成分),反应完毕后加食盐进行 盐析 ,因为氯化钠能降低高级脂肪酸钠的溶解度,使混合液分成上下两层,上层为高级脂肪酸钠盐,下层为 甘油 和 食盐水 的混合液。
④脂肪、油、矿物油三者的比较
3、甲酸酯的结构与性质
甲酸酯的结构为,分子中含有一个 酯 基和一个 醛 基,所以甲酸酯除了能发生水解反应外,还可以发生醛的特征反应,如 银镜 反应、与 新制的Cu(OH)2 反应。由此可知,能发生银镜反应及与新制的Cu(OH)2反应产生砖红色沉淀的有醛、甲酸、甲酸酯等含有醛基的物质。
(三)酰胺
1、胺的结构
烃基取代氨分子中的氢原子而形成的化合物叫做胺,胺也可以看作是烃分子中的 氢 原子被 氨基 所替代得到的化合物。根据取代烃基数目不同,胺有三种结构通式:
2、胺的性质
(1)物理性质
低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体。芳香胺是无色高沸点的液体或低熔点的固体,并有 毒性 。
低级的伯、仲、叔胺都有较好的水溶性。随着碳原子数的增加,胺的水溶性逐渐下降。
(2)化学性质(胺的碱性)
RNH2+H2ORNHeq \\al(+,3)+OH-;
RNH2+HClRNH3Cl;
RNH3Cl+NaOHRNH2+NaCl+H2O。
3.酰胺
(1)酰胺的结构
酰胺是 羧酸 分子中羟基被 氨基 所替代得到的化合物,其结构一般表示为,其中的叫做酰基,叫做 酰胺基 。
(2)几种常见酰胺及其名称
N-甲基乙酰胺 N,N-二甲基乙酰胺
N-甲基-N-乙基苯甲酰胺 N-甲基苯甲酰胺
(3)酰胺的性质(水解反应)
酰胺在酸或碱存在并加热的条件下可以发生水解反应。如果水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
RCONH2+H2O+HCleq \(――→,\s\up7(△)) RCOOH+NH4Cl ;RCONH2+NaOHeq \(――→,\s\up7(△)) RCOONa+NH3↑。
第五节 有机合成
一、有机合成的主要任务
(一)有机合成
1、有机合成的概念
有机合成指利用相对简单、易得的原料,通过有机化学反应来构建 碳骨架 和引入 官能团 ,由此合成出具有特定 结构 和 性质 的目标分子的过程方法。
2、有机合成的任务和过程
3、有机合成的原则
(1)起始原料要廉价、易得、低毒、低污染。
(2)尽量选择步骤最少的合成路线,使得反应过程中副反应 少 、产率 高 。
(3)符合“绿色化学”的要求,操作简单、条件温和、能耗低、易实现、原料利用率高、污染少,尽量实现零排放。
(4)按照一定的反应顺序和规律引入官能团,不能臆造不存在的反应事实。
(二)有机合成中的碳骨架的构建和官能团的引入
1、构建碳骨架
(1)增长碳链
①卤代烃与NaCN的反应
CH3CH2Cl+NaCN―→ CH3CH2CN(丙腈)+NaCl ;
CH3CH2CNeq \(―――→,\s\up7(H2O、H+)) CH3CH2COOH 。
②醛、酮与氢氰酸的加成反应
CH3CHO+HCN―→;
eq \(―――→,\s\up7(H2O、H+))。
③卤代烃与炔钠的反应
2CH3C≡CH+2Naeq \(――→,\s\up7(液氨)) 2CH3C≡CNa+H2 ;
CH3C≡CNa+CH3CH2Cl―→ CH3C≡CCH2CH3+NaCl 。
④羟醛缩合反应
CH3CHO+eq \(――→,\s\up7(OH-))。
(2)缩短碳链
①脱羧反应
R—COONa+NaOHeq \(――→,\s\up11(CaO),\s\d4(△)) R—H+Na2CO3 。
②氧化反应
eq \(―――――――→,\s\up7(KMnO4H+,aq));
R—CH==CH2eq \(―――――――→,\s\up7(KMnO4H+,aq)) RCOOH+CO2↑ 。
③水解反应:主要包括酯的水解、蛋白质的水解和多糖的水解。
④烃的裂化或裂解反应
C16H34eq \(――→,\s\up7(高温))C8H18+C8H16 ;C8H18eq \(――→,\s\up7(高温)) C4H10+C4H8 。
(3)成环
①二烯烃成环反应(第尔斯-阿尔德反应)
②形成环酯
+eq \(,\s\up11(浓硫酸),\s\d4(△))+2H2O。
③形成环醚
(4)开环
①环酯水解开环
②环烯烃氧化开环
2、常见官能团引入或转化的方法
(1)碳碳双键
①醇的消去反应
CH3CH2OHeq \(―――→,\s\up11(浓H2SO4),\s\d4(170 ℃)) CH2==CH2↑+H2O 。
②卤代烃的消去反应
CH3—CH2—Br+NaOHeq \(――→,\s\up11(乙醇),\s\d4(△)) CH2==CH2↑+NaBr+H2O 。
③炔烃的不完全加成反应
CH≡CH+HCleq \(――→,\s\up11(催化剂),\s\d4(△)) CH2==CHCl 。
(2)卤素原子
①烃与卤素单质的取代反应
+Br2eq \(――→,\s\up7(FeBr3))+HBr;
+Cl2eq \(――→,\s\up7(光照))+HCl。
②不饱和烃的加成反应
+Br2―→;
CH2==CHCH3+HBreq \(――→,\s\up7(催化剂)) CH3CHBrCH3;
CH≡CH+HCleq \(――→,\s\up11(催化剂),\s\d4(△))CH2==CHCl。
③醇的取代反应
CH3—CH2—OH+HBreq \(――→,\s\up7(△)) CH3—CH2—Br+H2O 。
(3)羟基
①烯烃与水的加成反应
CH2==CH2+H2Oeq \(――→,\s\up11(催化剂),\s\d4(△)) CH3CH2OH 。
②卤代烃的水解反应
CH3—CH2—Br+NaOHeq \(――→,\s\up11(水),\s\d4(△)) CH3CH2—OH+NaBr 。
③醛或酮的还原反应
CH3CHO+H2eq \(――→,\s\up11(Ni),\s\d4(△)) CH3CH2OH ;
+H2eq \(――→,\s\up11(Ni),\s\d4(△))。
④酯的水解反应
CH3COOCH2CH3+H2Oeq \(,\s\up11(稀硫酸),\s\d4(△)) CH3COOH+CH3CH2OH ;
CH3COOCH2CH3+NaOHeq \(――→,\s\up7(△)) CH3COONa+CH3CH2OH 。
(4)官能团的转化
熟悉烃及其衍生物之间的相互转化是有机合成的基础。
二、有机合成路线的设计与实施
(一)有机合成路线的设计
1、常见有机物的转化关系
若以乙醇为原料合成乙二酸(HOOC—COOH),则依次发生反应的类型是 消去反应 、 加成反应 、 水解(或取代)反应 、 氧化反应 、 氧化反应 。
2、常见的有机合成路线
(1)一元化合物合成路线
eq \x(R—CH==CH2)eq \(――→,\s\up7(HX))eq \x(卤代烃)eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))eq \x(一元醇)eq \(――→,\s\up7([O]))eq \x(一元醛)eq \(――→,\s\up7([O]))eq \x(一元羧酸)eq \(―――――――→,\s\up7(醇、浓H2SO4,△))eq \x(酯)
(2)二元化合物合成路线
eq \x(CH2==CH2)eq \(――→,\s\up7(X2))eq \x(CH2X—CH2X)eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))eq \x(HOCH2—CH2OH)eq \(――→,\s\up7([O]))eq \x(OHC—CHO)eq \(――→,\s\up7([O]))eq \x(HOOC—COOH)eq \(―――→,\s\up7(一定条件))eq \x(链酯、环酯、聚酯)
(3)芳香族化合物合成路线
①eq \(――→,\s\up11(Cl2),\s\d4(FeCl3))eq \(―――――――→,\s\up11(NaOH水溶液、H+),\s\d4(△))
②eq \(――→,\s\up11(Cl2),\s\d4(光照))eq \(―――――→,\s\up11(NaOH水溶液),\s\d4(△))
eq \(―――――――→,\s\up7(醇,浓硫酸,△))芳香酯
3、有机合成中常见官能团的保护
(1)酚羟基的保护:因酚羟基易被 氧化 ,所以在氧化其他基团前可以先使其与NaOH溶液反应,把—OH变为 —ONa (或使其与ICH3反应,把—OH变为—OCH3)将其保护起来,待氧化后再酸化将其转变为 —OH 。
(2)碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用 消去反应 转变为碳碳双键。
(3)氨基(—NH2)的保护:如在对硝基甲苯eq \(――→,\s\up7(合成))对氨基苯甲酸的过程中应先把—CH3氧化成—COOH之后,再把—NO2还原为—NH2。防止当KMnO4氧化—CH3时,—NH2(具有还原性)也被氧化。
(二)逆合成分析法
1、逆合成分析法
从目标化合物的组成、结构、性质入手,找出合成所需的直接或间接的 中间体 ,逐步推向已知原料,其合成示意图为
2、逆合成分析法应用例析
由“逆合成分析法”分析由乙烯合成草酸二乙酯
(1)具体步骤如下:
根据以上逆合成分析,可以确定合成草酸二乙酯的有机基础原料为乙烯(CH2==CH2),通过六步反应进行合成,写出反应的化学方程式:
①CH2==CH2+Cl2eq \(――→,\s\up7(催化剂))
②+2NaOHeq \(――→,\s\up11(H2O),\s\d4(△))+2NaCl
③
④
⑤CH2==CH2+H2Oeq \(――→,\s\up7(催化剂)) CH3CH2OH
⑥+2CH3CH2OHeq \(,\s\up11(浓硫酸),\s\d4(△))+2H2O
(2)根据以上逆合成分析,合成步骤如下:
名称
结构简式
eq \f(液态时密度,g·cm-3)
沸点/℃
氯甲烷
CH3Cl
0.916
-24
氯乙烷
CH3CH2Cl
0.898
12
1-氯丙烷
CH3CH2CH2Cl
0.890
46
1-氯丁烷
CH3CH2CH2CH2Cl
0.886
78
1-氯戊烷
CH3CH2CH2CH2CH2Cl
0.882
108
实验装置
实验现象
①中溶液 分层
②中有机层厚度减小,直至 消失
④中有 淡黄色沉淀 生成
实验解释
溴乙烷与NaOH溶液共热产生了 Br-
实验装置
实验现象
反应产生的气体经水洗后,使酸性KMnO4溶液 褪色
生成的气体分子中含有 碳碳不饱和键
名称
结构简式
性质
用途
甲醇
CH3OH
无色透明、易挥发的液体;能与水及多种有机溶剂混溶;有毒、误服少量(10 mL)可致人失明,多量(30 mL)可致人死亡
化工原料、燃料
乙二醇
无色、黏稠的液体,有甜味、能与水混溶,能显著降低水的凝固点
发动机防冻液的主要化学成分,也是合成涤纶等高分子化合物的主要原料
丙三醇(甘油)
无色、黏稠、具有甜味的液体,能与水以任意比例混溶,具有很强的吸水能力
吸水能力——配制印泥、化妆品;凝固点低——作防冻剂;三硝酸甘油酯俗称硝化甘油——作炸药等
实验步骤
实验现象
得到 浑浊 液体
液体变 澄清
液体变 浑浊
类别
苯
苯酚
取代反应
溴的状态
液溴
饱和溴水
条件
催化剂
无催化剂
产物
特点
苯酚与溴的 取代 反应比苯易进行
原因
酚羟基对苯环的影响使苯环上的邻、对位氢原子变得活泼,易被取代
类别
脂肪醇
芳香醇
酚
实例
CH3CH2OH
官能团
醇羟基(—OH)
醇羟基(—OH)
酚羟基(—OH)
结构特点
—OH与 链烃基 相连
—OH与 苯环侧链 上的碳原子相连
—OH与 苯环 直接相连
主要化学性质
(1)与 钠 反应;(2)取代 反应;(3)部分能发生 消去 反应;(4)氧化反应;(5)酯化反应;(6)部分能发生加成反应
(1)弱酸性 ;(2)取代反应 ;(3)显色反应 ;(4)加成反应;(5)与钠反应;(6)氧化反应
特性
灼热的铜丝插入醇中,有刺激性气味物质(醛或酮)生成
遇FeCl3溶液发生 显色 反应
实验操作
实验现象
向A中滴加氨水,现象为先产生 白色沉淀 后变 澄清 ,加入乙醛,水浴加热一段时间后,试管内壁出现一层 光亮的银镜
有关反应的化学方程式
A中:AgNO3+NH3·H2O===AgOH↓( 白色 )+NH4NO3,
AgOH+2NH3·H2O===[Ag(NH3)2]OH+2H2O;
C中:CH3CHO+2[Ag(NH3)2]OHeq \(――→,\s\up7(△))2Ag↓+CH3COONH4+3NH3+H2O
实验操作
实验现象
A中溶液出现 蓝色絮状 沉淀,滴入乙醛,加热至沸腾后,C中溶液有 砖红色 沉淀产生
有关反应的化学方程式
A中:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4;
C中:CH3CHO+2Cu(OH)2+NaOHeq \(――→,\s\up7(△))CH3COONa+Cu2O↓+3H2O
醛
酮
官能团
醛基:
酮羰基:
官能团位置
碳链末端(最简单的醛是甲醛)
碳链中间(最简单的酮是丙酮)
结构通式
(R为烃基或氢原子)
(R、R′均为烃基)
联系
碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为 同分异构体
典型羧酸
物理性质
主要用途
甲酸(蚁酸)HCOOH
无色、有 刺激性 气味的液体,有 腐蚀 性,能与 水、乙醇等互溶
工业上可用作还原剂,是合成医药、农药和染料等的原料
苯甲酸(安息香酸)
无 色晶体,易升华,微溶于 水 ,易溶于 乙醇
用于合成香料、药物等,其钠盐是常用的食品 防腐剂
乙二酸(草酸)
HOOC—COOH
无色 晶体 ,通常含有两分子结晶水,可溶于 水 和 乙醇
化学分析中常用的 还原剂 ,也是重要的化工原料
实验装置
B装置现象及解释
有 无色气体 产生,说明酸性:乙酸 > 碳酸;
方程式:2CH3COOH+Na2CO3―→2CH3COONa+CO2↑+H2O
D装置的现象及解释
溶液 变浑浊 ,说明酸性:碳酸 > 苯酚
方程式:+CO2+H2O―→+NaHCO3
C装置的作用
除去B中挥发的 乙酸
实验结论
酸性:乙酸 > 碳酸 > 苯酚
名称
乙醇
苯酚
乙酸
结构简式
CH3CH2OH
CH3COOH
羟基氢原子的活泼性
不能电离
能电离
能电离
eq \(――――――→,\s\up7(活泼性逐渐增强))
酸性
中性
极弱酸性
弱酸性
与Na反应
反应放出H2
反应放出H2
反应放出H2
与NaOH反应
不反应
反应
反应
与Na2CO3反应
不反应
反应
反应
与NaHCO3反应
不反应
不反应
反应
酯化反应
酯的水解反应
反应关系
CH3COOH+C2H5OHeq \(,\s\up26(△),\s\d9(催化剂)) CH3COOC2H5+H2O
催化剂
浓硫酸
稀硫酸或NaOH溶液
催化剂的其他作用
吸水、提高CH3COOH和C2H5OH的转化率
NaOH中和酯水解生成的羧酸、提高酯的水解率
加热方式
酒精灯火焰加热
热水浴加热
反应类型
酯化反应、取代反应
水解反应、取代反应
名称
饱和脂肪酸
不饱和脂肪酸
软脂酸
硬脂酸
油酸
亚油酸
结构简式
C15H31COOH
C17H35COOH
C17H33COOH
C17H31COOH
物质
油脂
矿物油
脂肪
油
组成
多种高级脂肪酸的甘油酯
多种烃(石油及其分馏产品)
含饱和烃基多
含不饱和烃基多
性质
固态或半固态
液态
液态
具有酯的性质,能水解,有的油脂兼有烯烃的性质
具有烃的性质,不能水解
鉴别
加含酚酞的NaOH溶液,加热,红色变 浅 ,不再分层
加含酚酞的NaOH溶液,加热, 无变化
用途
营养素可食用,化工原料如制肥皂、甘油
燃料、化工原料
相关学案
这是一份化学必背知识手册分类第四章 生物大分子-【知识手册】(人教版选择性必修3)(教师版)15,共10页。学案主要包含了糖类的组成和分类,蛋白质等内容,欢迎下载使用。
这是一份化学必背知识手册分类第二章 分子结构与性质-【知识手册】(人教版选择性必修2)(教师版)5,共10页。学案主要包含了共价键,键参数——键能,价层电子对互斥模型,杂化轨道理论简介等内容,欢迎下载使用。
这是一份化学必背知识手册分类第二章 烃-【知识手册】(人教版选择性必修3)(教师版)6,共10页。学案主要包含了烷烃的结构和性质,烷烃的命名等内容,欢迎下载使用。








