
化学必背知识手册分类第三章 水溶液中的离子反应与平衡 -【知识手册】(人教版选择性必修1)(教师版)9
展开
这是一份化学必背知识手册分类第三章 水溶液中的离子反应与平衡 -【知识手册】(人教版选择性必修1)(教师版)9,共14页。学案主要包含了强电解质和弱电解质,弱电解质的电离平衡,电离平衡常数,溶液中的守恒关系等内容,欢迎下载使用。
一、强电解质和弱电解质
1、电解质:在水溶液中或 熔融状态下 能导电的化合物。
2、非电解质:在水溶液中和 熔融状态下 均以分子形式存在,因而不能导电的化合物。
3、强电解质和弱电解质
(1)实验探究盐酸和醋酸的电离程度
(2)强电解质与弱电解质的比较
二、弱电解质的电离平衡
1、电离平衡状态
(1)概念:在一定条件(如温度、浓度)下,弱电解质分子 电离成离子的速率 与 离子结合成弱电解质分子的速率 相等,溶液中各分子和离子的 浓度 都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程
2、电离方程式的书写
(1)强电解质:完全电离,在写电离方程式时,用“===”。
(2)弱电解质:部分电离,在写电离方程式时,用“⇄”。
3、电离平衡的影响因素
(1)温度:弱电解质的电离一般是 吸热 过程,升高温度使电离平衡向 电离 的方向移动,电离程度 增大 。
(2)浓度:在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率 越小 ,电离程度 越大 。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度 减小 。
(4)化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向 电离 方向移动。
三、电离平衡常数
1、概念:在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的 各种离子浓度的乘积 ,与溶液中 未电离分子的浓度 之比是一个常数,简称电离常数,用K表示。
2、电离平衡常数的表示方法
AB=A++B- K=eq \f(cA+·cB-,cAB)
3、弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越 大 ,酸(或碱)性越 强 。
4.电离常数的影响因素
(1)内因:同一温度下,不同的弱电解质的电离常数 不同 ,说明电离常数首先由物质的 本性 所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与 温度 有关,由于电离为 吸热 过程,所以电离平衡常数随 温度升高 而增大。
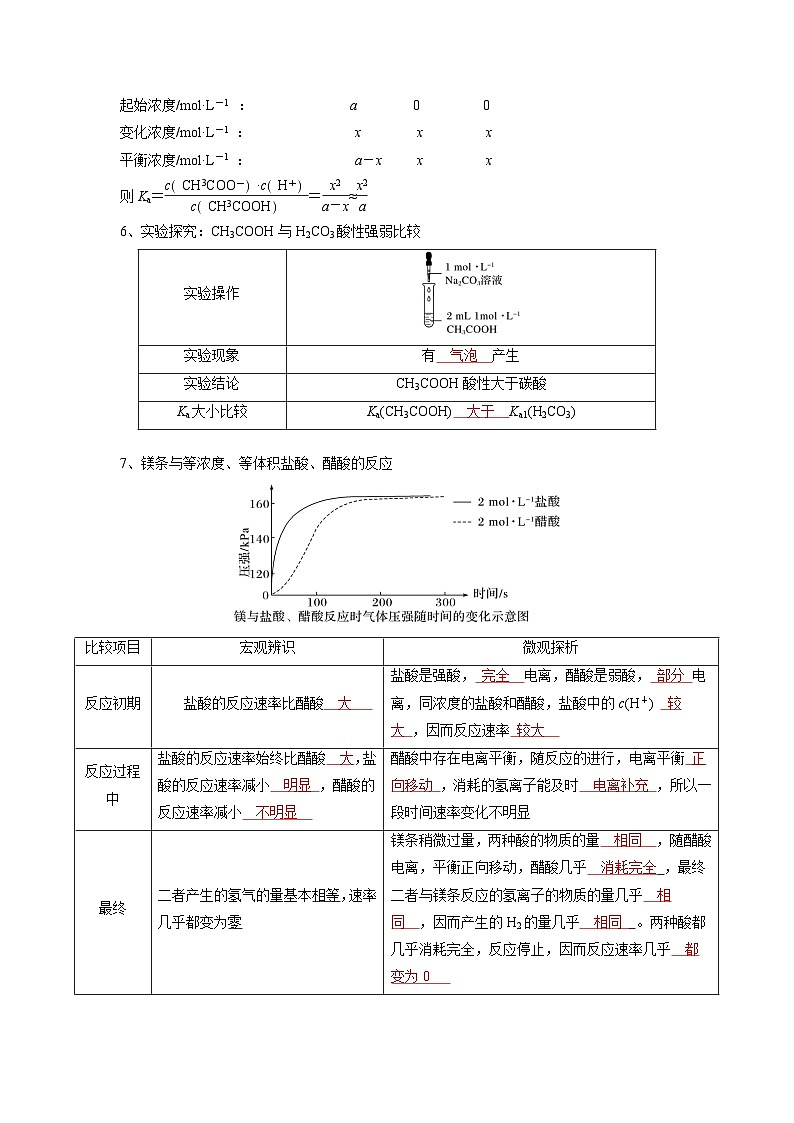
5、电离常数的计算——三段式法
例:25 ℃ a ml·L-1的CH3COOH
CH3COOH ⇄CH3COO-+H+
起始浓度/ml·L-1 : a 0 0
变化浓度/ml·L-1 : x x x
平衡浓度/ml·L-1 : a-x x x
则Ka=eq \f(cCH3COO-·cH+,cCH3COOH)=eq \f(x2,a-x)≈eq \f(x2,a)
6、实验探究:CH3COOH与H2CO3酸性强弱比较
7、镁条与等浓度、等体积盐酸、醋酸的反应
第二节 水的电离和溶液的pH
一、水的电离
1、水的电离
(1)水是一种极弱的电解质。
(2)水的电离方程式为H2O+H2O ⇄H3O++OH-,简写为H2O ⇄H++OH-。
(3)水的电离平衡常数K电离=eq \f(cH+·cOH-,cH2O)。
2、水的离子积常数
(1)含义:因为水的浓度可看作常数,所以水中的 c(H+)·c(OH-) 可看作常数,称为水的 离子积常数 ,简称水的离子积,用KW表示。
(2)表达式与数值:表达式KW= c(H+)·c(OH-) ,室温时,KW=1.0×10-14。
(3)影响因素:KW只受温度影响,由于水的电离是 吸热 过程,温度升高,KW增大。
3、外界条件对水的电离平衡的影响
分析下列条件的改变对水的电离平衡H2O ⇄H++OH- ΔH>0的影响,并填写下表:
二、溶液的酸碱性与pH
1.25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
2、溶液的酸碱性与溶液中c(H+)、c(OH-)的关系
任何水溶液中都有H+和OH-。
3.溶液的pH与c(H+)及酸碱性的关系
特别提醒 pH计算公式中c(H+):强酸溶液:c(H+)=n·c(HnA) ;若强碱溶液:c(H+)=eq \f(Kw,cOH-)=eq \f(Kw,n·c[BOHn])。
4、溶液酸碱性的测定方法
(1)利用pH试纸测定。使用pH试纸的正确操作为取一小块pH试纸于干燥洁净的 玻璃片或表面皿上 ,用干燥洁净的玻璃棒蘸取试液点在试纸上,当试纸颜色变化稳定后迅速与 标准比色卡 对照,读出pH。
①广泛pH试纸:其pH范围是 1~14 (最常用),可以识别的pH差约为 1 。
②精密pH试纸:可判别0.2或0.3的pH差值。
③专用pH试纸:用于酸性、中性或碱性溶液的专用 pH试纸 。
(2)用pH计测量。
pH计也叫 酸度计 ,该仪器可精密测量溶液的pH。其量程为 0~14 。
5、pH的应用
pH在医疗、生活、环保、农业生产和 科学实验 中都有重要的应用。溶液pH的控制常常是影响实验结果或 产品质量、产量 的一个关键因素。
6、酸碱溶液稀释时pH的变化图像
(1)pH相等的酸或碱溶液稀释后溶液pH的变化示意图
(2)c相等的酸或碱溶液稀释后溶液pH的变化示意图
可以看出无论是c相等还是pH相等,加水稀释相同倍数pH变化大的都是 强酸或强碱 。
7、酸碱溶液稀释时pH的变化
三、酸碱中和滴定实验
1、概念和原理
(1)概念:依据中和反应,用已知浓度的 酸(或碱) 来测定未知浓度的 碱(或酸) 的方法。
(2)原理:在中和反应中,酸提供的H+与碱提供的OH-之间的 物质的量 相等 。
即: c(H+)·V酸=c(OH-)·V碱 ,则c(H+)=eq \f( cOH-·V碱,V酸)或c(OH-)=eq \f(cH+·V酸,V碱)。
2、主要仪器使用
(1)仪器:滴定管,铁架台,滴定管夹, 锥形瓶 , 烧杯 。
仪器a是 酸式滴定管 ,仪器b是 碱式滴定管 。精密度: 0.01 mL。
(2)滴定管的使用方法
①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:在加入溶液之前,洁净的滴定管要用所要盛装的溶液 润洗 2~3遍。
③加入溶液:分别将溶液加入到相应滴定管中,使液面位于滴定管 0 刻度线以上。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满溶液,然后调节滴定管液面使其处于 “0”刻度 或 “0”刻度以下的某一刻度 。准确读取数值并记录。
3、主要试剂
(1)待测液;(2)标准液;(3)指示剂(一般用 酚酞或甲基橙 ,一般不用石蕊,颜色改变不明显)。
4、指示剂的选择
(1)原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)酸碱指示剂法(只能测定溶液的pH范围)
5、滴定操作
(1)滴速:先快后慢,当接近终点时,应一滴一摇,甚至半滴一摇,利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
(2)终点的判断:滴入最后一滴标准液,指示剂变色,且在 半分钟 内不变回原色,视为 滴定 终点。
6、数据处理
为减少实验误差,重复实验 2~3 次,求出所用标准溶液体积的 平均值 ,然后再计算待测液的 物质的量 浓度。
7、常见的误差分析
第三节 盐类的水解
一、盐类的水解
1、探究盐溶液的酸碱性
2、盐溶液呈现不同酸碱性的原因
理论解释:溶液中不生成 弱电解质 ,水的电离平衡未受影响,溶液中c(H+)=c(OH-),溶液呈 中 性。
3、盐类的水解
(1)概念:在溶液中,由盐电离出来的弱离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
(2)实质:生成弱酸或弱碱,使水的电离平衡被破坏而建立起新的平衡。
(3)特征:①一般是可逆反应,在 一定 条件下达到化学平衡;②盐类水解反应是 中和 反应的逆反应。
③盐类水解是 吸热 反应。
二、影响盐类水解的主要因素
1、反应物本身性质的影响
盐类水解程度的大小主要由 盐的性质 所决定的,生成盐的弱酸(或弱碱)越难 电离 (电离常数越小),盐的水解程度 越大 ,即越弱越水解。
2、实验探究反应条件对盐类水解程度的影响
已知FeCl3发生水解反应的离子方程式:Fe3++3H2O ⇄Fe(OH)3+3H+,根据实验操作填写下表:
3、盐的水解常数
(1)表达式
以CH3COONa为例:CH3COO-+H2O ⇄CH3COOH+OH-
Kh=eq \f(cCH3COOH·cOH-,cCH3COO-),只与 温度 有关。
(2)与对应弱酸电离常数的关系
Ka=eq \f(cH+·cCH3COO-,cCH3COOH) 所以,Kh·Ka=Kw或Kh=eq \f(Kw,Ka)。
弱酸或弱碱的电离常数 越小 (越弱),其生成的盐水解的程度就 越大 。
三、盐类水解的应用
1、在化学实验中的应用
2、在生产生活中的应用
四、溶液中的守恒关系
1、电荷守恒:电解质溶液中 阳离子 所带的电荷总数与 阴离子 所带的电荷总数 相等 。即电荷守恒,溶液呈 电中性 。
2、元素质量守恒:
在电解质溶液中,由于某些离子发生水解或电离, 离子 的存在形式发生了变化,就该 离子 所含的某种元素来说,其质量在反应前后是 守恒 的,即 元素质量 守恒。
如:Na2CO3溶液中:
①eq \f(nNa+,nCO\\al(2-,3))=eq \f(2,1),即n(Na+)=2c(COeq \\al(2-,3)),COeq \\al(2-,3)在水中部分会水解成HCOeq \\al(-,3)、H2CO3,共三种含碳元素的存在形式。
②c(Na+)=2[c(COeq \\al(2-,3))+c(HCOeq \\al(-,3))+c(H2CO3)]。
3、质子守恒
方法一:可以由电荷守恒与元素质量守恒推导出来。
如Na2CO3中将电荷守恒和元素质量守恒中的金属阳离子消去得c(OH-)=c(H+)+c(HCOeq \\al(-,3))+2c(H2CO3)。
方法二:质子守恒是依据水的电离平衡:H2O=H++OH-,水电离产生的H+和OH-的物质的量总是相等的,无论在溶液中由水电离出的H+和OH-以什么形式存在。
如:Na2CO3溶液中即:c(OH-)=2c(H2CO3)+c(HCOeq \\al(-,3))+c(H3O+)或c(OH-)=2c(H2CO3)+c(HCOeq \\al(-,3))+c(H+)。
第四节 沉淀溶解平衡
一、难溶电解质的沉淀溶解平衡
1、25 ℃时,溶解性与溶解度的关系
2、难溶电解质的沉淀溶解平衡
(1)沉淀溶解平衡的建立
(2)沉淀溶解平衡方程式
以AgCl沉淀溶解平衡为例:AgCl(s)===Ag+(aq)+Cl-(aq)。
(3)沉淀、溶解之间这种动态平衡也决定了Ag+与Cl-的反应 不能完全 进行到底。一般情况下,当溶液中剩余离子的浓度小于 1×10-5 ml·L-1 时,化学上通常认为生成沉淀的反应进行 完全 了。
3、难溶电解质沉淀溶解平衡的影响因素
已知沉淀溶解平衡:Mg(OH)2(s)===Mg2+(aq)+2OH-(aq)
Q:离子积对于AmBn(s)===mAn+(aq)+nBm-(aq)任意时刻Q=cm(An+)·cn(Bm-)。
(1)Q>Ksp,溶液过饱和,有 沉淀 析出,直至溶液 饱和 ,达到新的平衡。
(2)Q=Ksp,溶液饱和,沉淀与溶解处于 平衡状态 。
(3)Qc(OH-)
c(H+)> 1×10-7 ml·L-1
中性溶液
c(H+)=c(OH-)
c(H+)= 1×10-7 ml·L-1
碱性溶液
c(H+)7
pH>7
pH>7
pHHY>HZ
配制或贮存易水解的盐溶液
配制CuSO4溶液时,加入少量 H2SO4 ,抑制Cu2+水解;贮存Na2CO3溶液不能用 磨口 玻璃塞
胶体的制取
制取Fe(OH)3胶体的离子反应:Fe3++3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3H+
制备无水盐
将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的气流中加热蒸干
判断离子是否共存
Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2);Fe3+与HCOeq \\al(-,3)、COeq \\al(2-,3)、AlOeq \\al(-,2);NHeq \\al(+,4)与AlOeq \\al(-,2)、SiOeq \\al(2-,3)因相互促进水解强烈而 不能大量 共存。
判断中和反应至中性的试剂用量
如NH3·H2O与HCl反应至中性, NH3·H2O 过量,CH3COOH与NaOH反应至中性时 CH3COOH 过量。
制备无机化合物
如用TiCl4制备TiO2,其反应的化学方程式为:
TiCl4+(x+2)H2O===TiO2·xH2O↓+4HCl
加入大量的水,同时加热,促使水解趋于完全。
泡沫灭火器原理
泡沫灭火器中药品成分为NaHCO3与Al2(SO4)3,发生的反应为:
Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑
作净水剂
明矾可作净水剂,原理为Al3++3H2O===Al(OH)3(胶体)+3H+
化肥的使用
铵态氮肥与草木灰不得混合施用
除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂,原理为:
NHeq \\al(+,4)+H2O===NH3·H2O+H+、Zn2++2H2O===Zn(OH)2+2H+
热纯碱去污能力强
加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强
溶解性
易溶
可溶
微溶
难溶
溶解度
>10 g
1~10 g
0.01~1 g
相关学案
这是一份化学必背知识手册分类第二章 化学反应速率与化学平衡-【知识手册】(人教版选择性必修1)(教师版)4,共9页。学案主要包含了化学反应速率,影响化学反应速率的因素,活化能等内容,欢迎下载使用。
这是一份化学必背知识手册分类第二章 烃-【知识手册】(人教版选择性必修3)(教师版)6,共10页。学案主要包含了烷烃的结构和性质,烷烃的命名等内容,欢迎下载使用。
这是一份化学必背知识手册分类第三章 铁 金属材料 -【知识手册】(人教版必修第一册)(教师版)10,共7页。学案主要包含了铁的单质,铁的重要化合物,Fe2+等内容,欢迎下载使用。








