




2023-2024学年江苏省盐城市响水县清源高级中学高一下学期3月学情分析考试(必修)化学试题
展开第I卷(60分)
一、选择题(每题3分,共60分,每小题只有1个选项符合题意)
1. 下列反应中,既属于氧化还原反应同时又是吸热反应的是
A. Ba(OH)2·8H2O与NH4Cl反应
B. 铝与稀盐酸
C. 灼热的炭与CO2反应
D. 甲烷与O2的燃烧反应
【答案】C
【解析】
【详解】A.Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但该反应中各元素的化合价没有发生变化,不属于氧化还原反应,故A不选;
B.铝与稀盐酸反应为放热反应,且该反应中Al元素的化合价升高,H元素的化合价降低,属于氧化还原反应,故B不选;
C.灼热的炭与CO2反应为吸热反应,且该反应中碳元素的化合价发生变化,属于氧化还原反应,故C选;
D.反应中C和O元素的化合价发生变化,为氧化还原反应,物质的燃烧属于放热反应,故D不选;
答案选C。
【点睛】熟悉常见的吸热反应是解题的关键。常见的吸热反应包括:大部分分解反应,铵盐与碱的反应,以炭、氢气、CO为还原剂的氧化还原反应(不包括燃烧),水解反应等。
2. 下列化学电池不易造成环境污染的是
A. 氢氧燃料电池B. 锌锰电池C. 镍镉电池D. 铅蓄电池
【答案】A
【解析】
【分析】
【详解】A.氢氧燃料电池生成物为水,无污染,故A正确;
B.锌锰电池中含有重金属锰,对环境有污染,故B错误;
C.镍镉电池中含有重金属镍镉,对环境有污染,故C错误;
D.铅蓄电池中含有铅元素,对环境有污染,故D错误.
故选A,
3. 下列反应不可用于设计原电池的是
A. NaOH+HCl=NaCl+H2OB. 2CH3OH+3O22CO2+4H2O
C. Zn+2HCl=ZnCl2+H2↑D. 4Al+3O2+6H2O=4Al(OH)3
【答案】A
【解析】
【分析】
【详解】A、氢氧化钠和盐酸的反应不是氧化还原反应,所以不能设计成原电池,故A正确;
B、甲醇的燃烧属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故B错误;
C、锌和盐酸的反应属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故C错误;
D、铝和氧气的反应属于自发的氧化还原反应且该反应放热,所以能设计成原电池,故D错误;
故选A。
【点睛】本题考查了原电池的设计,明确原电池的构成条件及反应必须是放热反应是解本题的关键。构成原电池的条件是:①有两个活泼性不同的电极;②将电极插入电解质溶液中;③两电极间构成闭合回路;④能自发的进行氧化还原反应;所以设计原电池必须符合构成原电池的条件,且该反应必须是放热反应。
4. 在2L密闭容器中存在反应A(g)+3B(g)=2C(g)+D(g),A的物质的量在10s内从4.0ml变成1.0ml,下列说法正确的是
A. v(A)=0.3ml·L-1·s-1B. v(B)=0.6ml·L-1·s-1
C. v(C)=0.3ml·L-1·s-1D. v(D)=0.4ml·L-1·s-1
【答案】C
【解析】
【详解】A的物质的量在10s内从4.0ml变成1.0ml,v(A)==0.15ml·L-1·s-1,根据速率之比等于化学计量数之比可知:v(B)= 3v(A)= 0.45ml·L-1·s-1,v(C)= 2v(A)= 0.3ml·L-1·s-1,v(D)= v(A)= 0.15ml·L-1·s-1,故C正确;
故选:C。
5. 钢铁发生析氢腐蚀时,正极上发生的反应是
A. 2H++2e-=H2↑B. 2H2O+O2+4e-=4OH-
C. Fe-3e-=Fe3+D. 4OH--4e-=O2↑+2H2O
【答案】A
【解析】
【详解】钢铁发生析氢腐蚀时,负极Fe失电子生成亚铁离子,电极反应为:Fe-2e-=Fe2+,正极氢离子得电子生成氢气,电极反应为:2H++2e-=H2↑,故A正确;
故选:A。
6. 有关反应(N2+3H22NH3)的说法正确的是
A. 升高温度可减慢反应速率B. 使用催化剂可提高反应速率
C. 达到平衡时,v(正)=v(逆)=0D. 达到平衡时H2转化率可达100%
【答案】B
【解析】
【详解】A.升高温度反应速率加快,故A错误;
B.使用催化剂可以降低反应活化能,从而加快反应速率,故B正确;
C.化学平衡为动态平衡,平衡时v(正)=v(逆)≠0,故C错误;
D.该反应为可逆反应,反应不能进行到底,因此达平衡时,H2转化率小于100%,故D错误;
故选:B。
7. 下列四种X溶液,均能跟盐酸反应,其中反应最快的是
A. 10℃ 20 mL 3ml/L的X溶液B. 20℃ 30 mL 2mlL的X溶液
C. 20℃ 10 mL 4ml/L的X溶液D. 10℃ 10 mL 2ml/L的X溶液
【答案】C
【解析】
【详解】化学反应速率与反应的温度,反应物浓度有关;温度越高,浓度越高,反应速率越快,与反应物的体积无关。对比各项的反应温度和反应物的浓度,可知C项中反应温度最高,且X溶液浓度最大,所以C项所在溶液与盐酸反应速率最快,故C项正确;
故选C。
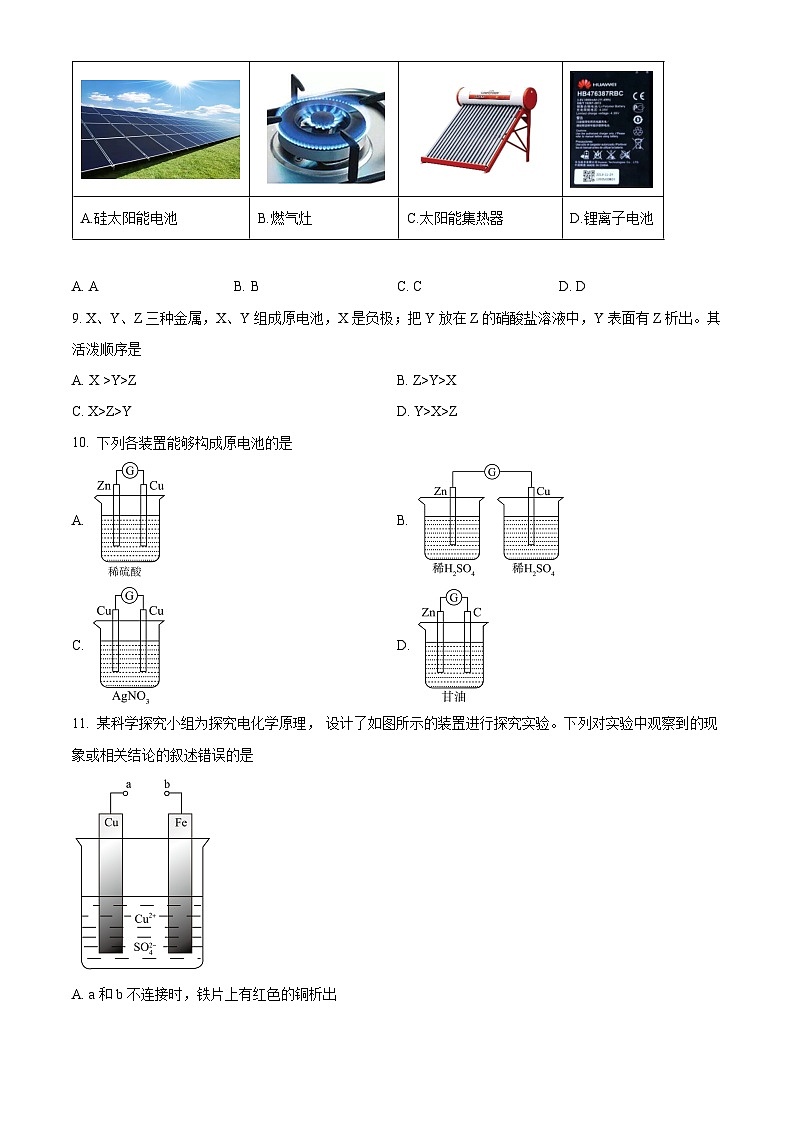
8. 下列设备工作时,把化学能转化为电能是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.硅太阳能电池是将太阳能转化为电能,A错误;
B.燃气灶是将化学能转化为热能和光能,B错误;
C.太阳能集热器将太阳能转化为热能,C错误;
D.锂离子电池是将化学能转化为电能,D正确;
答案选D。
9. X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是
A. X >Y>ZB. Z>Y>X
C. X>Z>YD. Y>X>Z
【答案】A
【解析】
【详解】X、Y组成原电池,X是负极,则X比Y活泼;把Y放在Z的硝酸盐溶液中,Y表面有Z析出,则Y比Z活泼;活泼顺序为X>Y>Z,答案选A。
10. 下列各装置能够构成原电池的是
A. B.
C. D.
【答案】A
【解析】
【分析】原电池构成条件:活性不同的两个电极、电解质溶液、形成闭合回路、自发的氧化还原反应。
【详解】A.具备活性不同的两个电极、电解质溶液、形成闭合回路、自发的氧化还原反应,能形成原电池,A正确;
B.没有形成闭合回路,不能构成原电池,B错误;
C.没有活动性不同的电极,不能构成原电池,C错误;
D.没有电解质溶液,不能形成闭合回路,所以不能构成原电池,D错误;
答案选A。
11. 某科学探究小组为探究电化学原理, 设计了如图所示的装置进行探究实验。下列对实验中观察到的现象或相关结论的叙述错误的是
A. a和b不连接时,铁片上有红色的铜析出
B. a和b用导线连接时, 铜片为负极
C. 无论a和b是否连接,反应的本质相同,铁片均会被氧化,溶液中均有Fe2+生成
D. a和b用导线连接时,溶液中的Cu2+应向铜电极移动且能更快地在铜电极上析出铜
【答案】B
【解析】
【分析】由图可知,当ab连接时,铁较活泼,铁失去电子,发生氧化反应,作负极,此时铜作正极;但是当两者不连接时,不形成原电池,以此解题。
【详解】A.a和b不连接时,没有形成闭合回路,没有构成原电池,铁直接把铜置换出来,A正确;
B.导线连接后,构成原电池,铁比铜活泼,铁作负极,发生的反应为Fe-2e-=Fe2+,B错误;
C.无论a和b是否连接,反应的本质相同均为Fe+Cu2+=Fe2++Cu,铁片均会被氧化,溶液中均有Fe2+生成,C正确;
D.a和b用导线连接时,构成原电池,铜电极为正极,阳离子流向负极,且原电池可以加快反应速率,D正确;
故选B。
12. N2H4是一种高效清洁的火箭燃料,0.25 ml N2H4(g)完全燃烧生成N2和气态水放出133.5kJ热量,则下列热化学方程式中正确的是
A. 1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g) △H=+267 kJ·ml-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-133.5 kJ·ml-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534 kJ·ml-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ·ml-1
【答案】D
【解析】
【详解】0.25 ml N2H4(g)完全燃烧生成N2和气态水放出133.5kJ热量,则1 ml N2H4(g)完全燃烧生成N2和气态水放出133.5kJ×4=534kJ热量,所以热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ·ml-1。答案选D。
13. 关于吸热反应和放热反应,下列说法中错误的是
A. 放热反应都不需要加热就能够发生
B. 化学反应中能量变化,除了热量外,还可以是光能、电能等
C. 化学反应过程中的能量变化,也服从能量守恒定律
D. 反应物的总能量高于生成物的总能量时,发生放热反应
【答案】A
【解析】
【详解】A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应是放热反应,但需要加热,故A错误;
B.化学反应中的能量变化除了热量外还可以是光能、电能等,如燃烧发光、放热,原电池还可以转换成电能,故B正确;
C.化学反应过程中的能量变化服从能量守恒定律,质量变化服从质量守恒定律,故C正确;
D.反应物总能量高于生成物的总能量时,为放热反应,释放出能量,故D正确;
故选:A。
14. 化学反应A2+B2=2AB的能量变化如图所示,则下列说法错误的是
A. 该反应是释放能量的反应
B. 1mlA—A键和1mlB—B键断裂需要吸收xkJ的能量
C. 2mlA—B键形成能放出ykJ的能量
D. 1mlA2 的能量高于2mlAB的能量
【答案】D
【解析】
【详解】A.由图示可知,生成物总能量小于反应物总能量,该反应是放出能量的反应,A正确;
B.化学键断裂要吸收能量,结合图示,1mlA-A键和1mlB-B键断裂需要吸收xkJ的能量,B正确;
C.形成化学键要释放能量,结合图示,2mlA-B键形成能放出ykJ的能量,C正确;
D.根据图示,1mlA2和1mlB2的总能量高于2mlAB的总能量,D错误;
答案选D。
15. 通常状况下,氮气的性质不活泼的原因是
A. 氮分子中有三个共价键,键能很大B. 氮元素非金属性很弱
C. 氮分子中氮元素化合价为零D. 固态氮属于分子晶体
【答案】A
【解析】
【详解】氮气的性质不活泼是因为含有氮氮三键,氮氮三键非常稳定,断裂时需要吸收大量的能量,所以氮气不活泼,性质非常稳定, 故选:A。
16. 图像法是研究化学反应的一种常用方法。已知化学反应A2(g)+B2(g)=2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是
A. 每生成2mlAB(g)时吸收bkJ能量
B 该反应热ΔH=+(a-b)kJ·ml-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1mlA-A键和1mlB-B键时放出akJ能量
【答案】B
【解析】
【分析】据图像可知,反应物的总能量小于生成物的总能量,反应为吸热反应。
【详解】A.由图中信息可知,每生成2ml AB(g)吸收的热量应为(a-b)kJ,A错误;
B.根据分析,反应吸热,焓变大于0,反应热=反应物能量总和-生成物能量总和=+(a-b) kJ/ml,B正确;
C.由图像可知,反应吸热,反应物总能量小于生成物总能量,C错误;
D.断键应吸收能量,断裂1mlA-A和1mlB-B键,吸收akJ能量,D错误;
故选:B。
17. 如图为研究金属腐蚀的实验。下列相关说法中正确的是
A. 食盐水中有气泡逸出B. 铁表面的反应为Fe-3e-=Fe3+
C. 红色首先在食盐水滴的中心出现D. 该实验研究的是金属的电化学腐蚀
【答案】D
【解析】
【详解】A.食盐水显中性,因此该实验属于钢铁的吸氧腐蚀,负极上发生的电极反应式为Fe-2e-=Fe2+,正极上发生的电极反应式为O2+2H2O+4e-=4OH-,所以食盐水中没有气泡逸出,故A错误;
B.铁是负极,铁表面的反应为Fe-2e-=Fe2+,故B错误;
C.食盐水周围液体少,氧气量多,所以红色首先在食盐水滴的周围出现,故C错误;
D.该实验是在中性条件下发生的腐蚀,为吸氧腐蚀,故D正确;
故选:D。
18. 根据下图提供的信息,下列所得结论正确的是
A. 该反应的∆H<0
B. 生成物比反应物稳定
C. 该图可以表示石灰石高温分解反应
D. 生成物的总键能高于反应物的总键能
【答案】C
【解析】
【详解】A.生成物的总能量高于反应物的总能量,为吸热反应,△H>0,故A错误;
B.由图无法获知反应物、生成物种类,不能比较稳定性,故B错误;
C.该反应属于吸热反应,而石灰石高温分解属于吸热反应,符合图象变化,故C正确;
D.此反应为吸热反应,说明反应物的键能和大于生成物的键能和,故D错误;
故选C。
19. 下列不属于氮的固定的是
A. 雷雨天:N2+O2=2NOB. 工业上合成氨:N2+3H22NH3
C. 大豆根瘤菌将N2转化成化合态氮D. 2NO+O2=2NO2
【答案】D
【解析】
【分析】把大气中的游离态的氮转化为氮的化合物的过程称为固氮,主要有:自然固氮:生物固氮(根瘤菌的固氮)和大气固氮(闪电时N2转化为NO)、工业固氮(合成氨)两大类;
【详解】A.雷雨天:N2+O2═2NO,将氮气单质变为化合物中的氮元素,属于大气固氮,选项A不符合;
B.工业上合成氨:N2+3H2⇌2NH3,属于工业固氮,选项B不符合;
C.大豆根瘤菌将N2转化成化合态氮,属于生物固氮,选项C不符合;
D.NO、NO2都为氮的氧化物,它们间的相互转化,属于化合物间的转化,不符合单质转化为化合物的特点,所以不属于氮的固定,选项D符合;
答案选D。
20. 工业生产硫酸时,其中一步反应是2SO2 + O2 2SO3,下列说法错误的是
A. 增大氧气的浓度可提高反应速率
B. 升高温度可提高反应速率
C. 使用催化剂能显著增大反应速率
D. 达到化学平衡时正逆反应速率相等且都为零
【答案】D
【解析】
【详解】A.增大氧气浓度,单位体积内的活化分子数目增加,单位时间内的有效碰撞次数增加,故反应速率增大,A说法正确;
B.升高温度,活化分子百分数增加,单位时间内的有效碰撞次数增加,故反应速率增大,B说法正确;
C.加入催化剂,可以降低反应的活化能,活化分子百分数增加,单位时间内的有效碰撞次数增加,故反应速率增大,C说法正确;
D.达到化学平衡时正逆反应速率相等,应反应没有停止,速率不为零,D说法错误。
综上所述,相关说法错误的是D,答案选D。
第II卷(40分)
二、填空题(本题共3小题,21、22题每空3分,23题每空2分)
21. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为_____。
(2)反应开始至2min,以气体X表示平均反应速率为_____。
(3)已知X、Y、Z均为气体,则下列措施能增大反应速率的是_____。
A. 升高温度B. 降低压强
C. 减小N的浓度D. 将反应容器容积缩小
【答案】(1)3X+Y2Z
(2)0.075ml·L-1·min-1 (3)AD
【解析】
【小问1详解】
由图可知X、Y物质的量减少为反应物,Z物质的量增加为生成物,反应到2min时,;,,根据物质的量的变化量之比等于化学计量数之比可得反应:3X+Y2Z,故答案为:3X+Y2Z;
【小问2详解】
0.075ml·L-1·min-1,故答案为:0.075ml·L-1·min-1;
【小问3详解】
A. 升高温度能加快化学反应速率,故A选;
B. 降低压强,反应速率减小,故B不选;
C. 减小浓度,反应速率减小,故C不选;
D. 将反应容器容积缩小,各物质浓度增大,反应速率加快,故D选;
故答案为:AD;
22. 氮是大气中含量最多的一种元素,氮及其化合物在生产、生活中有着重要作用。请回答:
(1)下列变化属于“氮的固定”的是_____(填字母)。
a.植物从土壤中吸收氮肥
b.硝酸和氨气反应生成氮肥
c.将空气中的氮气转变为氮的化合物
d.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
(2)写出下列反应是“吸热反应”或“放热反应”。
A.Ba(OH)2·8H2O与NH4Cl反应:_____。
B.铝与稀盐酸:_____。
【答案】(1)c (2) ①. 吸热反应 ②. 放热反应
【解析】
【小问1详解】
氮的固定是将游离态氮转化为化合态氮的过程,只有c符合,故答案为:c;
【小问2详解】
Ba(OH)2·8H2O与NH4Cl反应为吸热反应;Al与盐酸反应生成氯化铝和氢气,该反应为放热反应,故答案为:吸热反应;放热反应。
23. 如图所示,A装置的烧杯中盛有足量的稀硫酸溶液。
(1)A池中Zn是_____极,发生_____反应(填“氧化”或“还原”,下同)。
(2)电极反应式为_____。
(3)Cu是_____极,发生_____反应。
(4)电极反应式为_____。
(5)A池中总的电极反应式为_____。
(6)外电路中的电子是从_____电极流向_____电极(填电极材料。下同)
(7)溶液中阴离子向_____电极移动。
(8)若反应过程中有0.2ml电子发生转移,则生成的氢气在标况下体积为_____。
【答案】(1) ①. 负 ②. 氧化反应
(2)Zn-2e-=Zn2+
(3) ①. 正 ②. 还原反应
(4)2H++2e-=H2↑
(5)Zn+2H+=Zn2++H2↑
(6) ①. 锌(Zn) ②. 铜(Cu)
(7)锌(Zn) (8)2.24L
【解析】
【分析】Zn-Cu-硫酸形成原电池,Zn作负极,Cu作正极,反应原理为Zn与硫酸反应生成硫酸锌和氢气,据此解答。
【小问1详解】
由上述分析可知Zn为负极,失电子发生氧化反应,故答案为:负;氧化反应;
【小问2详解】
负极锌失电子生成锌离子,电极反应:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
【小问3详解】
Cu为正极,氢离子在正极得电子生成氢气,发生还原反应,故答案为:正;还原反应;
【小问4详解】
正极氢离子在正极得电子生成氢气,电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
【小问5详解】
该原电池的总反应为锌与硫酸生成硫酸锌和氢气,反应离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
【小问6详解】
外电路中电子由负极经导线流向正极,即由锌电极经导线流向铜电极,故答案为:锌(Zn);铜(Cu);
【小问7详解】
原电池中,溶液中阴离子向负极移动,即向锌(Zn)电极移动,故答案为:锌(Zn);
【小问8详解】
正极反应:2H++2e-=H2↑,由电极反应可知转移2ml电子生成1ml氢气,则0.2ml电子发生转移时生成0.1ml氢气,体积为2.24L,故答案为:2.24L。A.硅太阳能电池
B.燃气灶
C.太阳能集热器
D.锂离子电池
2023-2024学年江苏省盐城市响水县清源高级中学高一下学期3月学情分析考试(选修)化学试题: 这是一份2023-2024学年江苏省盐城市响水县清源高级中学高一下学期3月学情分析考试(选修)化学试题,文件包含江苏省盐城市响水县清源高级中学高一下学期3月学情分析考试选修化学试题原卷版docx、江苏省盐城市响水县清源高级中学高一下学期3月学情分析考试选修化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
江苏省盐城市响水县清源高级中学2023-2024学年高二上学期期中考试化学试卷(选修)Word版含答案: 这是一份江苏省盐城市响水县清源高级中学2023-2024学年高二上学期期中考试化学试卷(选修)Word版含答案,文件包含高二期中化学选修docx、高二期中化学选修答案pdf等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
江苏省盐城市响水县清源高级中学2022-2023学年高一下学期3月月考化学试题(Word版含答案): 这是一份江苏省盐城市响水县清源高级中学2022-2023学年高一下学期3月月考化学试题(Word版含答案),共8页。试卷主要包含了选择题,填空简答题等内容,欢迎下载使用。












