


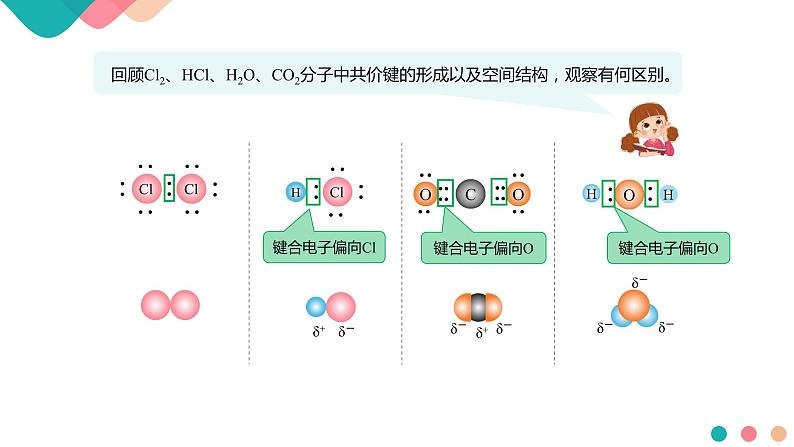
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质图片ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质图片ppt课件,共20页。PPT课件主要包含了键合电子偏向Cl,键合电子偏向O,不同种元素的原子,同种元素的原子,发生偏移,不发生偏移,电中性,键的极性,分子的极性,极性分子等内容,欢迎下载使用。
众多水分子随电磁场定向转动,相互间频繁摩擦,使电磁能转化为热能
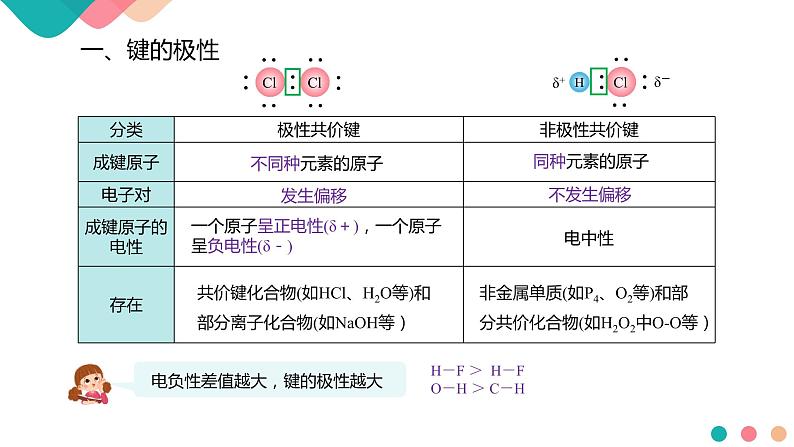
共价键化合物(如HCl、H2O等)和部分离子化合物(如NaOH等)
非金属单质(如P4、O2等)和部分共价化合物(如H2O2中O-O等)
一个原子呈正电性(δ+),一个原子呈负电性(δ-)
H-F > H-FO-H > C-H
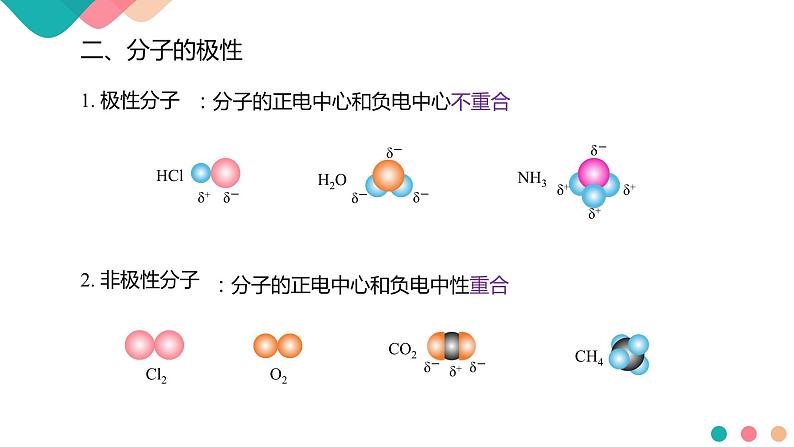
:分子的正电中心和负电中心不重合
:分子的正电中心和负电中性重合
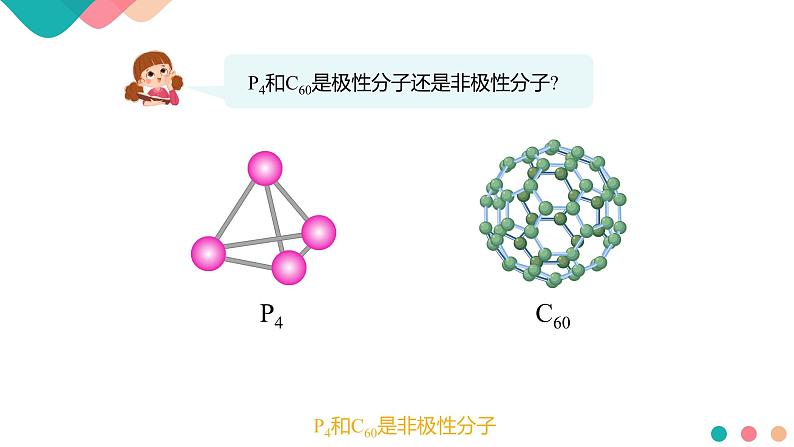
P4和C60是非极性分子
(1)只含非极性键的分子
以一个氧原子为中心,采取 sp2 杂化方式,与另外两个氧原子分子构成极性键,中间氧原子提供 2 个电子,旁边两个氧原子各提供 1个电子,构成一个特殊的化学键(虚线内部)——三个氧原子均等地享有这4个电子,整体呈V形, O3 为极性分子。
H2O2的分子空间结构可在二面角中表示,连个H原子犹如在半展开的书的两面纸上,书面夹角为93°52′,而两个O-H键与O-O键的夹角均为96°52′。H-O为极性共价键, O-O为非极性共价键,空间结构不对称,为极性分子。
键的极性对物质的化学性质的影响
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱。
氯的电负性较大,极性:Cl3C->Cl2CH-> ClCH2-,卤素原子越多,羧基的极性越大,酸性越强。
电负性:F>Cl 极性:F3C>Cl3C 三氟乙酸中羧基极性更大,酸性更强。
1.下列叙述正确的是( )A.构成单质分子的微粒一定含有共价键B.由非金属元素组成的化合物不一定是共价化合物C.非极性键只存在于双原子单质分子里D.不同元素组成的多原子分子里的化学键一定都是极性键
2.下列叙述中正确的是( )A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性也越强B.以极性键结合的分子,一定是极性分子C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键D.非极性分子中,各原子间都应以非极性键结合
3.下列中心原子采取sp2杂化且为非极性分子的是( )A.CS2 B.H2S C.SO2 D.SO3
4.下列叙述正确的是( )A.NO、N2O、NO2、NH3都是非极性分子B.CO2、SO3、BCl3、NF5都是非极性分子C.H2O、NH3是极性分子,分子中的H—O比N—H的极性弱D.PCl5、NCl3、SO3、BF3、CCl4都是非极性分子
5. ①PH3分子的空间结构为三角锥形,②BeCl2分子的空间结构为直线形,③CH4分子的空间结构为正四面体形,④CO2为直线形分子,⑤BF3分子的空间结构为平面三角形,⑥NF3分子结构为三角锥形。下面对分子极性的判断正确的是( )A.①⑥为极性分子,②③④⑤为非极性分子B.只有④为非极性分子,其余为极性分子C.只有②⑤是极性分子,其余为非极性分子D.只有①③是非极性分子,其余是极性分子
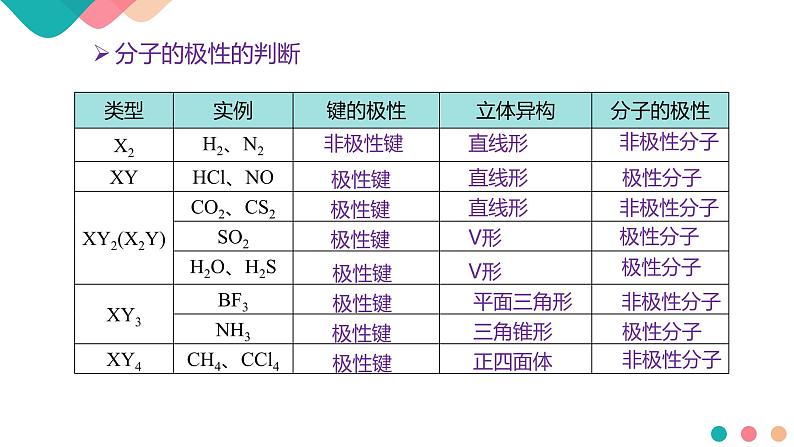
6.在HF、H2O、NH3、CS2、CH4、N2分子中:(1)以非极性键结合的非极性分子是________。(2)以极性键相结合,具有直线形结构的非极性分子是________。(3)以极性键相结合,具有三角锥形结构的极性分子是________。(4)以极性键相结合,具有正四面体结构的非极性分子是________。(5)以极性键相结合,具有V形结构的极性分子是____。(6)以极性键相结合,而且分子极性最大的是________。
相关课件
这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质备课ppt课件,共60页。PPT课件主要包含了极性键,共价键的极性,学习目标,分子的极性,负电荷两中心重合,ClCl,HCl,非极性键,非极性分子,极性分子等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件,共29页。PPT课件主要包含了课前导入,电子式,结构式,非极性键,极性键,极性键和非极性键,极性分子,非极性分子,HCl,大小相等方向相反等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第三节 分子结构与物质的性质完美版习题课件ppt,共33页。









