










高中物理沪科技版(2020)选修第三册第一节 电子的发现说课ppt课件
展开科学家在研究稀薄气体放电时发现,当玻璃管内的气体足够稀薄时,阴极就发出一种射线。它能使对着阴极的玻璃管壁发出荧光,这种射线的本质是什么呢?
一种观点认为阴极射线像X射线一样是电磁辐射代表人物赫兹
另一种观点认为阴极射线是带电微粒代表人物汤姆孙
J.J.汤姆孙 英国
J.J.汤姆孙对阴极射线进行了一系列的实验研究。他确认阴极射线是带电的粒子。自1890年起开始研究。
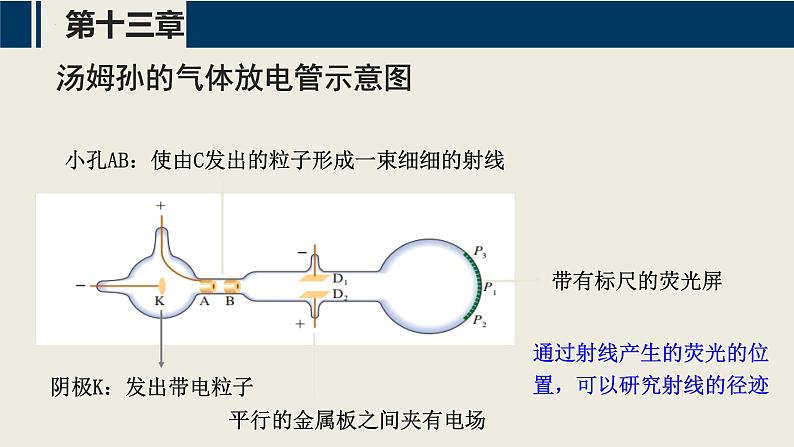
小孔AB:使由C发出的粒子形成一束细细的射线
平行的金属板之间夹有电场
通过射线产生的荧光的位置,可以研究射线的径迹
汤姆孙的气体放电管示意图
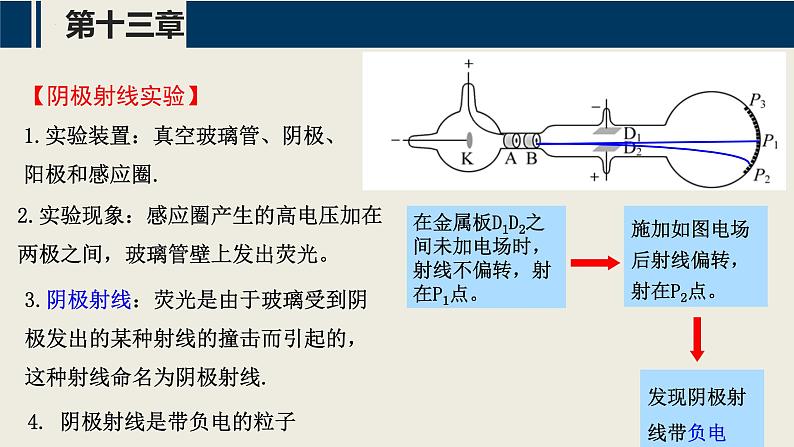
【阴极射线实验】1.实验装置:真空玻璃管、阴极、阳极和感应圈.
在金属板D1D2之间未加电场时,射线不偏转,射在P1点。
施加如图电场后射线偏转,射在P2点。
3.阴极射线:荧光是由于玻璃受到阴极发出的某种射线的撞击而引起的,这种射线命名为阴极射线.
2.实验现象:感应圈产生的高电压加在两极之间,玻璃管壁上发出荧光。
4. 阴极射线是带负电的粒子
需在D1D2之间施加垂直纸面向外的磁场
去掉D1D2之间的电场
射线在磁场作用下偏转,射在P3点。
换用不同材料的阴极做实验,所得比荷的数值都相同,是氢离子比荷的近两千倍.证明这种粒子是构成各种物质的共有成分.
1.真空玻璃管两极加上高电压
2.物理学家戈德斯坦将阴极发出的射线命名为阴极射线.
3.猜想:(1)阴极射线是一种电磁辐射.(2)阴极射线是带电微粒.
4.英国物理学家汤姆孙让阴极射线在电场和磁场中偏转.
由实验测得的阴极射线粒子的比荷是氢离子比荷的近两千倍。 J.J汤姆孙猜测若这种粒子的电荷量与氢离子的电荷量相同,则其质量约为氢离子质量的近两千分之一。汤姆孙后续的实验粗略测出了这种粒子的电荷量确实与氢离子的电荷量差别不大,证明了他当初的猜测是正确的。 后来,物理学家把新发现的这种组成阴极射线的粒子称之为电子。
1889年4月30日,J.J.汤姆孙正式宣布发现电子; 电子的发现,结束了关于阴极射线本质的争论; 从此,人类意识到,原子并不是组成物质的最小单位,探索原子结构的序幕由此拉开…… 由于J.J.汤姆生的杰出贡献,1906年他获得诺贝尔物理学奖。
由此可见电子是原子的组成部分,是比原子更基本的物质单元。
阴极射线是带负电的电子流。
J.J.汤姆孙的儿子G.P.汤姆孙(1937年诺贝尔物理学奖)
G.P.汤姆孙(Gerge Paget Thmsn,1892-1975),因通过实验发现受电子照射的晶体中的干涉现象,1937年获得诺贝尔物理学奖。 汤姆逊父子分别于1906年、1937年获得物理学奖,是诺贝尔奖历史上6次“子承父业”奇迹之一。
想一想:为什么说电子是原子的组成部分,是比原子更基本的物质单元?
J.J汤姆孙研究发现: ① 许多现象中都发现了同样的带电粒子---电子, ② 它的质量只比最轻原子质量的两千分之一稍多一点。
阴极射线是由比最小的原子还小的多的带负电荷的微粒构成的
(1)产生电子的方法
(2)汤姆孙通过进一步的研究证明:电子是原子的组成部分,是比原子更基本的单元。
第一次较为精确测量出电子电荷量的是美国物理学家密立根利用油滴实验测量出的。
电子的质量m=9.1094×10-31 kg
电子的电荷量e=1.6022×10-19 C
密立根实验发现:电荷具有量子化的特征,即任何带电体的电荷只能是e的整数倍。
电子电荷的精确测定是在1909〜1913年间由密立根通过著名的“油滴实验”做出的。目前公认的电子电荷e的值为:
e= 1.602 176 634 × 10 -19 C
密立根实验更重要的发现是:电荷是量子化的,即任何带电体的电荷只能是e的整数倍。
从实验测到的比荷及e的数值,可以确定电子的质量。现在人们普遍认为电子的质量为:
me= 9.109 383 56 × 10 -31 kg
质子质量与电子质量的比值为:
通常情况下,物质是不带电的,因此,原子应该是电中性的。既然电子是带负电的,质量又很小,那么,原子中一定还有带正电的部分,它具有大部分的原子质量。请你设想一下,原子中带正电的部分以及带负电的电子可能是如何分布的?
原子是一个球体,正电荷均匀分布在球体中,电子镶嵌在正电荷之中,就象枣点缀在一块蛋糕里一样,所以又被人们称为“枣糕模型(西瓜模型)”。
这个模型不久就被实验事实否定了
1903年勒纳德实验:使电子束射到金属膜上。
1、现象:较高速度的电子束很容易穿透原子。
2、推断:说明原子内部很空,或者说原子不是一个实心球体。
3、矛盾:与汤姆孙的原子模型(实心)不符。
说明汤姆孙的枣糕模型是有问题的,再后来卢瑟福α粒子散射实验则完全否定了汤姆孙的模型。
从经典物理学的角度看,汤姆孙的模型是很成功的。解释原子是电中性的,电子在原子里是怎样分布的,解释原子为什么会发光,能估计出原子的大小约为一亿分之一厘米。
以汤姆孙为首的英国剑桥学派,在原子物理学上所取得的这些惊人成就,使欧洲大陆上的物理学家都拜倒在他们的脚下。他的学生卢瑟福也接受了汤姆孙的原子模型,1909年卢瑟福建议其学生兼助手盖革和马斯顿用α粒子轰击金箔去验证汤姆孙原子模型。
欧内斯特·卢瑟福1871年8月30日生于新西兰纳尔逊的一个手工业工人家庭,并在新西兰长大。他进入新西兰的坎特伯雷学院学习。23岁时获得了三个学位(文学学士、文学硕士、理学学士)。
α粒子特性:(1)具有足够的能量可以接近原子中心。(2)可使荧光物质发光。
α粒子是从放射性物质(如铀和镭)中发射出来的快速运动的粒子,质量为氢原子质量的4 倍、电子质量的7300倍。
1909 年,英国物理学家卢瑟福指导他的助手盖革和马斯顿进行α粒子散射实验的研究时,所用仪器的示意图。
③M显微镜带有光屏S,可以在水平而内转到不同的方向对散射的α粒子进行观察。
①R是被铅块包围的α粒子源
②F是金箔:接收α粒子的轰击
当α粒子打到金箔时,发生了α粒子的散射。统计散射到各个方向的α粒子所占的比例,可以推知原子中电荷的分布情况。
金的延展性好,核电荷量大,核质量大。
1、 α粒子射入金箔时难免与电子碰撞。试估计这种碰撞对α粒子速度影响的大小。2、按照J. J.汤姆孙的原子模型,正电荷均匀分布在整个原子球体内。请分析:α粒子穿过金箔,受到电荷的作用力后,沿哪些方向前进的可能性较大,最不可能沿哪些方向前进。
α粒子的质量大约是电子质量的7300倍,α粒子与电子碰撞时,对α粒子速度影响的很小,碰撞前后,质量大的α粒子速度几乎不变。只可能是电子的速度发生大的改变,因此不可能出现α粒子反弹现象,即使是非对心碰撞,也不会有大角度散射。
按照J. J.汤姆孙的原子模型,正电荷均匀分布在整个原子球体内,由于受库仑斥力的作用,α粒子穿过原子时,受到的各个方向正电荷的斥力基本会相互平衡,因此对α粒子运动的影响不会很大。大部分α粒子会有小角度偏转,但不可能有大角度偏转。
①绝大多数α粒子穿过金箔后,基本上仍沿原来的方向前进。
③极少数偏转的角度甚至大于90°,也就是说,它们几乎被“撞了回来”。
①J.J.汤姆孙的模型无法解释大角度散射的实验结果。
②占原子质量绝大部分的带正电的物质集中在很小的空间范围。这样才会使α粒子在经过时受到很强的斥力,使其发生大角度的偏转。
⑴大角度的偏转不可能是电子造成的
⑵α粒子偏转主要是具有原子的大部分质量的带正电部分造成的
⑶带负电的电子在核外空间绕着核旋转做圆周运动
⑴在原子的中心有一个体积很小、带正电荷的核,叫做原子核
⑵原子的全部正电荷和几乎全部质量都集中在原子核里
1899年命名 α 射线、β 射线;1902年提出原子自然衰变理论;1909~1911年,卢瑟福指导他的学生盖革和马斯顿进行了α粒子散射实验。1911年提出原子的核式结构模型;1919年发现质子,预言中子;实现人工核反应。直接培养了11名诺贝尔奖获得者。被誉为原子物理学之父。
原子核式结构与经典理论之间的矛盾
在核式结构模型中,电子受原子核的库仑引力作用绕原子核旋转,因此这种运动必有 加速度。根据经典理论,做加速运动的电荷将向外辐射电磁波。而这种电磁辐射将导致电 子绕核运动的能量减少,从而使电子绕核运动的轨道半径减小,直至电子沿螺旋线落入原 子核。计算表明,电子落入原子核的时间约为 10-9 s 。照此看来,原子是不稳定的,但这 显然与事实不符
核式结构模型与经典理论之间的尖锐矛盾使得卢瑟福的理论受到冷遇。 1911 年,代表 当时物理学最高学术水准的第一届索尔维会议 (图 13-10) 在比利时布鲁塞尔召开,包括 爱因斯坦、居里夫人、洛伦兹和卢瑟福本人在内的 23 位卓越的物理学家参加了会议。但 当时的会议记录中根本没有提及卢瑟福对原子结构的研究工作。不久以后,曾在卢瑟福实 验室工作的丹麦物理学家玻尔 (N. Bhr ,1885— 1962) 运用创造性的假说拯救了卢瑟福的 核式结构模型。现代物理学史表明:卢瑟福的方法和理论开辟了研究原子结构的正确途径, 为原子物理学的发展做出了重要贡献。
1、原子核的电荷、电子数、原子序数
⑴原子是由带电荷+Ze的核与核外Z个电子组成的。电子数Z等于原子核所带正电荷数。
⑶原子核是由质子和中子组成的,原子核的电荷数就是核中的质子数。
Ze是原子核的电荷,单位是库仑;Z是原子序数,也是原子核的电荷数,它表示原子核的电荷是一个电子电荷(绝对值)的多少倍。Z是没有单位的,或者说Z的单位是1。
⑵原子序数Z 等于核电荷与电子电荷大小的比值
原子核的电荷数:电荷数(Z)=质子数=原子序数
原子核的质量数:质量数(A)=核子数=质子数+中子数
X为元素符号,Z为质子数,A 为质量数。核电荷数=质子数(Z)=元素的原子序数=核外电子数质量数(A)=核子数=质子数+中子数
原子核的半径是很难测量的,一般通过其他粒子与核的相互作用来确定。α粒子散射可以用来估算核半径。对于一般的原子核,实验确定的核半径的数量级为10-15 m,而整个原子半径的数量级是10-10 m,两者相差十万倍之多。
原子内部是十分“空旷”的
通常用核半径描述核的大小
核半径的数量级为10-15 m
原子半径的数量级是10-10 m
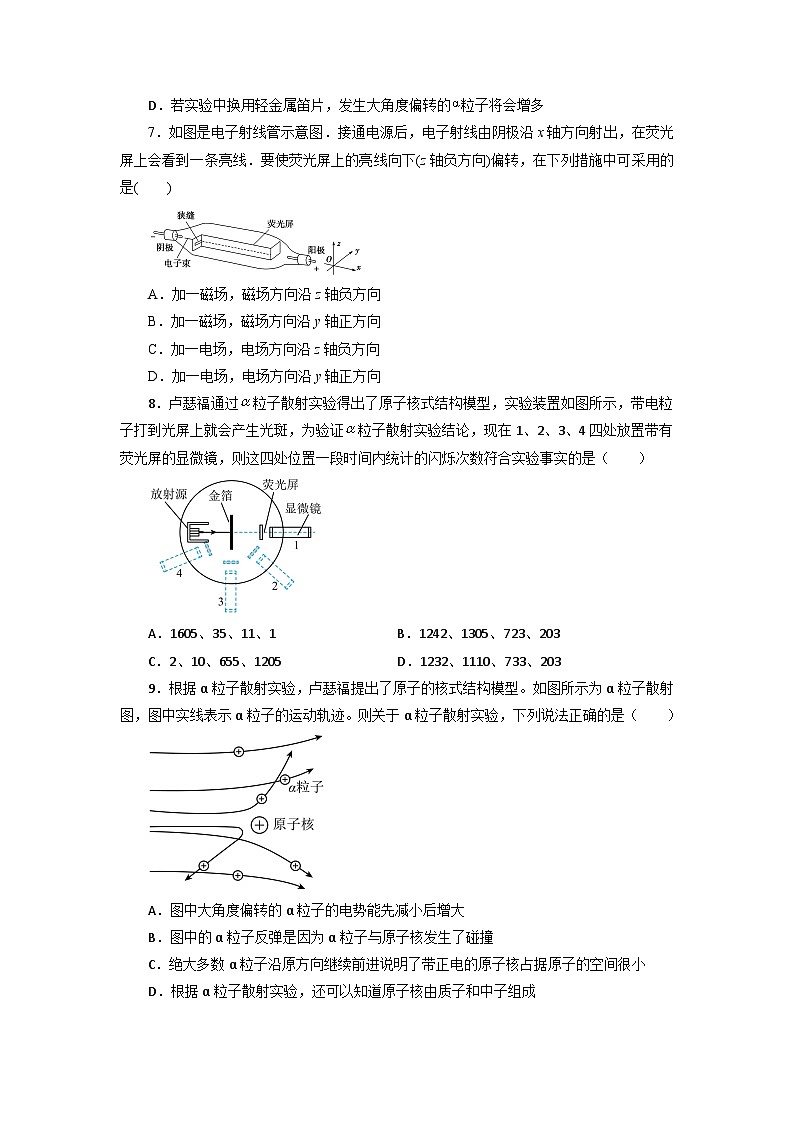
1、(多选)(卢瑟福和他的学生用α粒子轰击不同的金属,并同时进行观测,经过大量的实验,最终确定了原子的核式结构.如图为该实验的装置,其中荧光屏能随显微镜在图中的圆面内转动.当用α粒子轰击金箔时,在不同位置进行观测,如果观测的时间相同,则下列说法正确的是( )A.在1处看到的闪光次数最多B.2处的闪光次数比4处多C.3和4处没有闪光D.4处有闪光但次数极少
2、美国物理学家密立根通过如图所示的实验装置,最先测出了电子的电荷量,被称为密立根油滴实验.两块水平放置的金属板A、B分别与电源的正、负极相连接,板间产生匀强电场,方向竖直向下,图中油滴由于带负电悬浮在两板间保持静止.(1)若要测出该油滴的电荷量,需要测出的物理量有________.A.油滴质量m B.两板间的电压UC.两板间的距离d D.两板的长度L(2)用所选择的物理量表示出该油滴的电荷量q=________.(已知重力加速度为g)
板间电场为匀强电场,油滴处于静止状态,所以电场力与重力平衡。
所以需要测出的物理量有油滴质量m,两板间的电压U,两板间的距离d。
3.美国物理学家密立根通过如图所示的实验装置,最先测出了电子的电荷量,被称为密立根油滴实验.两块水平放置的金属板A、B分别与电源的正、负极相连接,板间产生匀强电场,方向竖直向下,图中油滴由于带负电悬浮在两板间保持静止.(1)若要测出该油滴的电荷量,需要测出的物理量有________.A.油滴质量m B.两板间的电压UC.两板间的距离d D.两板的长度L(2)用所选择的物理量表示出该油滴的电荷量q=________.(已知重力加速度为g)
4、(多选)根据卢瑟福的原子核式结构理论,下列对原子结构的认识中,正确的是( )A.原子中绝大部分是空的,原子核很小B.电子在核外运动,库仑力提供向心力C.原子的全部正电荷都集中在原子核里D.原子核的直径大约为10-10 m
卢瑟福α粒子散射实验的结果否定了关于原子结构的汤姆孙模型,提出了关于原子的核式结构学说,并估算出原子核半径的数量级为10-15 m,原子半径的数量级为10-10 m,原子半径是原子核半径的十万倍,所以原子内部是十分“空旷”的,核外带负电的电子由于受到带正电的原子核的吸引而绕核旋转,所以A、B、C正确,D错误.
为了解决核式结构模型所遇到的困难,丹麦物理学家玻尔 根据量子概念对经典理论进行了修正。 在玻尔将量子学说引入原子结构的过程中,瑞士的中学数学教 师巴尔末于 1885 年所给出的关于氢原子光谱中可见光波段波长的经 验公式 (巴尔末公式) 起到了很重要的作用。
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发其他颜色的光呢?
光谱:光按波长(频率)和强度分布的记录(有时只是波长成分的记录)。
用棱镜或光栅可以把物质发出的光按波长(频率)展开
定义:由发光体直接产生的光谱
产生条件:炽热的固体、液体和高压气体发光形成的
光谱的形式:连续分布(连在一起的光带),一切波长的光都有
产生条件:稀薄气体或金属蒸气发光形成的光谱
光谱形式:一些不连续的明线组成,不同元素的明线光谱不同(又叫特征光谱)
定义:连续光谱中某些波长的光被物质吸收后产生的光谱
产生条件:炽热的白光通过温度较白光低的气体后,再色散形成的
光谱形式:用分光镜观察时,见到连续光谱背景上出现一些暗线(与特征谱线相对应)——也是原子的特征谱线。
光谱的分类:发射光谱和吸收光谱。
定义:物体发光直接产生的光谱叫做发射光谱。
分类:连续光谱和明线光谱。
光谱是连在一起的,一切波长的光都有(如炽热的固体、液体和高压气体的发射光谱)
一些不连续的明线的光谱,每种原子只能发出具有本身特征的某些波长的光(如稀薄气体、金属的蒸气或原子的发射光谱)
②线状光谱:(原子光谱)
a.定义:由波长连续分布的光组成的连在一起的光带叫连续光谱。
c.产生:炽热的固体、液体及高压气体发射的光谱是连续光谱(如白炽灯丝、烛焰、炽热的钢水发出的光都形成连续光谱)。
b.特点:光谱看起来不是一条条分立的谱线,而是连在一起的彩色光带。 即连续分布的包含有从红光到紫光各种色光的光谱。
① 定义:高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。即连续光谱背景上出现的一些暗线。
②各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱中的一条明线相对应。实验表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光。因此吸收光谱中的暗线与发射光谱中明线相对应,也是原子的特征谱线。
③太阳的光谱是吸收光谱。
氢原子是最简单的原子,其光谱也最简单。从氢气放电管可以获得氢原子光谱。
氢原子在可见光区的四条谱线
3、可见光的波长范围: 4.0×10-7m~7.6×10-7m (400nm~760nm)。
1、氢原子在可见光区有四条谱线。氢原子光谱呈现分立的明线条纹,在可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性。
2、氢原子的谱线由不同色亮线组成,每种颜色对应着一种波长。
巴耳末系波长公式:
R∞叫作里德伯常量,实验测得的值为R∞=1.10×107 m-1
n=3,4,5,...
除了巴耳末系,后来发现的氢光谱在红外和紫外光区的其他谱线也都满足与巴耳末公式类似的关系式。
(可见光区的四条谱线)
原子内部电子的运动是原子发光的原因。因此,光谱是探索原子结构的一条重要途径。
n=2,3,4,...
n=4,5,6,...
n=5,6,7,...
n=6,7,8,...
卢瑟福原子核式模型正确地指出了原子核的存在,很好地解释了α粒子散射实验。但是,经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立特征。
1、按经典物理学电子绕核旋转,作加速运动,电子将不断向四周辐射电磁波,它的能量不断减小,从而将逐渐靠近原子核,最后落回到原子核上形成原子坍塌。但事实上原子是个稳定的系统。
电子绕核转动的经典图景
辐射电磁波频率只是某些确定值
轨道及转动频率不断变化,辐射的电磁波频率也是连续的, 即原子光谱应是连续的光谱。而实际上看到的是分立的线状谱。
事实上:原子是稳定的;原子光谱是线状谱、分立的。
这些矛盾说明尽管经典物理学理论可以很好地应用宏观物休,但它不能解释原子世界的现象。
玻尔在卢瑟福原子核式结构模型的基础上引入了量子化概念,提出了自己的原子结构 模型假设,为解释氢原子光谱提供了理论基础。这个理论就叫做玻尔理论。
普朗克黑体辐射的量子论
玻尔原子理论假设的基础
——针对原子核式结构模型提出
绕核运动的电子轨道半径只能是某些分立的数值。
原子的能量En:核外电子绕原子核运动时动能Ekn 原子所具有的电势能Epn的总和
可与万有引力“高轨低速大周期,大机大势小引力”类比
电子沿不同的圆形轨道绕核运动时原子有相对应的不同的确定的能量状态
假设2:能量量子化(定态、能级)
⑵能级:原子的在各种定态时的能量值
⑴定态:原子具有确定能量的稳定状态
①基态:能量最低的状态(离核最近)
②激发态:其他的能量状态
——针对原子的稳定性提出
原子的能量与电子所在的轨道相对应
当电子在不同的轨道上运动时,原子具有不同的能量。
假设3:频率条件(跃迁假说)
——针对原子光谱是线状谱提出
电子吸收光子克服库仑引力做功,原子能量增加
电子辐射光子,原子能量减少
玻尔运用经典理论结合上述量子化假设,给出了氢原子核外电子所有可能的轨道半径 以及电子在各条轨道上运动时氢原子的能量 (电子绕核运动的动能以及电子与氢原子核间 静电相互作用的电势能的代数和)。
氢原子各个定态的能量,叫做氢原子的能级(energy level),以上关于 En 的表达式就 称为氢原子的能级公式。
1、电子从高能级向低能级跃迁(自发跃迁)
处于激发态的原子是不稳定的,可自发地经过一次或几次跃迁到达基态。
由于能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线。
2、电子从低能级向高能级跃迁(受激跃迁)
吸收光子的能量必须等于能级差
处于某个能级的电子吸收能量,挣脱原子核的束缚,成为自由电子的现象,叫做电离。电离后自由电子动能EK = hv - En
发射光谱的明线与吸收光谱的暗线频率相同
电子从低能级向高能级跃迁(受激跃迁):
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。(对于能量大于或等于13.6eV的光子,氢原子电离,即原子结构被破坏)
电离后电子剩余动能为:
要么全被吸收,要么不吸收。
②吸收实物粒子能量(碰撞、加热) 只要实物粒子(如微观粒子中的电子、α粒子等)能量足以使氢原子向高能级跃迁,就能被氢原子全部吸收或部分吸收而使氢原子向高能级跃迁,多余能量仍为实物粒子动能(自己保留)。
2)实物粒子使原子跃迁(n→m) :
实物粒子的能量可以全部或部分被吸收,需要多少,吸收多少。多余的能量由实物粒子自己保留。
1)原子的电离:原子由某一定态轨道跃迁到最高能级n=∞的过程。
从高能级向低能级跃迁(自发跃迁)
从低能级向高能级跃迁(受激跃迁)
玻尔在解决核外电子的运动时成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律
除了氢原子光谱外,在解决其他问题上遇到了很大的困难
无法解释复杂一点的原子的光谱现象无法解释谱线的强度等
2、原子结构理论的发展过程
原子稳定性事实氢光谱实验
观察与实验所获得的事实
建 立 科 学模型提出科学假说
彻底放弃经典概念,用电子云概念取代经典的轨道概念
电子在某处单位体积内出现的概率
1、根据玻尔的原子理论,原子中电子绕核运动的半径( )A.可以取任意值 B.可以在某一范围内取任意值C.可以取一系列不连续的任意值 D.是一系列不连续的特定值
2、一个氢原子从n=3能级跃迁到n=2能级,该氢原子( )A.放出光子,能量增加 B.放出光子,能量减少C.吸收光子,能量增加 D.吸收光子,能量减少
3、根据玻尔理论,下列关于氢原子的论述正确的是( )A.当氢原子由能量为En的定态向低能级跃迁时,氢原子要辐射的光子能量为hν=EnB.电子沿某一轨道绕核运动,若圆周运动的频率为ν,则其发光的频率也是νC.一个氢原子中的电子从一个半径为ra的轨道自发地直接跃迁到另一个半径为rb的轨道,已知ra>rb,则此过程原子要辐射某一频率的光子D.氢原子吸收光子后,将从高能级向低能级跃迁
氢原子由能量为En的定态向低能级跃迁时,辐射的光子能量等于能级差,与En不同,故A错误;电子沿某一轨道绕核运动,处于某一定态,不向外辐射能量,故B错误;电子由半径大的轨道跃迁到半径小的轨道,能级降低,因而要辐射某一频率的光子,故C正确;原子吸收光子后能量增加,能级升高,故D错误.
4、如图所示为氢原子能级图。大量处于n=4能级的氢原子向低能级跃迁时发出不同频率的光。用这些光照射金属钙。已知金属钙的逸出功为3.20 eV。能够从金属钙的表面照射出光电子的光共有( )A.2种B.3种C.4种 D.5种
大量的处于n=4能级的氢原子向低能级跃迁时,能发出6种不同频率的光电子,它们的能量分别是E1=-0.85 eV-(-1.51 eV)=0.66 eV,E2=-0.85 eV-(-3.40 eV)=2.55 eV,E3=-0.85 eV-(-13.6 eV)=12.75 eV,E4=-1.51 eV-(-3.40 eV)=1.89 eV,E5=-1.51 eV-(-13.6 eV)=12.09 eV,E6=-3.40 eV-(-13.6 eV)=10.2 eV,可见有三种光电子的能量大于3.20 eV,故能够从金属钙的表面照射出光电子的光共有三种,故B正确,A、C、D错误。
5、(多选)氢原子各个能级的能量如图所示,大量氢原子由n=1能级跃迁到n=4能级,在它回到n=1能级过程中,下列说法中正确的是( )
A.可能激发出频率不同的光子只有6种B.可能激发出频率不同的光子只有3种C.可能激发出的光子的最大能量为12.75 eVD.可能激发出的光子的最大能量为0.66 eV
6、(多选)如图是氢原子的能级图,一群氢原子处于n=3能级,下列说法中正确的是 ( )
A.这群氢原子跃迁时能够发出3种不同频率的光子B.这群氢原子发出的光子中,能量最大为10.2 eVC.从n=3能级跃迁到n=2能级时发出的光波长最长D.这群氢原子能够吸收任意光子的能量而向更高能级跃迁
8、氢原子的核外电子由离核较远的轨道跃迁到离核较近的轨道上时,下列说法正确的是( )A.核外电子受力变小B.原子的能量减少,电子的动能增加C.氢原子要吸收一定频率的光子D.氢原子要放出一定频率的光子
7、一个氢原子从n=3能级跃迁到n=2能级,该氢原子 ( )A.放出光子,能量增加 B.放出光子,能量减少C.吸收光子,能量增加 D.吸收光子,能量减少
9、(多选)氢原子各个能级的能量如图所示,大量氢原子由n=1能级跃迁到n=4能级,在它回到n=1能级过程中,下列说法中正确的是( )
10、(多选)如图是氢原子的能级图,一群氢原子处于n=3能级,下列说法中正确的是 ( )
高中物理沪科技版(2020)选修第三册第四节 液体的基本性质教学演示ppt课件: 这是一份高中物理沪科技版(2020)选修第三册<a href="/wl/tb_c4027751_t3/?tag_id=26" target="_blank">第四节 液体的基本性质教学演示ppt课件</a>,文件包含114116气体液体和固体课件pptx、114116气体液体和固体练习原卷版docx、114116气体液体和固体练习解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
高中物理沪科技版(2020)选修第三册第一节 气体的状态教学ppt课件: 这是一份高中物理沪科技版(2020)选修第三册<a href="/wl/tb_c4027748_t3/?tag_id=26" target="_blank">第一节 气体的状态教学ppt课件</a>,文件包含111113气体液体和固体课件pptx、111113气体液体和固体练习原卷版docx、111113气体液体和固体练习解析版docx等3份课件配套教学资源,其中PPT共59页, 欢迎下载使用。
高中物理沪科技版(2020)选修第三册第三节 分子运动速率分布的统计规律精品课件ppt: 这是一份高中物理沪科技版(2020)选修第三册<a href="/wl/tb_c4027745_t3/?tag_id=26" target="_blank">第三节 分子运动速率分布的统计规律精品课件ppt</a>,文件包含第103节分子运动速率分布的统计规律课件pptx、103分子运动速率分布的统计规律原卷版docx、103分子运动速率分布的统计规律解析版docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













