





所属成套资源:2024版新教材高中化学苏教版必修第二册课件(28份)
苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化图片ppt课件
展开
这是一份苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化图片ppt课件,共60页。PPT课件主要包含了图说考点,基础知识,技能素养,课堂检测,2铁的氧化物,二价铁,三价铁,FeOH3,答案B,答案C等内容,欢迎下载使用。
新课程标准1.掌握Fe2+与碱反应的条件,会书写相关化学方程式。2.掌握Fe2+的检验方法。学业质量水平合格性要求1.会书写Fe2+与碱反应的化学方程式,并能分析反应条件对化学反应的影响。(水平1)2.能设计对照方案,并运用适当方法控制反应条件完成实验,得出结论。等级性要求能运用变量控制方法设计转化的实验方案,根据实验现象进行推理。
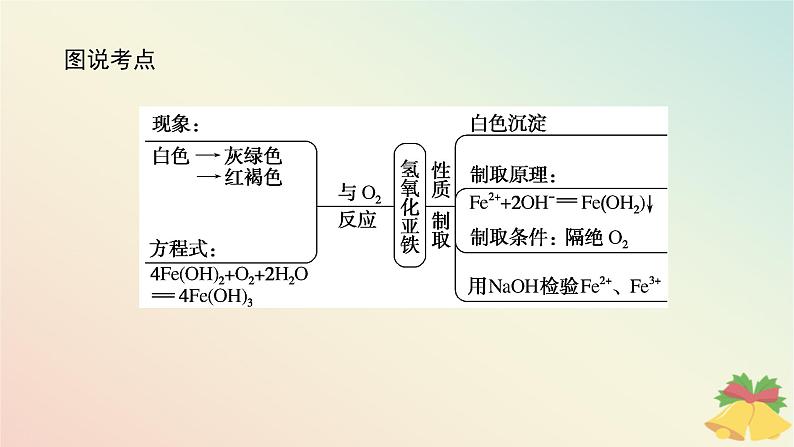
[新知预习]一、Fe(OH)2制备条件的控制1.反应条件对化学反应的影响反应条件对化学反应的方向、速率和限度都会有不同程度的影响。在研究物质的性质和制备时,应依据化学反应的规律和反应物、生成物的特点,合理选择并控制好反应条件,才能达到预期的结果。
2.氢氧化亚铁制备的条件控制
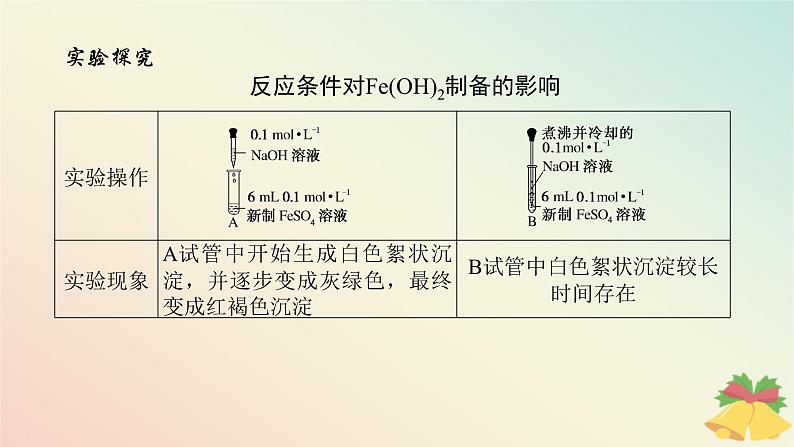
实验探究反应条件对Fe(OH)2制备的影响
特别提醒Fe(OH)2的制备方法(两个角度)1.反应试剂(1)Fe2+极易被氧化,所以FeSO4溶液要现配现用。(2)为了防止Fe(OH)2被氧化,配制FeSO4溶液所用的蒸馏水和制备Fe(OH)2所用的NaOH溶液都要煮沸、冷却,尽可能除去O2。(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长胶头滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。 胶头滴管的特殊用法
2.反应环境(1)有机溶剂覆盖法:在新制FeSO4溶液的液面上覆盖一层密度比水小且与水互不相溶的有机溶剂(如苯、煤油等),以隔绝空气(图甲),然后将吸有NaOH溶液的长胶头滴管插入FeSO4溶液的液面下,再挤出NaOH溶液。(2)还原性气体保护法:充入还原性气体(图乙),实验中先打开止水夹a,利用A中生成的H2将装置中的O2排尽,一段时间后,关闭止水夹a,利用生成的H2将A中的亚铁盐溶液压入B中与NaOH溶液反应,这样可以长时间观察到白色沉淀。
3.Fe(OH)2与Fe(OH)3的性质比较与氧化性酸混合后发生两种反应:中和反应、氧化还原反应(Fe2+转化为Fe3+)
二、铁及其化合物的相互转化1.铁和铁的氧化物(1)铁
2.铁及其化合物的“价—类”二维图
3.从物质分类的角度理解铁及其化合物的性质(1)Fe2O3、FeO都是碱性氧化物,能与酸反应生成盐和水。Fe2O3+6H+===2Fe3++3H2O;FeO+2H+===H2O+Fe2+。(2)FeSO4和FeCl3都属于盐类,能和碱反应生成Fe(OH)2及Fe(OH)3。Fe2++2OH-===Fe(OH)2↓;Fe3++3OH-===Fe(OH)3↓。(3)Fe(OH)2和Fe(OH)3均属于碱,能与酸反应生成盐和水。Fe(OH)2+2H+===Fe2++2H2O;Fe(OH)3+3H+===Fe3++3H2O。
(2)Fe2+既有还原性又有氧化性,可以转化为铁单质或含+3价铁的化合物
(3)Fe3+是铁元素的高价态,具有氧化性,可以转化为含+2价铁的化合物
5.铁元素与人体健康(1)铁元素在人体膳食结构中分为血红素铁和非血红素铁。血红素铁是与血红蛋白、肌红蛋白中的卟啉结合的________,而非血红素铁则主要以________形式存在于植物中。(2)血红素铁容易被人体吸收利用,而非血红素铁则需要将三价铁还原为二价铁才能被吸收。维生素C具有________性,能将三价铁转化为二价铁,因此进食含铁的植物食品时,要补充一定量的维生素C以促进铁的吸收。
☞应用体验元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具。如图为铁及其化合物的“价—类”二维图。
(1)填写二维图缺失的类别①________和化学式②________。(2)某同学利用以下试剂研究FeCl3的性质,进行了如下预测:①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3从物质类别上看,FeCl3属于________,可能与________发生反应(填序号);从化合价角度看,Fe3+具有________性,可能与________发生反应(填序号)。(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。①写出该反应的离子方程式:________________________。②反应中FeCl3作______剂,理由是__________________________。
Cu+2Fe3+===Cu2++2Fe2+
铁元素的化合价由+3价变为+2价
[即时自测]1.判断正误,正确的打“√”,错误的打“×”(1)Fe(OH)2不稳定,具有较强的氧化性。( )(2)FeO、Fe2O3均为碱性氧化物,均可与盐酸反应。( )(3)Fe(OH)3可通过化合反应得到,Fe(OH)2则不能。( )(4)向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁。( )(5)Fe3O4中铁的化合价有+2和+3价,是一种混合物。( )(6)FeCl2不能通过化合反应制得。( )(7)同价态含铁物质间的转化一般可通过复分解反应实现。( )(8)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气。( )
2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )A.①② B.①③C.②③ D.①②③
3.要证明某溶液中不含有Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液A.①③ B.③②C.③① D.①②③
5.元素的价—类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质类别为横坐标所绘制的二维平面图像。下图为铁元素的价—类二维图,其中的箭头表示部分物质间的转化关系,
例1 选择合适试剂完成甲、乙两组实验。甲组:检验含Fe3+的溶液中是否含有Fe2+;乙组:检验含Fe2+的溶液中是否含有Fe3+。下列试剂及加入试剂顺序能达到实验目的的是( )
解析:甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂应具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。酸性KMnO4溶液和溴水符合条件,实验现象是颜色变浅(或褪去)。乙组,在Fe2+存在的条件下,检验Fe3+,用KSCN溶液检验Fe3+,Fe2+无干扰。
例2 乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,Mr=288}可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。Ⅰ.制备碳酸亚铁(装置如图所示)
(1)仪器A的名称是________。(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是________________________________;然后关闭活塞1,接下来的操作是________________________;装置C中发生反应的离子方程式为_________________________________。Ⅱ.制备乳酸亚铁向纯净的FeCO3固体中加入足量乳酸溶液,在75 ℃下搅拌使之充分反应。(3)为防止乳酸亚铁变质,在上述体系中还应加入________。(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为__________________。
排尽装置内的空气,防止Fe2+被氧化
关闭活塞3,打开活塞2
KSCN溶液与新制氯水
关键能力 归纳提升1.Fe2+、Fe3+的检验对比(1)直接观察颜色(2)利用氢氧化物沉淀的颜色
(3)利用显色反应(4)利用Fe2+的还原性
(5)利用Fe3+的氧化性
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为少量固体 紫红色褪去。①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化盐酸。②步骤a中,不能选用稀HNO3,原因是稀HNO3可以将Fe2+氧化为Fe3+。
1.人类最早发现铁是从天上落下的陨石,埃及人把铁叫做“天石”。下列有关铁及其化合物的说法正确的是( )A.铁的氧化物有FeO、Fe2O3、Fe3O4,它们都是黑色的固体B.铁的氢氧化物Fe(OH)2、Fe(OH)3的混合物可能是灰绿色C.鉴别Fe2+中混有Fe3+,可先加入Cl2水,再加入KSCN溶液D.铁的合金生铁比纯铁硬度大,熔点高
2.化学是一门以实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是( )A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色B.向FeSO4中滴加NaOH溶液,沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色C.向Fe(NO3)2溶液中滴加稀硫酸,能使溶液由浅绿色变为棕黄色D.向FeSO4中滴加少量酸性高锰酸钾溶液,能使溶液由浅绿色变为浅紫红色
3.下列关于氢氧化亚铁及其制备方法的叙述中,不正确的是 ( )A.氢氧化亚铁易被空气氧化B.氢氧化亚铁为灰绿色絮状沉淀C. 可利用如图所示装置制备氢氧化亚铁D.实验中所用氢氧化钠溶液应预先煮沸
4.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )A.a可与e反应生成bB.b既可被氧化,也可被还原C.可将e加入浓碱液中制得d的胶体D.可存在b→c→d→e→b的循环转化关系
5.实验室用FeCl2和烧碱制备Fe(OH)2,为了生成的产物不容易被氧化,下列说法不正确的是( )A.配制FeCl2和烧碱溶液所用的蒸馏水通常要煮沸B.可在FeCl2溶液的上面加一层苯,以隔绝空气C.向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴不能伸入试管内D.产生Fe(OH)2沉淀后,不能振荡试管
6.下列说法正确的是( )A.Fe2(SO4)3易溶于水,故可用作净水剂B.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象C.根据下图可观察Fe(OH)2的生成D.Fe2O3是碱性氧化物,故Fe2O3可用作红色油漆和涂料
7.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )A.一定有Fe2+,一定没有Fe3+、Mg2+B.一定有Fe3+,可能有Fe2+,一定没有Mg2+C.一定有Fe3+,一定没有Fe2+、Mg2+D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
8.下列关于铁的氧化物说法不正确的是( )A.铁的氧化物通常状况下都是有色固体B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+C.氧化铁是铁锈的主要成分,因此氧化铁俗称铁锈D.工业上常使用铁的氧化物作原料冶炼铁
9.有FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻1.6 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 ml·L-1的盐酸的体积为( )A.200 mL B.100 mLC.50 mL D.无法计算
解析:FeO、Fe2O3的混合物若干克,在CO气流中加热充分反应,生成Fe,冷却后称剩余固体比原混合物质量减轻1.6 g,则减少的质量为O元素的质量,物质的量是0.1 ml。将FeO、Fe2O3的混合物与盐酸反应生成FeCl2、FeCl3的混合物,相当于其中的O被Cl代替,根据化合价守恒,1个O被2个Cl代替,所以需1 ml·L-1的盐酸的体积V(HCl)=0.2 ml÷1 ml·L-1=0.2 L,即200 mL。
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是________。A中反应的离子方程式是______________________。(2)实验开始时先将止水夹a________(填“打开”或“关闭”)。(3)简述生成Fe(OH)2的操作过程___________________________________________________________。(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为____________________________。
Fe+2H+===Fe2++H2↑
待A装置反应一段时间后关闭止水夹a,产生的H2将FeSO4溶液压入B中进行反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2FeCl2+Cl2===2FeCl3
解析:(1)在反应中Fe2+作还原剂,体现还原性,因此应选择氧化剂,所以选用新制氯水,反应为2FeCl2+Cl2===2FeCl3。(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe===3Fe2+,所以溶液由棕黄色变为浅绿色。向溶液中滴加硫氰化钾溶液,溶液不变血红色。
相关课件
这是一份高中化学苏教版 (2019)必修 第二册专题9 金属与人类文明第二单元 探究铁及其化合物的转化备课课件ppt,共58页。PPT课件主要包含了图说考点,基础知识,技能素养,课堂检测,烧杯和玻璃棒,Cu和Fe,答案B,答案D,溶液变成蓝色,答案A等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化一等奖ppt课件,共17页。PPT课件主要包含了转化路径的设计,转化路径的选择,学以致用等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化优秀ppt课件,共27页。PPT课件主要包含了铁单质陨铁,化合态,磁铁矿Fe3O4,铁的存在,游离态,典型的变价金属,HNO3过量,Fe过量,H2Og,浓硝酸等内容,欢迎下载使用。










