




所属成套资源:2024春高中化学人教版必修第二册课件、课后训练、单元测试多份
- 2024春高中化学第5章化工生产中的重要非金属元素第2节氮及其化合物第1课时氮气与氮的固定一氧化氮和二氧化课后训练(人教版必修第二册) 试卷 0 次下载
- 2024春高中化学第5章化工生产中的重要非金属元素第1节硫及其化合物第2课时硫酸不同价态含硫物质的转化课件(人教版必修第二册) 课件 0 次下载
- 2024春高中化学第5章化工生产中的重要非金属元素第1节硫及其化合物第2课时硫酸不同价态含硫物质的转化课后训练(人教版必修第二册) 试卷 0 次下载
- 2024春高中化学第5章化工生产中的重要非金属元素第1节硫及其化合物第1课时硫和二氧化硫课后训练(人教版必修第二册) 试卷 0 次下载
- 2024春高中化学第6章化学反应与能量过关检测卷(人教版必修第二册) 试卷 0 次下载
高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物示范课课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物示范课课件ppt,共52页。PPT课件主要包含了重难归纳,答案D等内容,欢迎下载使用。
1.能说出硫元素在自然界中的主要存在形式以及含硫物质的主要来源。2.能基于客观事实和实验探究认识单质硫、二氧化硫、硫酸等物质的主要化学性质及应用。3.能结合实例,从物质类别和元素价态角度认识含硫物质之间的转化及其在资源综合利用和环境保护中的作用。4.能基于二氧化硫、硫酸等的性质,设计制备、分离、提纯、检验等简单任务的方案。
第1课时 硫和二氧化硫
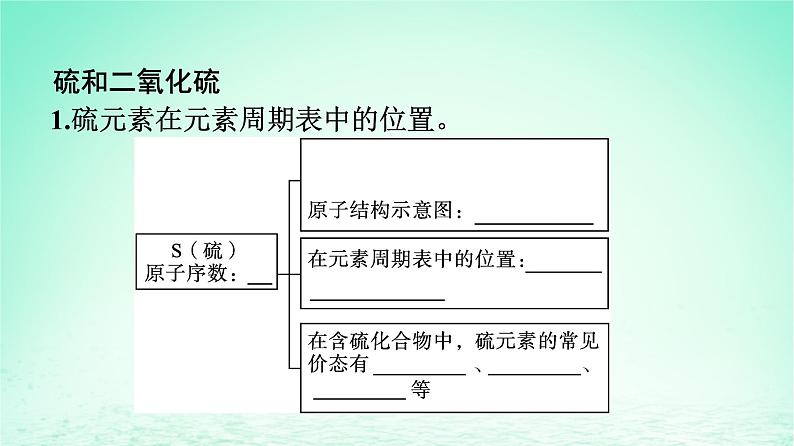
硫和二氧化硫1.硫元素在元素周期表中的位置。
2.硫的物理性质。硫俗称硫黄,是黄色晶体,质脆,易研成粉末。硫的密度约为水的 2 倍。硫难溶于水,微溶于酒精,易溶于二硫化碳。
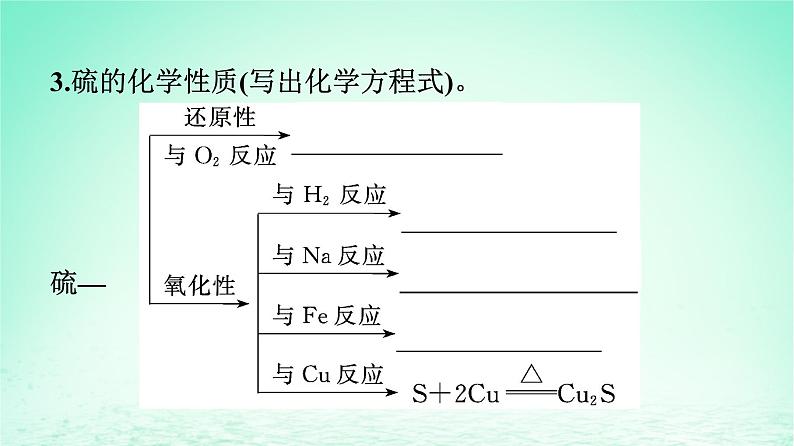
3.硫的化学性质(写出化学方程式)。硫—
微判断(1)可以用蒸馏水清洗试管内壁残留的硫。( )(2)硫的氧化性较弱,与变价金属反应生成低价态硫化物。( )(3)S在空气中燃烧生成SO2,在过量的纯O2中燃烧生成SO3。( )
4.二氧化硫(SO2)。(1)物理性质。二氧化硫是一种无色气体,有刺激性气味,密度比空气的密度大,易溶于水。
(2)化学性质。①酸性氧化物的通性(写出化学方程式)。
②氧化性与还原性:SO2中硫元素为 +4 价,既有氧化性又有还原性,SO2与氧气、硫化氢反应的化学方程式:
③漂白性:SO2能与某些有色物质生成不稳定的无色物质。例如SO2可使品红溶液褪色。这些无色物质容易分解而使有色物质恢复原来的颜色。
微思考2设计实验方案证明一种无色气体是SO2。提示:将无色气体通入盛有品红溶液的试管中,品红溶液褪色,然后加热试管,无色溶液又恢复红色。证明通入的无色气体是SO2。
(3)用途。工业上常用二氧化硫漂白纸浆、毛、丝等。二氧化硫还可以用于杀菌消毒和作食品添加剂。
微训练下列关于SO2的说法中,不正确的是( )。A.使某些有色物质褪色B.无色,有刺激性气味,无毒C.既有氧化性,又有还原性D.既可溶于水,又可与水反应答案:B解析:SO2为有毒气体;SO2具有漂白性,且SO2中硫元素处于中间价态(+4价),既有氧化性,又有还原性;SO2能溶于水,也可与水反应。
一 从物质类别和元素化合价角度理解硫单质的化学性质
问题探究作为我国古代四大发明之一,黑火药主要是由硝酸钾、硫黄、木炭三者粉末所组成的混合物。黑火药在点燃条件下,发生的化学反应主要为KNO3+S+C→N2↑+CO2↑+K2S(未配平)。
(1)在黑火药燃烧的反应中,硫元素的化合价如何变化?反应中S表现出什么性质?提示:硫元素的化合价由0价降为-2价,S表现出氧化性。(2)能否通过比较Fe与Cl2反应及Fe与S反应的产物来判断Cl2与S的氧化性?提示:能。因Cl2可以把Fe氧化成高价态,而S把铁氧化成低价态,故Cl2的氧化性强于S的氧化性。
(3)东汉魏伯阳在《周易参同契》中对汞有如下描述:“得火则飞,不见埃尘。鬼隐龙匿,莫知所存。将欲制之,黄芽为根。”这里的“黄芽”指什么物质?你能写出发生反应的化学方程式吗?提示:硫,Hg+S══HgS。
典例剖析【例1】下列说法中不正确的是( )。A.硫是一种黄色的难溶于水的固体B.硫原子的失电子能力比氧原子的强C.硫与铜反应生成CuS,表现了硫单质的氧化性D.硫在空气中和在氧气中燃烧都只生成二氧化硫答案:C
解析:A项,硫是一种黄色固体,难溶于水,正确;B项,与同主族的氧元素相比,硫元素的原子多一个电子层,原子失电子能力相对较强,正确;C项,硫与铜反应时,硫得电子作氧化剂,但产物为Cu2S,错误;D项,硫在空气中和在氧气中燃烧都只生成二氧化硫,燃烧产物与氧气用量和浓度无关,正确。
特别提醒(1)无论氧气是否过量,硫在氧气或空气中燃烧都只能生成SO2,不能生成SO3。
(2)硫与O2等较活泼非金属反应时表现还原性,硫与H2、金属反应时表现氧化性。
(3)硫单质与变价金属反应时通常生成低价态金属硫化物,氯气与变价金属反应时生成高价态金属氯化物,反应产物均与反应物的用量无关,故氧化性:Cl2>S。
2.下列化合物不能由两种单质直接化合而成的是( )。A.Al2S3D.FeCl3答案:B解析:S与变价金属反应,一般生成低价态金属硫化物,如Fe、Cu与S反应分别生成FeS、Cu2S,而Cl2的氧化性强,与变价金属反应一般生成高价态金属氯化物,如Fe、Cu与Cl2反应分别生成FeCl3、CuCl2,Al、Na无变价,可与单质S、O2直接化合生成Al2S3、Na2O、Na2O2,B项错误。
二 二氧化硫的性质综合应用
问题探究二氧化硫可作食品添加剂,食品中添加适量二氧化硫可以起到保鲜、防腐和抗氧化的作用。如仔细观察葡萄酒的标签,会发现标注了“含二氧化硫”。但是过量使用二氧化硫会带来食品安全问题。
(1)葡萄酒中加入适量SO2,主要利用了SO2的什么性质?提示:主要利用SO2的还原性,少量的SO2可以防止葡萄酒氧化变质。(2)SO2可以作为草编工艺品的美白剂,这利用了SO2的什么性质?为什么用SO2漂白的草帽时间久了会变色?提示:利用SO2的漂白性。二氧化硫的漂白性是可逆的。
(3)SO2和CO2都能使澄清石灰水变浑浊,当两者同时存在时如何检验。
重难归纳1.探究SO2的性质。
[总结]SO2的性质。
2.SO2的漂白性。(1)SO2的漂白作用具有选择性,可以漂白品红溶液,以及棉、麻等物品,但不能漂白酸碱指示剂,如石蕊。(2)SO2能使溴水、酸性KMnO4溶液褪色,是因为SO2的还原性而非漂白性。
3.常见的具有漂白作用的物质。
典例剖析【例2】下列实验能证明气体中存在SO2的是( )。A.能使澄清石灰水变浑浊B.能使湿润的蓝色石蕊试纸变红C.通入足量的NaOH溶液中,然后滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸D.通入新制氯水中,能使新制氯水褪色,然后滴加BaCl2溶液有白色沉淀生成答案:D
解析:CO2、SO2都属于酸性氧化物,性质上有相似之处,如两者都具有酸性氧化物的通性,都能使澄清石灰水先变浑浊后变澄清,都能使湿润的蓝色石蕊试纸变红;在碱性环境中,通入BaCl2溶液中均产生能溶于稀盐酸的沉淀等。但SO2通入新制氯水中发生反应:SO2+Cl2+2H2O═H2SO4+2HCl,使新制氯水褪色,然后滴加BaCl2溶液产生白色沉淀,CO2不具备该性质,故选D项。
学以致用3.检验SO2气体中是否混有CO2气体,可采用的方法是( )。A.通过品红溶液B.通过澄清石灰水C.先通过NaHCO3溶液,再通过澄清石灰水D.先通过足量酸性KMnO4溶液,再通过澄清石灰水答案:D
解析:A项检验的是SO2而不是CO2;B项中不管是否混有CO2,溶液均变浑浊;C项中不管是否混有CO2,澄清石灰水中均有白色沉淀生成;D项在通过酸性KMnO4溶液时混合气体中仅SO2被吸收,再通过澄清石灰水若有浑浊现象,说明混有CO2,若无浑浊现象,说明不混有CO2。综上分析,D项正确。
4.如图是研究二氧化硫性质的微型实验装置。现用60%的H2SO4溶液与亚硫酸钠晶体反应制取SO2气体,加入试剂后在培养皿上盖上玻璃片,实验现象很明显,且不易污染空气。下列说法中错误的是( )。A.紫色石蕊溶液变蓝色B.品红溶液褪色C.溴水褪色D.含酚酞的NaOH溶液红色变浅答案:A
解析:SO2的水溶液显酸性,能使紫色石蕊溶液变红,A项错误;SO2具有漂白性,能使品红溶液褪色,B项正确;SO2具有还原性,与溴水发生反应:Br2+SO2+2H2O═H2SO4+2HBr,能使溴水褪色,C项正确;SO2能与NaOH溶液反应生成Na2SO3,使含酚酞的NaOH溶液红色变浅,D项正确。
规律总结SO2和氯水的漂白性比较。
(1)紫色石蕊溶液中通入SO2或Cl2。紫色石蕊溶液—
(3)通入Cl2或SO2都可使含酚酞的NaOH溶液褪色,前者褪色的原因可能有两种,一种是因为Cl2与H2O反应生成了具有漂白性的物质HClO,另一种是酸中和了NaOH溶液;后者是因为SO2为酸性氧化物,能与NaOH反应。
1.下列关于硫的叙述正确的是( )。A.硫的化学性质比较活泼,所以硫在自然界中仅以化合态存在B.分离黑火药中的硝酸钾、木炭、硫黄要用到二硫化碳、水及过滤、蒸发操作C.硫与金属单质反应时作氧化剂,与非金属单质反应均作还原剂D.硫单质在常温下不与任何物质反应答案:B
解析:硫单质比较活泼,但在自然界中也有游离态的硫,A项错误;黑火药中的硫黄溶于CS2后过滤,将滤液蒸发得到晶体硫,滤渣再加水溶解过滤,新的滤渣为木炭,蒸发滤液,浓缩结晶得到硝酸钾,B项正确;硫与金属单质、H2反应时作氧化剂,与O2等强氧化性非金属单质反应时作还原剂,C项错误;常温下,硫单质可以与汞等物质反应,D项错误。
答案:C解析:根据可逆反应的特点,1 ml O2与2 ml SO2反应,不可能生成2 ml SO3。
3.下列物质均有漂白作用,但其中一种的漂白原理与其他三种不同,它是( )。A.HClOB.SO2C.O3D.Na2O2答案:B解析:漂白作用机理主要包括强氧化漂白(如O3、Na2O2、HClO等)、化合漂白(如SO2)和吸附性物理漂白(如活性炭)。
4.SO2与CO2的性质既有相似之处,又有不同之处。(1)若将CO2持续不断地通入Ba(OH)2溶液中,有关实验现象为 。 若将SO2持续不断地通入Ba(OH)2溶液中,有关反应的化学方程式为 , 。
(2)在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列两种气体:A.Cl2,B.H2S,均会产生沉淀。回答下列问题。①通入两种气体时产生的沉淀分别是A. ,B. 。 ②用离子方程式表示A和B产生沉淀的原因:A ; B 。
答案:(1)先有白色沉淀生成,而后白色沉淀消失SO2+Ba(OH)2══BaSO3↓+H2O SO2+BaSO3+H2O══Ba(HSO3)2(2)①BaSO4 S
(或SO2+Cl2+2H2O+Ba2+══BaSO4↓+2Cl-+4H+) 2H2S+SO2══3S↓+2H2O(或2H2S+H2SO3══3S↓+3H2O)
相关课件
这是一份高中化学第一节 硫及其化合物集体备课课件ppt,共52页。PPT课件主要包含了第一节硫及其化合物,新课情景呈现,课前素能奠基,O2不足,SO2,Fe或Cu,O2足量,H2S,Cl2,课堂素能探究等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评课ppt课件,共52页。PPT课件主要包含了第一节硫及其化合物,新课情景呈现,课前素能奠基,理性质,第三周期第ⅥA族,刺激性,试管中液面上升,溶液红色褪去,恢复红色,SO2易溶于水等内容,欢迎下载使用。
这是一份化学必修 第二册第一节 硫及其化合物教学ppt课件,共47页。










