





所属成套资源:鲁科版高中化学必修第一册 PPT课件
高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量示范课ppt课件
展开
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量示范课ppt课件,共15页。
物质的量是怎样把物质的宏观量与所含微观粒子的数量联系起来的呢?要解决这一问题,就需要研究 1 ml不同物质的质量和体积究竟是多少。
二、摩尔质量和气体摩尔体积
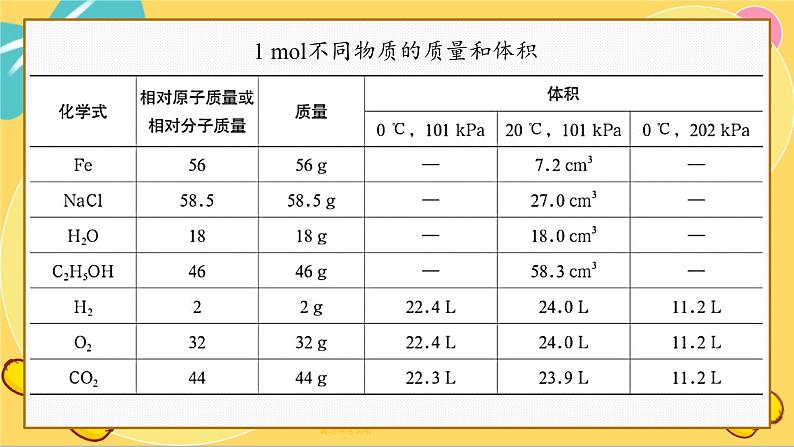
1 ml不同物质的质量和体积
由上表可以看出,1 ml 任何物质的质量,以克为单位时,在数值上都等于它的相对原子质量或相对分子质量。人们将单位物质的量的物质所具有的质量叫作摩尔质量。其常用单位为g·ml-1或 kg·ml-1。
根据上式可以进行物质的质量和物质的量之间的换算。例如,氧气的摩尔质量为32 g·ml-1,那么64 g 氧气的物质的量就是 2 ml;氯化钠的摩尔质量为 58.5g·ml-1,那么0.4 ml NaCl的质量就是 23.4 g。
对于气体来说,分子之间的平均距离比分子直径大得多,因此粒子数目相同的情况下,气体体积的大小主要取决于气体分子之间的平均距离。在相同的温度和压强下,气体分子之间的平均距离近似相等,所以1 ml任何气体的体积基本相同。
人们将一定温度和压强下,单位物质的量的气体所占有的体积叫作气体摩尔体积,其常用单位为L·ml-1或m·ml-1。标准状况(standard temperature and pressure,简写为 STP,指温度为0℃、压强为 101 kPa的状况)下,气体摩尔体积约为 22.4 L·ml-1(为了计算方便,一般可看作 22.4 L·ml-1)
根据上式可以进行气体体积和气体的物质的量之间的换算。例如,在标准状况下,33.6L 氧气的物质的量为 1.5 ml,2 ml CO2的体积为44.8 L。
阿伏加德罗定律1.内容:同温同压下,相同体积的任何气体都含有相同数目的分子。2.内容总结:“三同”定“一同”
标准状况下,气体摩尔体积的相关计算
(1)同温同压下:任何气体的摩尔体积Vm都相同,但不一定等于22.4 L·ml-1。(2)不能混淆标准状况和常温常压,两者压强相同,但温度不同。因为温度升高气体分子之间的距离变大,所以常温常压下的气体摩尔体积比标准状况下的气体摩尔体积大。(3)气体摩尔体积不能理解为体积,体积的单位是L或m3,而气体摩尔体积的单位是L·ml-1或m3·ml-1。
正确理解阿伏加德罗定律的应用(1)阿伏加德罗定律的适用对象是气体(单一气体或混合气体),不适用于液体或固体。(2)“三同”定“一同”。同温、同压、同体积和同分子数,四“同”共同存在,相互制约,只要有三“同”成立,则另一“同”就必定成立。
(3)“二同”定比例。温度、压强、气体体积、气体物质的量,若两个量相同,则另两个量成正比或反比。(4)气体摩尔体积是阿伏加德罗定律的一个特例。
相关课件
这是一份高中化学鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教案配套课件ppt,共14页。PPT课件主要包含了课堂探究等内容,欢迎下载使用。
这是一份化学必修第一册摩尔质量 气体摩尔体积习题ppt课件,共8页。
这是一份鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教课ppt课件,共39页。PPT课件主要包含了知识网络,学业基础,单位物质的量,L·mol-1,m3·mol-1,分子数,答案D,答案B,答案C,核心素养等内容,欢迎下载使用。










