



苏教版 (2019)必修 第一册第二单元 物质的化学计量示范课ppt课件
展开第二单元 物质的化学计量课时 3 2.2 气体摩尔体积
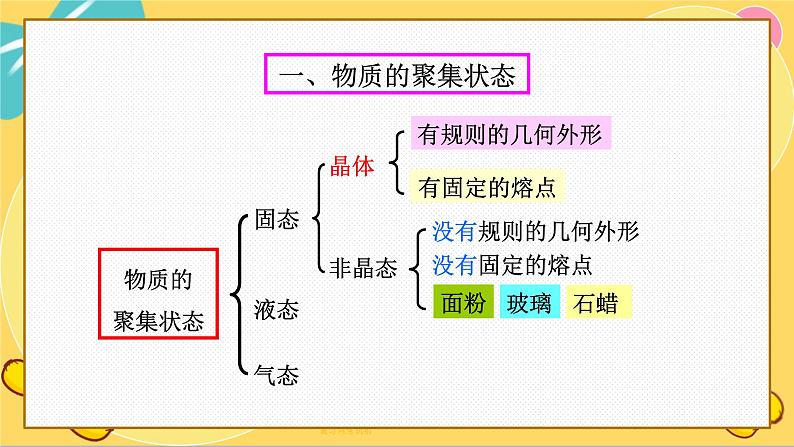
专题1 物质的分类及计量
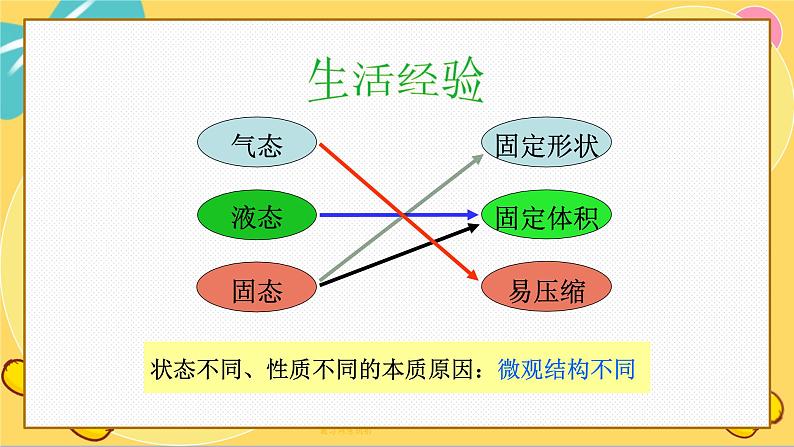
状态不同、性质不同的本质原因:微观结构不同
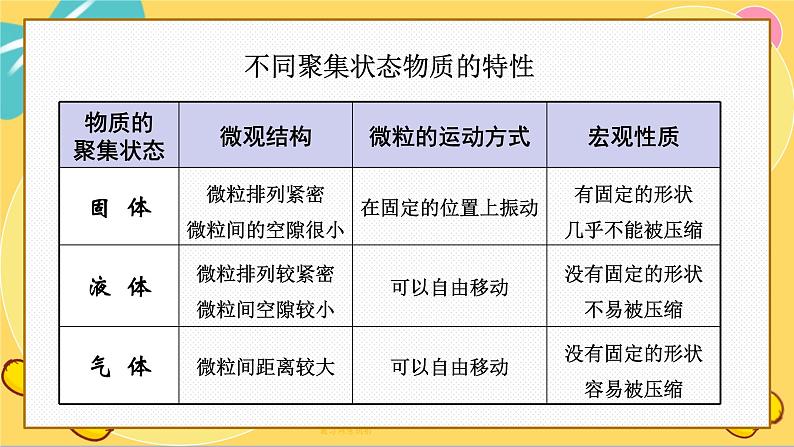
不同聚集状态物质的特性
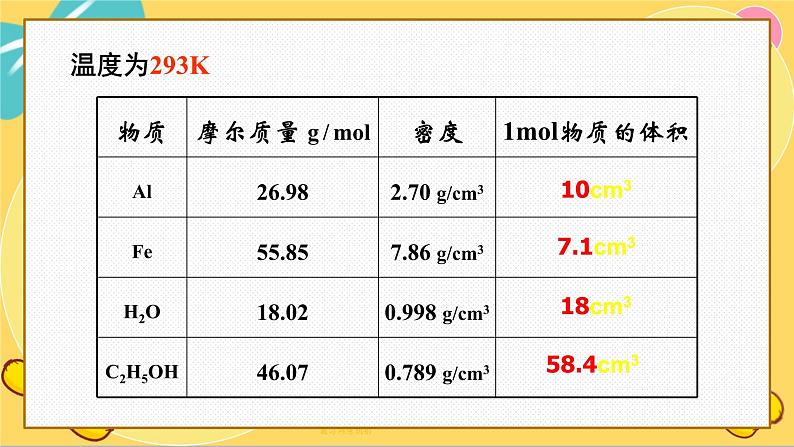
温度为273K,压强为1.01×105Pa
1ml 不同的固态、液态物质体积不同
1、1ml不同物质的体积:
二、影响物质体积的因素
温度为273K,压强为1.01×105Pa
1ml不同的气态物质,体积大约相同
仔细对比物质的体积微观模型,你能说出决定物质体积的因素吗?
2、影响物质体积大小的因素:
1、1ml固体、液体的体积主要决定于组成它们的微粒大小。
2、相同条件下,1ml气体的体积主要决定于分子间的距离。
分子间距大约是分子直径的10倍
科学证明:在温度和压强一定时,任何气体分子间的平均距离是相等!叙述气体体积时一定要指明温度和压强!
1.定义:单位物质的量的气体所占的体积。2.符号:Vm3.单位:L/ml 或 L·ml-1、m3/ml等4.对象:任何气体(纯净或混合气体)
★标准状况 ( 温度0℃(273K)、压强 1.01×105 Pa )下 1ml任何气体体积约:22.4L
答案:气体的体积在分子个数、温度、压强一定时,决定于气体的分子间平均距离,而与分子种类无关。
为什么说气体摩尔体积也适用于混合气体?
1. 标准状况下,1ml任何物质的体积都约是22.4L。
2. 1ml气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1mlO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/ml)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/ml。
条件:标准状况 对象:任何气体物质的量:1ml
标准状况下的气体摩尔体积的要点:
1ml任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。
5. 5克氨在标准状况时体积是多少?
解: 氨的式量是17,
氨的摩尔质量是 17g/ml。
答:5. 5氨在标准状况时的体积是7. 2L。
V(NH3) = Vm×n (NH3) = 22. 4L/ml ×0. 32ml = 7. 2L
×22.4L/ml
1、下列叙述正确的是( ) A.1 ml任何气体的体积都约为22.4 L B.1 ml任何物质在标准状况下所占的体积都约为22.4 L C.标准状况下,1 ml水所占的体积是22.4 L D.标准状况下,22.4 L任何气体的物质的量都约为1 ml
气体的体积和物质的量的关系:
1. 标准状况下,1ml的CO2的体积为:_____2. 标准状况下,0.5ml的H2S的体积为:_____ 3. 标准状况下,44.8L的CH4的物质的量为:______ 含H的个数为:_________ 4. 标准状况下,6.72L的NH3的物质的量为:______ 质量为:_____
我们初中学过,50 mL的水 50 mL的酒精混合在一起的体积小于100 mL,那么在标准状况下的11.2 L的 O2和11.2 L H2混合在一起的体积是否等于22.4 L?如果混合气体被点燃后剩余气体在标准状况下体积是多少?
第二单元 物质的化学计量课时 4 2.1 气体摩尔体积
2、规律:阿伏加德罗定律中有“四同”: 同温、同压、同体积、同微粒数。 只要有任何“三同”,就可以定出另一同。
1、定义:同温同压下,相同体积的任何气体含有 相同数目的分子。
阿伏加德罗定律:三同定一同
3、在同温下,两种气体同体积又同分子数,则必然同压。
“四同”:同温、同压、同体积、同微粒数
1、同温同压下,同体积的两种气体必含有相同数目的分子。
2、同温同压下,同分子数目的两种气体必同体积。
p为压强 V为体积n为物质的量 R为常数T为温度
1、下列说法中不正确的是:
A、同温同压下,含有相同分子数的两种气体占有相同的体积。
B、同温同压下,相同质量的两种气体含有相同分子数。
C、同温同压下,2L O2和N2的混合气体与 2LCO2和CO的混合 气体含有相同分子数。
D、同温同压下,相同物质的量的两种气体占有相同的体积。
2、同温同压下,同体积的氨和硫化氢气体的质量比是 ;同质量的氨和硫化氢气体的体积比是 ;同质量的氨和硫化氢气体中所含氢原子个数比是 ;若两者所含氢原子个数相等,它们的物质的量之比是 。3、同温同压下,两种气体A和B的体积之比为 2 : 1,质量之比为 8 : 5,则A与B的密度之比为 ,摩尔质量之比为 。
学习“物质的量”之后,化学方程式表示的意义更为广泛,以锌和稀硫酸反应为例: Zn + H2SO4 === ZnSO4 + H2↑ 微粒数 1 1 1 1物质的量 1 ml 1 ml 1 ml 1 ml 质量 65 g 98 g 161 g 2 g
二、有关化学方程式的计算
Zn + H2SO4 === ZnSO4 + H2↑物质的量与质量 1 ml 1 ml 1 ml 2 g物质的量与气体体积(标准状况) 1 ml 1 ml 1 ml 22.4 L 质量与气体体积(标准状况) 65 g 98 g 161 g 22.4 L
1. 写出相关的化学方程式或由化学方程式找出关系式
2.在方程式下面标明有关的量(标明的量应为纯净物 的量,单位上下要相同。)
14 g Fe 与足量稀盐酸充分混合后,消耗 HCl 的物质的量为多少?生成标准状况下的H2多少升?
答:消耗 HCl 为 0.5 ml,生成的 H2 为 5.6 L。
4、实验室用6.5g Zn与足量盐酸完全反应。求生成H2的体积(标况下)。
答:生成 H2 的体积为 2.24 L。
定义:同温同压下,相同体积的任何气体含有相同数目的分子。规律:三同定一同
步骤:写、标、列、算、答
在标准状况 ( 温度 273 K、压强 1.01×105 Pa )下 1ml 任何气体体积约为22.4 L,你能计算出理想气体状态方程中常数 R 大概的数值吗?(R的单位Pa·m3·ml-1·K-1)
高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量示范课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量示范课课件ppt,共38页。PPT课件主要包含了气体摩尔体积,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题1 物质的分类及计量第二单元 物质的化学计量课堂教学ppt课件: 这是一份高中化学苏教版 (2019)必修 第一册专题1 物质的分类及计量第二单元 物质的化学计量课堂教学ppt课件,共24页。
高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量备课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 物质的化学计量备课课件ppt,共54页。PPT课件主要包含了×××√等内容,欢迎下载使用。













